2.400016 重庆,重庆医科大学第一附属医院神经内科;
3.400037 重庆,第三军医大学新桥医院:放射科
2.Department of Neurology, the First Affiliated Hospital of Chongqing Medical University, Chongqing, 400016, China;
3.Department of Radiology, Xinqiao Hospital, Third Military Medical University, Chongqing, 400037;
缺血性脑血管病的高发病率、高死亡率、高致残率和高复发率给患者及家庭、社会带来极大危害[1]。随着我国老龄社会的到来和饮食结构、习惯的改变,该病发病率增高,且发病年龄呈年轻化的趋势,缺血性脑血管病的防治日益严峻。时间窗内(4.5 h)超早期静脉使用重组人组织型纤溶酶原激活剂(recombinant tissue plasminogen activator,rt-PA)溶栓是目前FDA唯一批准且有效的治疗。时间窗外溶栓治疗因继发缺血再灌注损伤导致弊大于利,但从长远功能恢复的角度来看,病损区的功能恢复需要血流再通送去氧及其他营养物质,所以,血管再通是必要的,也就是说时间窗外溶栓(延长时间窗)也是必要的。如果能够对抗缺血再灌注损伤,无疑可以延长溶栓时间窗。已有研究提示,预先电刺激小脑顶核(fastigial nucleus stimulation,FNS)可以通过增加脑血流量、改善能量供应、减少局部炎症性反应等多方面启动中枢神经源性神经保护,从而发挥综合性的神经保护效应改善缺血再灌注损伤的预后[2, 3]。但是FNS启动的内源性神经保护作用在rt-PA 溶栓时间窗的研究甚少,rt-PA狭窄的溶栓时间窗使大多数的患者不能从这一有效的治疗中获益。内源性神经保护如果能拓宽rt-PA的溶栓时间窗,将会使更多的患者从该有效的治疗中获益。我们将FNS应用于是否能够延长或拓宽溶栓的时间窗,并从过氧化物酶体增殖物激活受体γ(per-oxisome proliferators activited receptor γ,PPARγ)依赖的炎性调控机制的角度探讨FNS影响溶栓预后的机制。
1 材料与方法 1.1 实验动物及分组实验动物为SPF级SD大鼠60只,雄性,体质量(280±50)g,由第三军医大学新桥医院实验动物中心提供。实验动物获得第三军医大学动物伦理委员会批准,许可编号:SYXK(渝)2012-0011。大鼠用随机数字法分成电刺激组(FNS组)和对照组,每组30只。FNS组预先电刺激小脑顶核1 h,两组制备大脑中动脉栓塞(middle cerebral artery occlusion,MCAO)大鼠模型后,分别于1、3、6、9、12、15 h后以尿激酶溶栓处理,每个时相点5只大鼠。
1.2 小脑顶核电刺激大鼠以10%水合氯醛按0.35 mL/kg腹腔注射麻醉,参照夏一鲁等[4]的实验方法。将大鼠固定在立体定位仪上(小脑电刺激仪由重庆大学理论电工研究所设计制作),剪开头皮,充分暴露颅骨,根据大鼠脑立体定位图谱进行左侧核团定位,小脑顶核(FN):以前囟为零点,正中线向后11.6 mm,正中线向右旁开1.2 mm,深5.6 mm,钻孔,插入双极针电极(100 μm),电流刺激强度为50 μA 的直角方波脉冲,频率70 Hz,时程0.5 ms,连续刺激1 h。观察出现血压升高,摆尾,立毛现象为电刺激成功。
1.3 大脑中动脉栓塞-溶栓再通大鼠模型术前禁食12 h,大鼠以10%水合氯醛按0.35 mL/kg 腹腔注射麻醉,自体血栓及模型的制备参照Busch等[5]报道的方法。显露麻醉大鼠左侧股静脉,将0.6 mL 静脉血吸入装有75 U凝血酶的注射器内,混匀,快速推入内径为0.53 mm腰麻管内,成型后推入PBS缓冲液,将血栓剪切为2.5 mm长的小栓子、固缩4 h,用PBS将12个质量好的小栓子吸入腰麻管内待用。切开颈部正中皮肤,分离结扎左侧翼腭动脉、颈外动脉颅外分支和颈外动脉远心端。将穿刺针插入并将 针尖端置于颈内外动脉分叉处,固定。血栓制成后4 h,夹闭颈总动脉,用50 μL PBS将栓子推入。将栓子推入后,根据实验要求,插入穿刺针、固定,将0.6 mL尿激酶溶液(10 mg/kg)沿颈外动脉缓慢推入,时间约为20 min。手术过程保持室温为37 ℃。
1.4 神经功能评分实验大鼠手术后放回笼中饲养,自由饮食,予以青霉素饮水,维持室温37 ℃。溶栓后72 h予以神经功能评估,参照Zea Longa 5分制评分标准,待大鼠麻醉清醒后进行评分:0分,无神经功能缺损症状;1分,轻度局灶性神经功能缺损(不能完全伸展左侧前肢);2分,中度局灶神经功能缺损(向左侧转圈);3分,重度神经功能缺损(向左侧倾斜);4分,不能自发行走,意识水平降低。
1.5 标本收集评分后以过量的水合氯醛麻醉处死,断头取脑,选择病灶侧大脑中动脉供血区的脑皮质,用锡箔纸包裹并标注,迅速置于液氮之中保存,用于检测PPARγ蛋白表达及髓过氧化物酶(myeloperoxidase,MPO)活性。
1.6 比色法检测中性粒细胞浸润情况比色法检测梗死侧皮质MPO的活性。大鼠处死后,取缺血侧脑组织100 mg加入质量分数为0.5%的溴化十六烷基三甲胺2 mL,超声粉碎(30 s×3次),4 ℃下10 000 r/min离心15 min,取上清液0.1 mL加入反应液2.9 mL,保持温度25 ℃,于分光光度计460 nm波长下立即扫描2 min。根据公式计算光密度值[D(460)]。
1.7 Western blot检测PPARγ蛋白表达制备10%SDS-聚丙烯酞胺凝胶电泳(SDS-PAGE)胶,上样,SDS-PAGE进行蛋白标本的垂直电泳,将硝酸纤维膜及滤纸浸泡在转移缓冲液中,从阴极到阳极依次叠放滤纸、凝胶、硝酸纤维膜、滤纸,将蛋白质电泳转移到硝酸纤维膜上,完成后封闭过夜,在硝酸纤维素膜上先后加入PPARγ多克隆抗体(稀释浓度均为1 ∶100)进行抗原抗体结合反应,DAB显色观察结果并照相。用Bandleader 3.0软件对Western blot条带进行灰度扫描,按下述公式分别计算3次实验中某蛋白的相对含量:蛋白相对含量=(该蛋白条带的灰度值-背景的灰度值)/(上样对照条带的灰度值一背景的灰度值),以此比值计算均数与标准差。
1.8 RT-PCR检测PPARγ mRNA表达水平PPARγ的引物正义链:5′-TGCGGAAGCCCTTTGGTGAC-3′,反义链:5′-GCAGCAGGTTGTCTTGGATGTC-3′,由重庆市海韵生物技术公司合成。总RNA抽提,cDNA 的合成,PCR扩增。取5 μL PCR产物在2.0%琼脂糖凝胶中电泳后,将凝胶在0.5 μg/mL溴化乙锭中浸泡10 min 染色,用Bio-Rad凝胶成像分析系统成像并测定PPARγ和β-actin的光密度值,以PPARγ与β-actin的光密度比值作为PPARγ mRNA的表达水平。
1.9 统计学处理使用SPSS 19.0 统计软件进行数据处理分析。结果用x±s表示,多组间差异比较行单因素方差分析,两两比较行t检验,检验水准α=0.05,P<0.05认为差异有统计学意义。
2 结果 2.1 神经功能评分两组大鼠评分随再灌注时间呈逐渐增高的趋势, 大鼠MCAO后15 h再灌注后评分结果显示,FNS组评分与对照组评分比较差异有统计学意义(P<0.05),其余各再灌注时间点FNS组评分与对照组相比,差异无统计学意义(P>0.05),但低于对照组(图 1)。
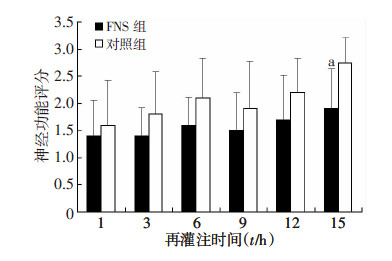 |
| a:P<0.05,与对照组比较 图 1 大鼠大脑中动脉栓塞-溶栓再通后72 h神经功能评分 |
Western blot检测结果显示3、6、9、12 h和15 h FNS组脑梗死区PPARγ表达水平与各自对照组比较差异有统计学意义(P<0.05);而1 h再灌注FNS组表达量与对照组比较差异无统计学意义(P>0.05)。RT-PCR检测结果提示3、6、9、15 h FNS组脑梗死区PPARγ表达水平与各自对照组比较差异有统计学意义(P<0.05);而1、12 h FNS组表达量与对照组比较差异无统计学意义(P>0.05);两组的PPARγ表达水平随再灌注时间的延长呈逐渐增高的趋势,表达高峰可能在梗死后9 h前后,9 h再灌注后表达水平明显下降(图 2、3)。
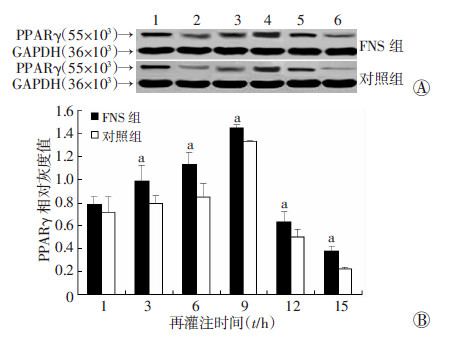 |
| A:Western blot检测结果 1:1 h; 2:3 h; 3:6 h; 4:9 h; 5:12 h; 6: 15 h;B:半定量分析结果 a:P<0.05,与对照组比较 图 2 Western blot检测各再灌注时间大鼠脑梗死皮质PPARγ 蛋白表达水平 |
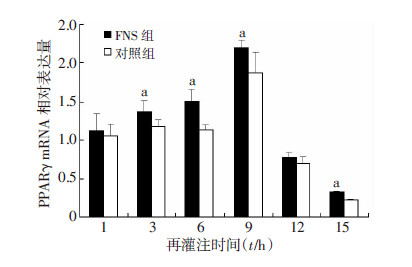 |
| a:P<0.05,与对照组比较 图 3 RT-PCR检测各再灌注时间大鼠脑梗死皮质PPARγ表达水平 |
3、6、9 h和12 h FNS组脑梗死边缘区MPO活性与对照组比较差异有统计学意义(P<0.05);而1、15 h FNS组与对照组比较差异无统计学意义(P>0.05);两组的表达水平随再灌注时间的延长呈逐渐增高的趋势(图 4)。
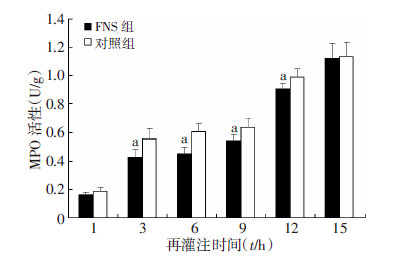 |
| a:P<0.05,与对照组比较 图 4 比色法检测大鼠脑梗死边缘区中性粒细胞浸润情况 |
缺血性脑卒中是目前世界位居第三的死亡原因,且幸存者多因遗留功能残障,生活质量受到极大的影响。目前时间窗内溶栓仍是改善预后的主要手段,但其狭窄的时间窗使得较少患者从中获益,原因在于rt-PA 的使用具有显著的时间依赖性。超时间窗溶栓的主要危害在于缺血后由延迟的再灌注损害所导致脑出血和严重脑水肿风险的显著增加,且随着缺血时间延长,由血流恢复引起的再灌注损伤则愈加严重。但长远来看,病损区血流再通无疑有助于患者后期功能的恢复和重建。因此,寻找延长局灶脑缺血的“溶栓治疗窗”的有效措施越来越引起大家的关注。已有研究提示FNS可有效激活多个内源性神经保护机制,且FNS目前已成品化,具有使用方便、无不良反应等多种优点[6, 7, 8]。将FNS应用于拓宽rt-PA的研究甚少,内源性神经保护作用在缺血性脑卒中的治疗和预防中可能有十分重要的意义。故本研究就预先电刺激小脑顶核对溶栓时间窗内、窗外溶栓预后的影响及其机制进行探讨,以寻找有效拓宽溶栓时间窗的方法和措施。
神经功能评分结果显示,预先电刺激能够改善溶栓时间窗外溶栓的预后。已有研究表明,炎症反应是缺血性脑损伤重要发病机制之一,在神经细胞的坏死和凋亡中起着关键作用[9]。PPARγ是PPAR家族的一种亚型,在中枢神经细胞和神经胶质细胞均有表达,与中枢神经系统有广泛且重要的联系,参与多种重要炎症调控[10]。研究表明动物脑梗死模型中使用PPARγ受体激动剂可激发神经保护,缩小脑梗死体积,而使用PPARγ受体拮抗剂使脑梗死面积增大[11, 12]。另有研究也证明PPARγ有介导脑梗死后的神经保护作用[13, 14]。本实验模型用大鼠自体血栓大脑中动脉栓塞模型[5],取缺血边缘区脑组织检测炎性指标,结果显示FNS组大脑皮质区PPARγ表达水平较对照组增加,并随着缺血再灌注时间的延长,表达量逐渐增多,在9 h再灌注前后达高峰,随后表达量减少,但仍高于对照组,一方面提示PPARγ介导的炎性调控作用在脑缺血损伤中可能发挥重要作用,另一方面提示FNS可通过激发PPARγ表达上调来发挥其内源性神经保护作用。MPO活性可以反映组织中中性粒细胞的浸润程度,活性越高,浸润越严重。检测脑梗死侧脑组织中性粒细胞浸润情况,结果显示FNS组与对照组随再灌注时间的延长MPO活性增加,但FNS组MPO活性较对照组低,较长溶栓时间点差异更显著,与神经功能评分趋势相符。
总之,本实验提示预先FNS对较长时间溶栓(时间窗外溶栓)的预后有一定的改善作用,但并不显著,这种对预后的改善可能是FNS通过激活PPARγ抑制过度炎性反应的损伤有关。后续将扩大样本量进一步明确FNS对溶栓时间窗的影响,并对其临床应用做进一步探讨。
| [1] | Feigin V L, Forouzanfar M H, Krishnamurthi R, et al. Global and regional burden of stroke during 1990-2010: findings from the Global Burden of Disease Study 2010[J]. Lancet, 2014, 383(9913): 245-254. |
| [2] | Golanov E V, Liu F, Reis D J. Stimulation of cerebellum protects hippocampal neurons from global ischemia[J]. Neuroreport, 1998, 9(5): 819-824. |
| [3] | Reis D J, Underwood M D, Berger S B, et al. Fastigial nucleus stimulation reduces the volume of cerebral infarction produced by occlusion of the middle cerebral artery in rat[M]//Seylaz J, MacKenzie E T. Neurotransmission and Cerebrovascular Function Ⅰ. New York: Elsevier Science,1989: 401-404. |
| [4] | 夏一鲁, 罗勇, 董为伟, 等. 电刺激小脑顶核对脑卒中大鼠的治疗作用与机制[J]. 中风与神经疾病杂志, 1999, 16(1): 3-5. DOI:10.3969/j.issn.1003-2754.1999.01.001 . |
| [5] | Busch E, Kruger K, Hossmann K A. Improved model of thromboembolic stroke and rt-PA induced reperfusion in the rat[J]. Brain Res, 1997, 788(1): 16-24. |
| [6] | Golanov E V, Zhou P. Neurogenic neuroprotection[J]. Cell Mol Neurobiol, 2003, 23(4/5): 651-663. |
| [7] | Liu J, Li J, Yang Y, et al. Neuronal apoptosis in cerebral ischemia/reperfusion area following electrical stimulation of fastigial nucleus[J]. Neural Regen Res, 2014, 9(7): 727-734. DOI:10.4103/1673-5374.131577 |
| [8] | Zhou P, Qian L, Zhou T, et al. Mitochondria are involved in the neurogenic neuroprotection conferred by stimulation of cerebellar fastigial nucleus[J]. J Neurochem, 2005, 95(1): 221-229. DOI:10.1111/j.1471-4159.2005.03358.x |
| [10] | Barreto G E, White R E, Xu L, et al. Effects of heat shock protein 72 (Hsp72) on evolution of astrocyte activation following stroke in the mouse[J]. Exp Neurol, 2012, 238(2): 284-296. DOI:10.1016/j.expneurol.2012.08.015 |
| [11] | LuoY, Yin W, Signore A P, et al. Neuroprotection against focal ischemic brain injury by the peroxisome proliferator-activated receptor-gamma agonist rosiglitazone[J]. J Neurochem, 2006, 97(2): 435-448. |
| [12] | Okami N, Narasimhan P, Yoshioka H, et al. Prevention of JNK phosphorylation as a mechanism for rosiglitazone in neuroprotection after transient cerebral ischemia: activation of dual specificity phosphatase[J]. J Cereb Blood Flow Metab, 2013, 33(1): 106-114. DOI:10.1038/jcbfm.2012.138 |
| [13] | Kinouchi T, Kitazato K T, Shimada K, et al. Activation of signal transducer and activator of transcription-3 by a peroxisome proliferator-activated receptor gamma agonist contributes to neuroprotection in the peri-infarct region after ischemia in oophorectomized rats[J]. Stroke, 2012, 43(2): 478-483. DOI:10.1161/STROKEAHA.111.618926 |
| [14] | Sun H, Xiong W, Arrick D M, et al. Low-dose alcohol consumption protects against transient focal cerebral ischemia in mice: possible role of PPARγ[J]. PLoS ONE, 2012, 7(7): e41716. DOI:10.1371/journal.pone.0041716 |
| [15] | Zhao X, Strong R, Zhang J, et al. Neuronal PPARgamma deficiency increases susceptibility to brain damage after cerebral ischemia[J].J Neurosci, 2009, 29(19): 6186-6195. DOI:10.1523/JNEUROSCI.5857-08.2009 |



