2.400037 重庆,第三军医大学新桥医院病理科
2.Department of Pathology, Xinqiao Hospital, Third Military Medical University, Chongqing,400037, China
Liu Mingyong, E-mail: 670199844@qq.com
脊髓损伤(spinal cord injury,SCI)发病率高、致残率高、病死率低,往往导致损伤节段以下肢体严重的功能障碍,严重影响患者生活质量。SCI后恢复期局部免疫反应对于神经组织损伤和神经功能恢复具有“双刃剑”中的有利作用,为神经功能的恢复所必需[1]。小胶质细胞(microglia)是中枢神经系统(central nervous system,CNS)的单核-巨噬细胞,是CNS固有的吞噬细胞,是中枢神经系统中的第一道也是最主要的一道免疫防线[2]。作为SCI后的主要炎症细胞,小胶质细胞在SCI后局部的浸润、聚集和吞噬功能与其预后密切相关。而炎症细胞的迁移是通过病原或者自体来源的趋化因子与相应的G蛋白偶联受体(G protein-coupled receptor,GPCR)结合而实现的,甲酰基肽受体(formylpeptide receptors,FPRs)是以趋化炎症细胞为主要功能的受体[3, 4]。人类FPRs包括FPR1、FPR2和FPR3,小鼠FPR1是人FPR1的类似物。目前FPR1与小胶质细胞迁移之间的关系及其机制尚不清楚。本研究以FPR1为切入点,基于BV-2小鼠小胶质细胞系,利用其特异性激动剂(formylmethionyl-leucyl-phenylalanine,fMLP)及特异性阻断剂(Boc-MLF)等药理学手段,结合Transwell、划痕实验及Western blot技术,探索FPR1与小胶质细胞迁移之间的关系及其可能机制,以期为临床SCI后的治疗及功能康复提供一定的理论依据。
1 材料与方法 1.1 材料BV-2细胞系购于上海斯信生物科技有限公司,改良型1640培养基(HyClone公司,美国),胎牛血清、Transwell 小室(Millipore公司,美国),fMLP及Boc-MLF、FPR1抗体(R&D公司,美国),BCA蛋白浓度测定试剂盒(碧云天公司,北京),ERK抗体及磷酸化细胞外信号调节激酶(phospho-extracellular regulate kinase,p-ERK)抗体、山羊抗兔IgG抗体(Abcam公司,美国)。二氧化碳培养箱(Thermo Forma公司,美国),Western blot电泳仪、转膜仪(六一公司,北京),倒置荧光显微镜(Olympus公司,美国),低温离心机、多功能酶标仪(Thermo scientific公司,美国)。
1.2 方法 1.2.1 BV-2细胞培养BV-2细胞培养于含10%胎牛血清的改良型1640培养基中,37 ℃、5%CO2孵育箱中生长,隔日换液,待贴壁细胞生长铺满瓶底时用0.25%胰酶消化离心后,进行传代培养。
1.2.2 BV-2细胞FPR1免疫荧光鉴定取对数期生长的BV-2细胞经胰酶消化后以3×105/mL接种于激光共聚焦培养皿中,置于细胞孵育箱中培养,待细胞生长状态及细胞密度适宜后,弃掉培养基,用PBS洗涤3次,加入4%多聚甲醛200 μL固定30 min,PBS洗涤3次,正常山羊血清室温封闭2 h,加入FPR1抗体(1 ∶1 000)100 μL,4 ℃孵育过夜,PBS洗涤3次,暗室中加入 荧光二抗(1 ∶200),室温孵育2 h,PBS洗涤3次,加入DAPI染核15 min,PBS洗涤3次,每次5 min,甘油封片后,激光共聚焦显微镜下拍照。
1.2.3 Transwell小室细胞迁移实验①检测FPR1在BV-2细胞迁移中的作用。将Transwell小室放入24孔板中,上室加入200 μL无血清细胞悬液,每孔细胞约10 000个。空白对照组:下室加入含有10%胎牛血清的培养基500 μL。激动剂组:下室分别加入含不同浓度fMLP(1、10、50、100、500 nmol/L)的培养基500 μL。②验证fMLP促进BV-2细胞迁移的作用可被Boc-MLF所抑制。实验共分为4组。空白对照组、激动剂组及阻断剂组的Transwell上室分别加入含10 000个细胞的无血清培养基200 μL。激动剂组:下室加入含100 nmol/L fMLP的培养基500 μL;阻断剂组:下室加入含5 μmol/L Boc-MLF的基础培养液500 μL;阻断剂组+激动剂组:预先用含5 μmol/L Boc-MLF的培养基干预20 min,用PBS洗涤3遍后,换用无血清培养基悬浮细胞后接种于Transwell上室,细胞量约为10 000个,下室加入含100 nmol/L fMLP的培养基500 μL。37 ℃、5% CO2条件下培养48 h后,用棉签擦除Transwell上室膜上的细胞后,将小室置于4%多聚甲醛中固定20 min,0.1%结晶紫染色15 min,用PBS漂洗3次,室温下静置24 h后,显微镜下随机挑选5个视野,计数迁移到下室的细胞数,并计算每个视野的平均迁移细胞数。
1.2.4 细胞划痕实验划痕实验进一步验证FPR1在BV-2细胞迁移中的作用可被Boc-MLF所抑制,将BV-2细胞接种至24孔板中,预先用含10%胎牛血清培养基培养至细胞铺满孔板底部,用20 μL枪头在各孔中心划1条宽度相等的划痕,用PBS漂洗刮落的细胞。分组情况、药物浓度及处理方法同1.2.3,在37 ℃、5%CO2条件下培养,分别于0、24 h在倒置显微镜下拍照。
1.2.5 Western blot检测将BV-2细胞随机分为空白对照组、激动剂组、阻断剂组、阻断剂+激动剂组。激动剂组:含100 nmol/L fMLP的培养基干预20 min;阻断剂组:含5 μmol/L Boc-MLF的培养基干预20 min;激动剂+阻断剂组:预先用含5 μmol/L Boc-MLF的培养基干预20 min后,用PBS洗涤3遍,再加入含5 μmol/L Boc-MLF的培养基干预20 min。收集各组处理后的细胞,提取总蛋白,采用Western blot检测各组FPR1、p-ERK、t-ERK蛋白表达水平,BCA测定蛋白浓度;取等量蛋白(20 μg),上样,电泳跑胶,转膜目的蛋白至PVDF膜后0.5% BSA 封闭2 h;加入一抗FPR1(1 ∶1 000)、p-ERK(1 ∶1 000)、t-ERK(1 ∶1 000)、Tubulin(1 ∶1 000)4 ℃过夜,PBST洗膜3次,每次10 min,二抗为HRP标记的山羊抗兔/小鼠IgG(1 ∶5 000)室温孵育2 h,洗膜3次,每次10 min;加显色剂,Chemi Doc XR+紫外凝胶成像仪扫描成像,条带分析测定使用Image Lab程序。
1.3 统计学方法应用SPSS 15.0统计软件,数据以x±s表示,多组间比较使用单因素方差分析。
2 结果 2.1 BV-2细胞中FPR1的鉴定经免疫荧光染色鉴定:BV-2细胞FPR1表达呈阳性(图 1)。
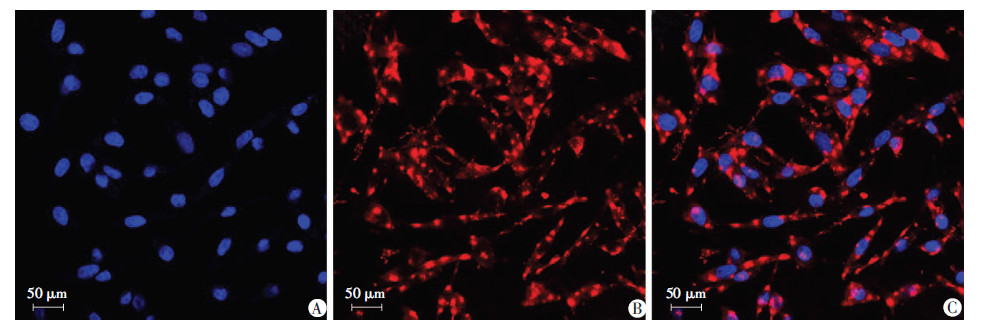 |
| A:细胞核(蓝色);B:FPR1膜表达(红色);C:融合 图 1 免疫荧光染色观察BV-2细胞表达FPR1 (激光共聚焦显微镜) |
使用不同浓度FPR1特异性激动剂fMLP(1、10、50、100、500 nmol/L)干预BV-2细胞48 h后,倒置相 差显微镜观察显示:随着fMLP浓度的增高,除1 nmol/L 组外,从Transwell上室迁移下室的细胞数量明显高于空白对照组(P<0.05,P<0.01)。其中100 nmol/L组和500 nmol/L组效果显著,fMLP促BV-2细胞迁移的适宜浓度为100 nmol/L(图 2、3)。
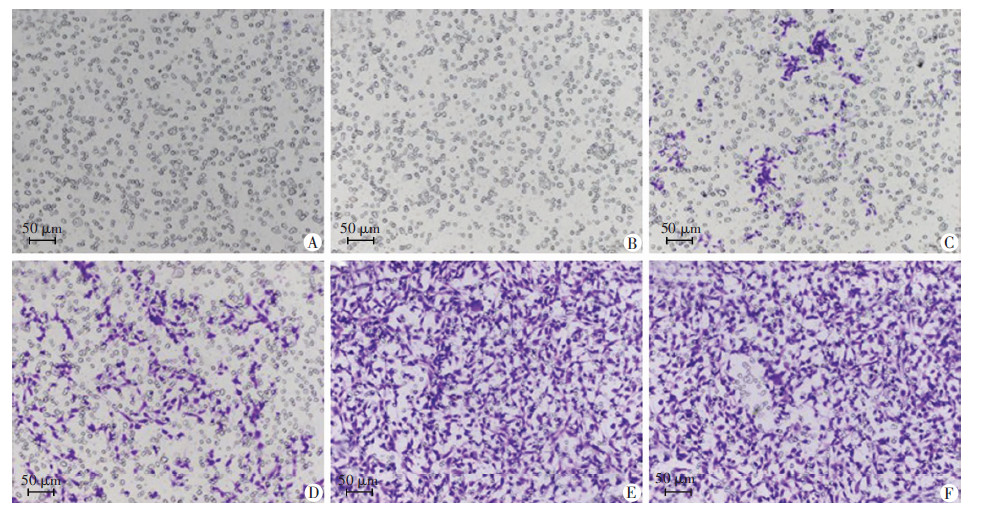 |
| A:空白对照组;B~F:激动剂组(分别为FPR1特异性激动剂fMLP终浓度为1、10、50、100、500 nmol/L) 图 2 Transwell证实fMLP能够促进BV-2细胞的迁移 (结晶紫) |
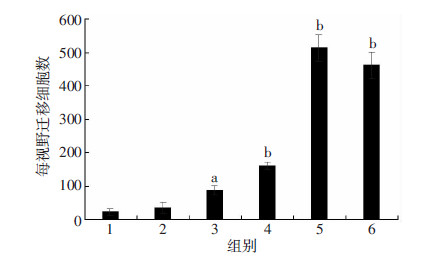 |
| 1:空白对照组;2~6:激动剂组(分别为FPR1特异性激动剂fMLP终浓度为1、10、50、100、500 nmol/L) a:P<0.05,b:P<0.01,与空白对照组比较 图 3 Transwell检测的定量分析结果 |
为了验证FPR1是否对BV-2细胞的迁移起到促进作用,我们采用划痕实验,结果证实:与空白对照组 相比,100 nmol/L fMLP的激动剂组能够显著促进BV-2 细胞的迁移,5 μmol/L的Boc-MLF阻断剂能抑制FPR1促进迁移的作用(图 4)。通过测量24 h后细胞迁移到划痕区域的相对面积,证实激动剂组是空白对照组的(2.94±0.56)倍,差异有统计学意义(P<0.01)。
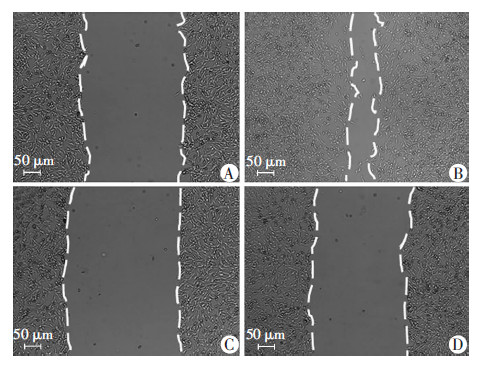 |
| A:空白对照组;B:激动剂组;C:阻断剂组;D:阻断剂+激动剂组 图 4 划痕实验检测FPR1对BV-2细胞的迁移能力的影响 (倒置相差显微镜) |
为了进一步验证FPR1对BV-2细胞的迁移作用,我们采用Transwell实验再次验证划痕实验所得结果。100 nmol/L fMLP的激动剂组较空白对照组能够显著促进BV-2细胞的迁移,其促进迁移的 效应能被阻断剂所抑制(图 5)。根据48 h后迁移的相对细胞数得出,激动剂组是空白对照组的(11.71±0.16)倍,差异有统计学意义(P<0.01)。此结果与细胞划痕实验结果一致,表明FPR1在BV-2细胞迁移中具有重要的作用。
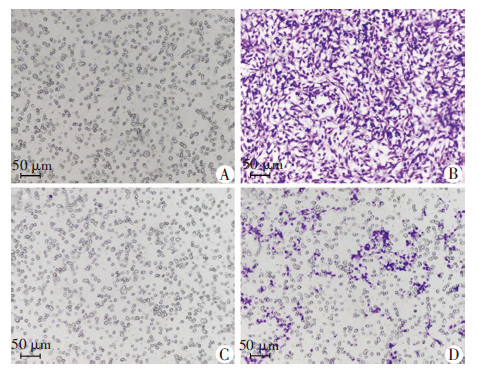 |
| A:空白对照组;B:激动剂组;C:阻断剂组;D:阻断剂+激动剂组 图 5 Transwell实验检测FPR1对BV-2细胞迁移能力的影响 (倒置相差显微镜) |
各组细胞经分别干预后,Western blot检测结果显示(图 6):与空白对照组相比,激动剂组FPR1蛋白表达水平升高(P<0.01);阻断剂+激动剂组的FPR1蛋白表达水平相比激动剂组降低(P<0.01)。这表明fMLP可以上调BV-2细胞FPR1蛋白的表达水平,此作用又可被Boc-MLF所抑制,证实激活FPR1可增强BV-2细胞的迁移。
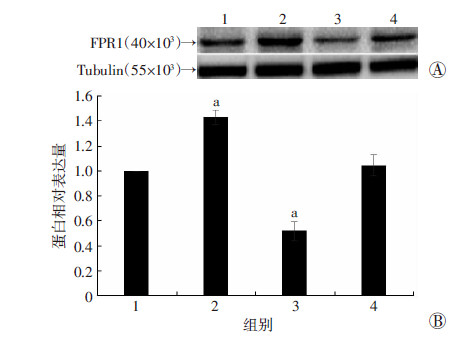 |
| 1:空白对照组;2:激动剂组;3:阻断剂组;4:阻断剂+激动剂组 A:Western blot检测结果;B:半定量分析结果 a:P<0.05,与空白对照组比较 图 6 Western blot检测各组BV-2细胞中FPR1蛋白的表达 |
各组细胞经分别干预后,Western blot检测结果显示(图 7):与空白对照组相比,激动剂组p-ERK蛋白表达水平升高(P<0.01);阻断剂+激动剂组的p-ERK蛋白表达水平相比激动剂组则又降低(P<0.05)。这表明ERK信号通路参与FPR1对BV-2细胞迁移能力的调控。
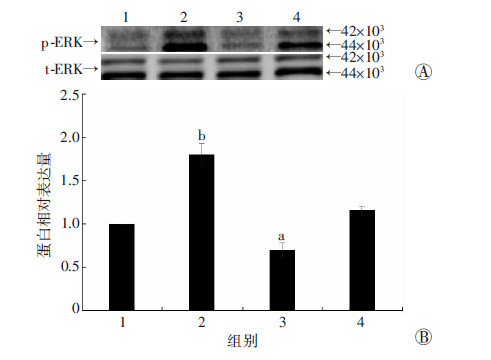 |
| 1:空白对照组;2:激动剂组;3:阻断剂组;4:阻断剂+激动剂组 A:Western blot检测结果;B:半定量分析结果 a:P<0.05,b:P<0.01,与空白对照组比较 图 7 Western blot检测各组BV-2细胞中p-ERK、t-ERK 蛋白的表达 |
SCI后的神经功能修复是困扰科学界的难题,以干细胞移植为代表的研究虽然取得了一定进展,但因移植细胞难以存活和分化,导致其临床应用治疗陷入困境。而SCI后局部微环境,尤其是免疫反应状态在其中起着至关重要的作用。小胶质细胞是神经胶质细胞的一种,相当于脑和脊髓中的巨噬细胞,是中枢神经系统的第一道也是最重要的免疫防线。SCI后,小胶质细胞不断清除损坏的神经细胞、斑块及感染性物质,以提供有利于神经再生的微环境、促进轴突和髓鞘再生[5, 6, 7]。因此,SCI后小胶质细胞参与的炎症反应对SCI的治疗效果和康复起着至关重要的作用。正常情况下,小胶质细胞的迁移数量和能力有限成为影响SCI后神经功能康复的一个重要因素。鉴于此,如何提高SCI后康复期小胶质细胞的迁移能力和增加小胶质细胞迁移的数量是目前研究的热点和焦点。
本课题组前期研究发现,敲除小鼠FPR基因导致吞噬性炎症细胞趋化能力障碍,在炎症区聚集减少,吞噬能力降低而导致创伤愈合延缓、细菌清除能力下降而致残率升高[8]。同时,有研究表明炎症细胞浸润、迁移是由病原或自体来源的趋化因子与相应的G蛋白偶联受体(G-protein-coupled receptor,GPCR)结合而实现的,FPR1作为GPCR的一种,是炎症细胞趋化的主要功能受体[9, 10]。本研究通过体外实验发现fMLP 对BV-2细胞的迁移能力具有促进作用,且具有浓度依赖性,最适浓度为100 nmol/L,该浓度下的fMLP 可明显上调BV-2细胞中FPR1蛋白的表达,并且p-ERK的蛋白水平也明显上调,提示在细胞外配体作用的情况下,可通过FPR1将信号转导至细胞内部引起ERK相关通路蛋白的活化,进而通过一系列内部信号转导通路,最终引起细胞运动蛋白的变化,如F-actin、Tubulin等,可增强BV-2细胞的运动能力,进而可能为SCI后的功能康复起到积极作用。研究表明,SCI损伤后的小胶质细胞活化可产生两种类型的小胶质细胞:M1型和M2型,脂多糖(lipopolysaccharide,LPS)和干扰素γ(interferon-γ,IFNγ)诱导的通过“经典活化的”(classically activated)促炎性M1小胶质细胞在SCI后起到持续性的损伤作用,而白介素-4(interleukin-4,IL-4)诱导的M2(alternatively activated)小胶质细胞在SCI后起到保护作用而促进轴突再生,对SCI的治疗和康复具有重要作用[11]。同时,本课题组前期研究表明:激活FPR1可使局部小胶质细胞向M2表型转换增多[12]。结合本研究的结果提示:FPR1的激活不仅可在损伤后功能康复中促进小胶质细胞的迁移能力,而且可促进小胶质细胞的表型转换,从两方面起到积极作用来提高康复效果。
综上所述,本研究从FPR1出发,基于小胶质细胞的细胞系BV-2,初步发现FPR1的激活可促进BV-2细胞的迁移及其潜在的分子机制ERK,为SCI后促进小胶质细胞向损伤部位迁移参与炎症反应提供了一个新靶点,也为fMLP向临床应用转化提供了一定的理论依据。同时,本研究也存在不足,FPR1促进小胶质细胞迁移是否存在其他信号通路,以及缺少动物实验验证。这也是我们下一步研究的方向。
| [1] | Held K S, Steward O, Blanc C, et al. Impaired immune responses following spinal cord injury lead to reduced ability to control viral infection[J]. Exp Neurol, 2010, 226(1): 242-253. DOI:10.1016/j.expneurol.2010.08.036 |
| [2] | Spitzbarth I, Bock P, Haist V, et al. Prominent microglial activation in the early proinflammatory immune response in naturally occurring canine spinal cord injury[J] . J Neuropathol Exp Neurol, 2011, 70(8): 703-714. DOI:10.1097/NEN.0b013e3182270f8e |
| [3] | Le Y, Murphy P M, Wang J M. Formyl-peptide receptors revisited[J]. Trends Immunol, 2002, 23(11): 541-548. |
| [4] | Riegger T, Conrad S, Liu K, et al. Spinal cord injury-induced immune depression syndrome (SCI-IDS)[J]. Eur J Neurosci, 2007, 25(6): 1743-1747. |
| [5] | Marcondes M C, Furtado G C, Wensky A, et al. Immune regulatory mechanisms influence early pathology in spinal cord injury and in spontaneous autoimmune encephalomyelitis[J]. Am J Pathol, 2005, 166(6): 1749-1760. |
| [6] | David S. Recruiting the immune response to promote long distance axon regeneration after spinal cord injury[J]. Prog Brain Res, 2002, 137: 407-414. |
| [7] | Weinstein J R, Koerner I P, Moller T. Microglia in ischemic brain injury[J]. Future Neurol, 2010, 5(2): 227-246. |
| [8] | Liu M, Chen K, Yoshimura T, et al. Formylpeptide receptors are critical for rapid neutrophil mobilization in host defense against Listeria monocytogenes[J]. Sci Rep, 2012, 2:786. DOI:10.1038/srep00786 |
| [9] | Devosse T, Dutoit R, Migeotte I, et al. Processing of HEBP1 by cathepsin D gives rise to F2L, the agonist of formyl peptide receptor 3[J]. J Immunol, 2011, 187(3): 1475-1485. DOI:10.4049/jimmunol.1003545 |
| [10] | Lee H Y, Lee S Y, Shin E H, et al. F2L, a peptide derived from heme-binding protein, inhibits formyl peptide receptor-mediated signaling[J]. Biochem Biophys Res Commun, 2007, 359(4): 985-990. DOI:10.1016/j.bbrc.2007.06.001 |
| [11] | Kigerl K A, Gensel J C, Ankeny D P, et al. Identification of two distinct macrophage subsets with divergent effects causing either neurotoxicity or regeneration in the injured mouse spinal cord[J]. J Neurosci, 2009, 29(43): 13435-13444. DOI:10.1523/JNEUROSCI.3257-09.2009 |
| [12] | Liu M, Zhao J, Chen K, et al. G protein-coupled receptor FPR1 as a pharmacologic target in inflammation and human glioblastoma[J]. Int Immunopharmacol, 2012, 14(3):283-288. DOI:10.1016/j.intimp.2012.07.015 |



