食管良性狭窄引起的吞咽困难临床较难解决,严重影响患者生活质量,并且引起严重并发症[1]。其治疗常采用探条扩张或球囊扩张,但其复发率较高[2, 3]。目前对难治性良性食管狭窄治疗主要是安装食管支架。食管支架可显著改善患者吞咽困难等症状[4]。但是各食管支架仍有缺点,如自扩张金属支架(self-expandable metal stents ,SEMS)易引起食管再狭窄[5]。自扩张塑料支架(self-expandable plastic stents,SEPS)具有较高的支架移位率(>62%)及缓解吞咽困难的时间较短[1]。可吸收支架(biodegrdable stents BDS)寿命一般只有6周,再狭窄发生率仍较高[6]。因此,目前对难治性良性食管狭窄还缺乏满意的治疗手段。
食管良性狭窄主要是由于瘢痕增生所致。目细胞凋亡与瘢痕增生、瘢痕疙瘩的形成具有密切的关系[7, 8]。我们前期的研究表明肿瘤坏死因子受体相关死亡域蛋白(tumor necrosis factor receptor associated death domain protein,TRADD)在瘢痕组织中的低表达,可能抑制了TNF-α介导的细胞凋亡途径,导致增生性瘢痕成纤维细胞(hypertrophic scar fibroblast,HSFb)的过度增殖及病理性瘢痕的形成[9, 10]。同时,我们利用慢病毒载体系统成功构建了携带人TRADD基因过表达慢病毒,将其转染入HSFb后,可使HSFb中TRADD蛋白表达恢复正常,可抑制HSFb的细胞增殖,影响细胞分裂,促进细胞凋亡,降低Ⅰ型胶原蛋白的分泌,从而减少HS的形成[9, 10]。
我们已采用氩离子凝固术(argon plasma coagulation,APC)成功构建实验犬动物模型,当APC功率在70 W,氩气流量2 L/min,作用时间3 s,可造成食管明显狭窄[11]。
因此,我们拟以APC构建实验犬食管狭窄模型,以全覆膜食管支架作为载体,将TRADD基因慢病毒转染入食管狭窄段组织,观察其抑制组织增生及防止再狭窄的效果。
1 材料与方法 1.1 实验动物成年健康毕格犬购自第三军医大学实验动物中心,并通过第三军医大学实验动物伦理委员会审查。实验犬体质量15~20kg,雌雄不限,共15只,称量,编号,采用随机数据表法将其分为实验组(实验犬4、7、10、14、15号)、对照组(实验犬1、2、3、6、13号)和空白组(实验犬5、8、9、11、12号),每组各5只。实验组拟置入TRADD基因慢病毒涂层支架,对照组置入慢病毒涂层支架,空白组置入普通带膜支架。饲养于第三军医大学实验动物中心实验犬饲养室。
1.2 病毒载体TRADD基因慢病毒过表达载体(2×10E8TU)及慢病毒过表达载体pLV X-EGFP-3FLAG-Puro(2×10E8TU)购自上海生博公司。
1.3 器材带膜食管支架(中国济南德尔曼科技有限公司,JiNan Derman KeJi Co.Ltd),规格1.8 cm×8 cm。 GIG-Q260胃镜(日本奥林巴斯公司),APC300/ICC200EA型氩离子凝固器(德国ERBE公司),AXIO Imager.A2,免疫荧光显微镜(德国蔡司公司)。
1.4 主要试剂RIPA裂解液、BCA蛋白浓度测定试剂盒购自江苏碧云天生物科技研究所。Rabbit Anti-TRADD,Mouse- Anti-collagenⅠ、collagenⅢ、Rabbit Anti-α-SMA四种抗体均购自ABCOM公司。Goat Anti-rabbit IgG、Goat Anti-mouse IgG购自中国中杉公司。Masson三色染色试剂盒(美国Sigma公司)
1.5 食管良性狭窄动物模型的构建实验方法参照文献[11]。每周复查,对建模不理想的实验犬可再次给予氩离子凝固器烧灼。直至动物模型符合食管支架安装标准,其标准为:实验犬出现明显吞咽困难、体质量减轻。胃镜直视下可见食管明显狭窄,且胃镜镜身不能通过食管狭窄段。
1.6 食管支架的安装及术后观察首先对食管狭窄处行球囊扩张。选用带膜镍钛记忆食管支架,将GFP-TRADD基因过表达慢病毒6×10E8TU均匀涂抹于带膜食管支架表面,涂抹后立即在胃镜引导下安置于食管狭窄表面。同时空白组安装普通带膜镍钛记忆支架,对照组安装慢病毒涂层食管支架。安装支架后第1周观察支架移位情况及食管狭窄的程度。经胃镜取出食管支架。术后第2、3周及第4周观察食管狭窄程度,同时观察实验犬进食情况及体质量变化情况。
1.7 实验犬食管标本提取安装支架4周后处死实验犬。方法同文献[11]。
1.8 组织HE检查分别取各实验犬食管狭窄段组织1块送至我院病理科医师行HE染色及病理检查。
1.9 Masson三色染色法检测分别取各实验犬食管狭窄段组织行Masson三色染色法检测组织中纤维组织含量。石蜡切片常规脱蜡,按Masson复合染色试剂盒实验方法操作。显微镜下观察。经Masson三色染色法后,胶原纤维呈蓝色,肌纤维呈红色,胞核染呈蓝黑色。Image-Pro plus 6.0对胶原纤维含量进行扫描分析,胶原纤维含量=胶原纤维面积/总面积×100%。
1.10 免疫荧光观察分别取3组实验犬食管狭窄处食管组织,行冰冻切片,切片厚度为10μm。免疫荧光显微镜观察食管组织.以观察TRADD基因慢病毒过表达载体转染情况。
1.11 Western blot检测食管组织转染TRADD基因慢病毒后TRADD-GFP-FLag融合蛋白的表达分别提取少许3组实验犬食管狭窄部位食管组织。取少许组织,加入200 μL RIPA 裂解液,匀浆器研磨至浆状,4 ℃ 10 000×g离心5 min,收集上清,BCA法测定蛋白浓度。聚丙烯酰胺凝胶(SDS-PAGE)变性电泳,继之半干法电转移法将蛋白印迹转移至PVDF膜上,5 g脱脂奶粉于常温下封闭2 h,TBS洗膜3次,每次10 min。加入一抗Mouse- Anti-ollagenⅠ、collagenⅢ、Rabbit Anti-α-SMA,4 ℃孵育过夜,洗膜。加入二抗Goat Anti-rabbit IgG、Goat Anti-mouse IgG,洗膜后以BCIP/NBT底物显色试剂盒显色。
1.12 Western blot检测3组食管狭窄部位组织中collagenⅠ、collagenⅢ、α-SMA三种蛋白表达方法同1.11,天能凝胶成像分析系统扫描条带并分析。以GAPDH作为内参,计算相对值。实验重复3次。
1.13 统计学分析对实验犬食管狭窄处内径数据采用SPSS 13.0进行重复测量设计的多因素方差分析。对胶原纤维含量采用SPSS 13.0进行统计学分析,t检验分析组间胶原相对含量的差异。
2 结果 2.1 食管狭窄及支架安装模型的构建结果氩离子凝固器灼伤食管,食管表明呈焦痂样(图 1)。
 |
| A:使用APC对实验犬食管进行烧灼;B:APC烧灼食管后胃镜下表现图 1 胃镜下观察APC对实验犬食管烧灼情况 |
4周后3组实验犬食管均出现明显狭窄,符合食管支架安装标准(图 2A)。建模前测量实验犬食管狭窄部位直径,以活检钳钳夹张开的宽度0.7 cm作为参考,测量食管直径。安装食管支架如图 2B所示。
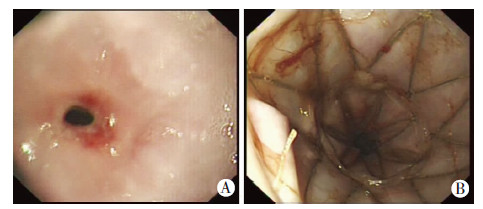 |
| A:胃镜下观察实验犬食管,可见实验犬食管明显狭窄,狭窄处管径仅0.4cm;B:胃镜引导下行带膜食管支架安装图 2 带膜食管支架置入实验犬食管前后观察 |
术后第1周观察,可见实验组实验犬食管支架全部移位进入胃中,对照组实验犬1、6号及空白组实验犬5、8、11号支架移位进入胃中。将支架未移位实验犬的食管支架取出。术后第 2、3、4周观察,对照组及空白组实验犬进食明显受限,进食出现呃逆、哽噎情况,体质量明显减轻,而实验组在取出支架后无明显呃逆及哽噎情况,进食不受限,体质量减轻不明显。从第2周开始测量实验犬食管置入支架部位的内径,测量方法同2.1,测量实验犬狭窄部位最狭窄处宽度,3组实验犬食管狭窄处胃镜观察如图 3所示,实验犬食管狭窄段直径变化如图 4所示,显示实验组较对照组和空白组明显狭窄程度轻,对实验犬食管狭窄处宽度数据采用SPSS 13.0进行重复测量设计的多因素方差分析,以造模前食管直径为协变量,结果表明实验组与对 照组和空白组比较,食管狭窄段内径差异有统计学意义(P <0.01),说明实验组食管狭窄明显较其余两组轻。
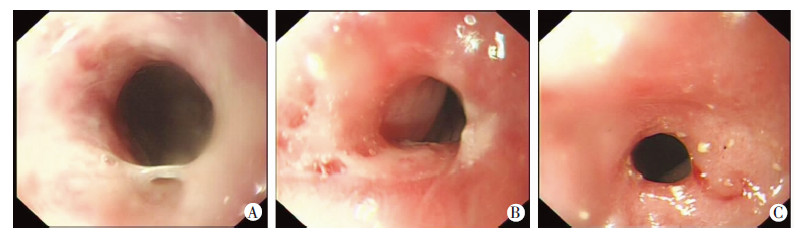 |
| A:实验组15号犬第4周食管胃镜可见食管直径直径约1.8 cm,表面光滑,略狭窄;B:对照组3号实验犬胃镜可见直径约0.8 cm,表面糜烂,中等狭窄程度;C:空白组12号实验犬胃镜可见直径约0.6 cm,表面充血,明显狭窄图 3 置入支架第4周实验犬胃镜下表现 |
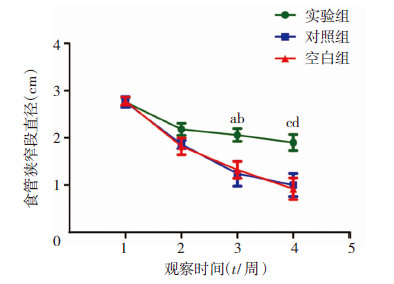 |
| 1:造模前;2:第2周;3:第3周;4:第4周 a: P <0.01,与空白组比较;b: P <0.01,与对照组比较图 4 3组实验犬食管狭窄段直径变化比较 |
分别取3组实验犬食管组织,进行HE染色。 实验组实验犬食管组织切片可见食管轻度纤维组织增生。对照组及空白组实验犬食管组织可见肉芽组织增生,纤维组织增生明显,炎性细胞浸润,伴表面溃疡形成(图 5)。
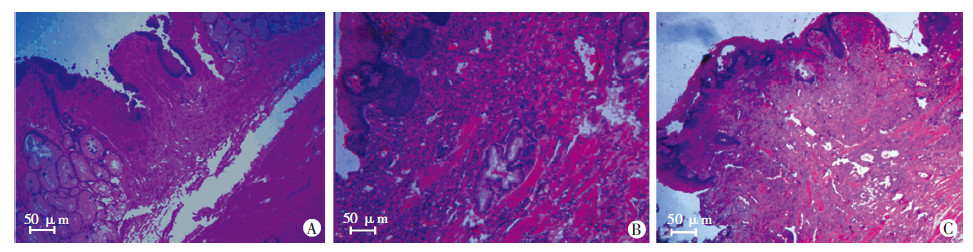 |
| A:实验组;B:对照组;C:空白组图 5 各组实验犬食管狭窄段组织病理变化 (HE×100) |
采用Masson三色染色法,可见实验组与空白组和对照组比较,被染成蓝色的胶原纤维明显较少(图 6)。对其胶原纤维含量进行扫描分析(图 7),可见实验组胶原纤维含量较对照组和空白组明显减少(P <0.05),说明经TRADD基因慢病毒转染后,实验组食管狭窄段组织纤维化受到显著抑制,而空白组及对照组狭窄段组织纤维化无抑制。
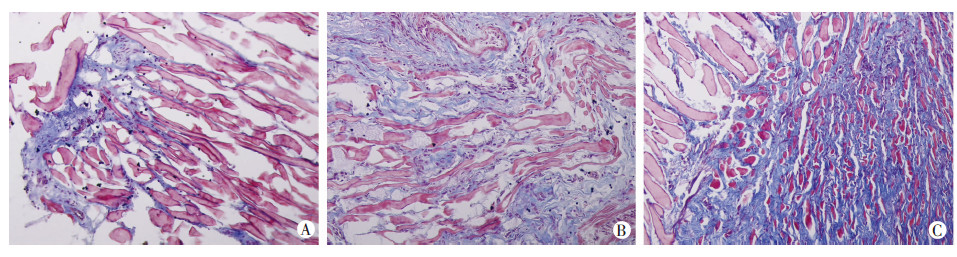 |
| A:实验组;B:对照组;C:空白组图 6 各组实验犬食管狭窄段组织Masson三色染色结果 (×200) |
 |
| a:P < 0.05,与对照组比较图 7 各组实验犬狭窄段组织胶原纤维相对含量比较 |
实验组及对照组均可见食管黏膜下组织见绿色荧光蛋白,而空白组无绿色荧光蛋白,表明GFP-慢病毒及GFP-Tradd基因慢病毒均能在食管黏膜下组织生长(图 8)。说明慢病毒涂层支架能有效转移慢病毒至食管组织,并且在黏膜下组织有效表达。
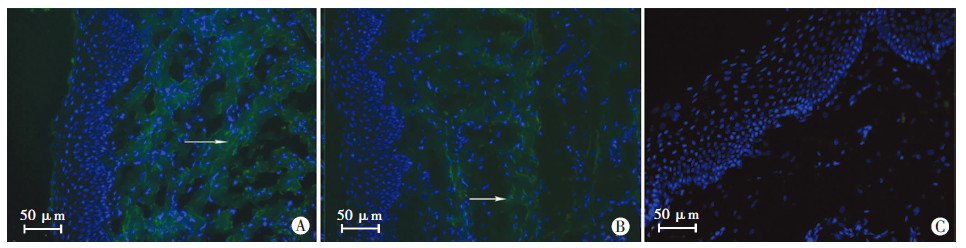 |
| A:实验组;B:对照组;C:空白组 ↑: 示绿色荧光蛋白图 8 各组实验犬食管组织绿色荧光蛋白表达 |
以β-actin为内参蛋白,PrestainedProtein Ladder为marker,实验组可在(55~72)×103处观察到阳性条带,其大小和TRADD-GFP-FLag融合蛋白(34×103+28×103+2×103=64×103)相吻合。表明实验组Tradd基因慢病毒成功转染食管黏膜下组织(图 9)。
 |
| 1:空白组; 2:对照组; 3:实验组图 9 Western blot检测各组实验犬转染TRADD基因慢病毒后TRADD-GFP-FLag融合蛋白的表达 |
以3种目的蛋白与GAPDH内 参蛋白累计光密度的比值作为3种蛋白的相对比较,结果显示collegan Ⅰ、 colleganⅢ、α-SMA 3种蛋白均表现出实验组较空白组、对照组明显降低 (P <0.05,图 10)。3种蛋白空白组、对照组之间无明显差异(P>0.05)。实验表明TRADD基因慢病毒能有效促进成纤维细胞凋亡,导致上述3种蛋白量明显降低,表明其在食管狭窄处能抑制再狭窄的发生。
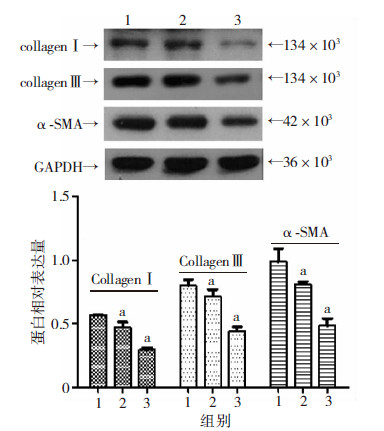 |
| A: Western blot检测结果;B:半定量分析结果 1:空白组;2:对照组;3:实验组 a: P < 0.05,与对照组比较图 10 Western blot检测各组实验犬食管狭窄部位组织中collagenⅠ、collagenⅢ、α-SMA蛋白表达 |
目前以冠脉支架为运载体系将药物及特异性基因带到血管狭窄段治疗血管狭窄取得了较好的效果[12, 13]。可见,通过病毒为载体,将目的基因转染至局部血管壁,实现外源性基因表达,可最大限度地在血管局部发挥生物学效应[14]。目前以食管支架为载体携带药物治疗食管狭窄的研究较少,Jeon等[5]报道采用紫杉醇药物涂层食管支架应用于动物支架,实验表明药物能显著缓解动物食管支架引起的食管肉芽组织增生。但药物洗脱支架的疗效与其作用时间长短有明显关系,因此,它受药物释放度影响较大。目前国内外缺少基因涂层食管支架治疗良性食管狭窄的研究。我们运用TRADD基因慢病毒涂层支架,以支架为载体将TRADD基因慢病毒成功转染至食管良性狭窄段组织中。胃镜检查TRADD基因慢病毒涂层支架组实验犬食管再狭窄程度较对照组和空白组明显轻,且具有统计学意义(P <0.01);Masson三色染色法结果表明其纤维化受到显著抑制;免疫荧光检查已证实其能转染至食管黏膜下组织并有效表达,Western blot检测可见TRADD-GFP-FLag融合蛋白在实验组表达,而在对照组和空白组则未检测出该融合蛋白;Western blot同时检测colleganⅠ、colleganⅢ、α-SMA 3种蛋白在实验组较空白组和对照组比较明显降低(P <0.05)。以上结果说明以食管支架作为载体携带TRADD基因慢病毒至食管良性狭窄段,能成功将TRADD基因慢病毒转染至食管狭窄段黏膜下组织,可抑制狭窄部位组织增生,减少食管狭窄部位再狭窄发生,给基因治疗良性食管狭窄提供了一种可能的选择方案。我们认为,在狭窄食管扩张和安装支架的过程中,食管黏膜损伤可让慢病毒进入食管黏膜下组织,同时在黏膜下组织中生长并表达,支架能维持在食管狭窄处数天,可有效使TRADD基因慢病毒持续进入食管黏膜下组织。在实验过程中,实验犬食管支架出现脱落,我们考虑这与带膜支架本身较高的移位率有关,而实验组1周后支架全部移位,可能还与转染后抑制成纤维细胞增生,再狭窄减轻有关。
TRADD可通过TNF-α介导的信号通路调控细胞的增殖与凋亡,TRADD在病理性瘢痕成纤维细胞中的低表达,可能抑制了TNF-α介导的细胞凋亡途径,导致HSFb的过度增殖及病理性瘢痕的形成[8, 15]。机体内的成纤维细胞产生的胶原蛋白处于合成代谢与分解代谢的动态平衡状态中,但是在某些因素的诱导或条件变化下,这种动态平衡被打破,导致成纤维细胞的胶原合成明显大于其分解,最终导致以Ⅰ、Ⅲ胶原纤维和α-SMA(α-平滑肌肌动蛋白)的过度增生,从而沉积于组织间隙中而发生纤维化,这是纤维化的细胞学基础[16]。本实验也证明提高疤痕组织中TRADD基因表达能有效抑制纤维化的发生,从而能抑制食管瘢痕组织形成。
慢病毒(Lentivirus)载体是以人类免疫缺陷病毒-1 (HIV-1) 为来源的一种病毒载体,除去其复制所需的基因,以治疗性基因和选择性标记物构建而成[17]。其最大的优势在于不仅能转染进入分裂期的细胞,而且能转染未分裂细胞及不分裂的细胞。目的基因搭载慢病毒载体进入靶细胞基因组中,能够长期稳定的表达[18]。慢病毒载体仍存在一些安全性方面的问题。慢病毒载体将目的基因插入靶细胞基因组中,是致突变性的,这样就有可能对宿主基因造成不可逆的改变,甚至引起宿主新的病变[19]。尽管如此,慢病毒载体已成为当前基因转移载体研究的热点。
但是目前的实验仍然是初步的。现在我们仅简单地将TRADD基因慢病毒采用物理的方法涂抹于带膜食管支架表面,需要即时涂层即时安装。下一步拟采用更有效的方法,比如采用生物蛋白胶(Fibrin glue)与TRADD基因慢病毒混合,然后将其涂于食管损伤段,让TRADD基因慢病毒缓慢释放。因为慢病毒存在安全性方面的因素,可同时对慢病毒在实验犬各组织、脏器的分布及其安全性应进一步研究。
| [1] | Ham Y H, Kim G H. Plastic and biodegradable stents for complex and refractory benign esophageal strictures[J]. Clin Endosc, 2014, 47(4): 295-300. |
| [2] | Shah J N. Benign refractory esophageal strictures: widening the endoscopist’s role[J]. Gastrointest Endosc, 2006, 63(1): 164-167. |
| [3] | Lew R J, Kochman M L. A review of endoscopic methods of esophageal dilation[J]. J Clin Gastroenterol, 2002, 35(2): 117-126. |
| [4] | Hirdes M M, Vleggaar F P, Siersema P D. Stent placement for esophageal strictures: an update[J]. Expert Rev Med Devices, 2011, 8(6): 733-755. |
| [5] | Jeon S R, Eun S H, Shim C S, et al. Effect of drug-eluting metal stents in benign esophageal stricture: an in vivo animal study[J]. Endoscopy, 2009, 41(5): 449-456. |
| [6] | Vandenplas Y, Hauser B, Devreker T, et al. A degradable esophageal stent in the treatment of a corrosive esophageal stenosis in a child[J]. Endoscopy, 2009, 41(Suppl 2): E73. |
| [7] | Pobezinskaya Y L, Liu Z. The role of TRADD in death receptor signaling[J]. Cell Cycle, 2011, 11(5): 871-876. |
| [8] | Sayah D N, Soo C, Shaw W W, et al. Downregulation of apoptosis-related genes in keloid tissues[J]. J Surg Res, 1999, 87(2): 209-216. |
| [9] | Yuan Y, Peng G, Kang X, et al. Effects of lentiviral vector-mediated TRADD expression on the inhibition of hypertrophic scar formation[J]. Exp Biol Med (Maywood), 2014, 239(12): 1557-1566. |
| [10] | 袁月, 康秀峰, 牟东, 等. TRADD慢病毒载体构建及其对增生性瘢痕成纤维细胞增殖的影响[J]. 第三军医大学学报, 2012, 34(9): 848-851. |
| [11] | 康秀峰, 刘培君, 袁月, 等. 氩离子凝固术治疗食管病变的安全性研究[J]. 第三军医大学学报, 2013, 35(10): 1009-1013. |
| [12] | Sharif F, Hynes S O, McMahon J, et al. Gene-eluting stent: comparison of adenoviral and adeno-associated viral gene delivery to the blood vessel wall in vivo[J]. Hum Gene Ther, 2006, 17(7): 741-750. |
| [13] | Wang K, Kessler P D, Zhou Z, et al. Local adenoviral-mediated inducible nitric oxide synthase gene transfer inhibits neointimal formation in the porcine coronary stented model[J]. Mol Ther, 2003, 7(5 Pt 1): 597-603. |
| [14] | Zhong H, Matsui O, Xu K, et al. Gene transduction into aortic wall using plasmid-loaded cationized gelatin hydrogel-coated polyester stent graft[J]. J Vasc Surg, 2009, 50(6): 1433-1443. |
| [15] | Boyce D E, Thomas A, Hart J, et al. Hyaluronic acid induces tumor necrosis factor-alpha production by human macrophages in vitro[J]. Br J Plast Srug, 1997, 50(5): 362-368. |
| [16] | Tan R J, Fattman C L, Niehouse L M, et al. Matrix metalloproteinases promote inflammation and fibrosis in asbestos-induced lung injury in mice[J]. Am J Respir Cell Mol Biol, 2006, 35(3): 289-297. |
| [17] | Wiznerowicz M, Trono D. Harnessing HIV for therapy, basic research and biotechnology[J]. Trends Biotechnol, 2005, 23(1): 42-47. |
| [18] | Cockrell A S, Kafri T. Gene delivery by lentivirus vectors[J]. Mol Biotechno1, 2007, 36(3): 184-204. |
| [19] | Hargrove P W, Kepes S, Hanawa H, et al. Globin lentiviral vector insections can perturb the expression of endogeous genes in beta-thalassemic hematopoietic cells[J]. Mol Ther, 2008, 16(3): 525-533. |



