永久性结扎双侧颈总动脉(bilateral common carotid arteries occlusion,BCCAO)是目前最常用的血管性痴呆(vascular dementia,VD)模型[1]。据报道,大鼠行BCCAO后2.5 h内大脑皮层血流降为正常对照组的35%~45%,海马区为对照组的60%左右;术后1周逐渐恢复,但直至4周仍显著低于对照组[2]。海马是调控学习记忆的关键脑区,以往的研究显示海马CA1区为缺血最敏感区域,CA1区神经元迟发性死亡可导致大鼠学习记忆障碍[3, 4]。
氧化应激是由机体内产生的活性氧(reactive oxygen species,ROS)介导,导致氧化与抗氧化失衡,从而引起组织、细胞的氧化损伤[5]。氧化应激在多种神经变性疾病的发病机制中发挥着重要作用,其中包括阿尔茨海默病、帕金森病和缺血性脑卒中等[6, 7]。大脑长期处于缺血性低灌注状态是否诱导海马CA1区氧化应激损伤,目前尚不清楚。本研究采用间断性结扎大鼠双侧颈总动脉方法制备慢性低灌注模型,探索BCCAO后海马CA1区氧化与抗氧化平衡的变化,揭示氧化与抗氧化失衡与大鼠海马CA1区神经元损伤及认知功能下降的关系及其分子机制。
1 材料与方法 1.1 主要试剂主要一抗:Nitrotyrosine(3NT,sc-65385),4HNE (Ab46545),Nrf2(sc-722),SOD2(sc-18503),HO-1 (sc-1797),NeuN(MAB377),β-actin(sc-81178);荧光二抗:驴抗小鼠Alexa-Fluor 488 nm,驴抗羊Alexa-Fluor 568 nm,驴抗兔Alexa-Fluor 647 nm (Invitrogen公司); 碱性磷酸酶标记二抗:羊抗兔IgG、驴抗羊IgG、兔抗小鼠IgG(Santa Cruz公司)。BCIP/NBT显色试剂(Promega公司),BCA蛋白浓度测定试剂盒(碧云天生物试剂公司)。
1.2 实验动物模型制备及分组SPF级成年雄性SD大鼠71只,体质量250~300 g,购自北京华阜康生物科技股份有限公司(许可证编号:SCXK京2004-0004),3只大鼠于实验过程中死亡,4只大鼠模型失败。经Morris水迷宫筛选学习记忆能力正常的大鼠用于本研究,并按完全随机分组方法 分为6组:假手术(Sham)组12只(HEt染色实验4只,3NT、4HNE、Nrf2/NeuN染色组各4只,Western blot实验4只),BCCAO 1 h,1、3、7、21 d组共52只(HEt染色实验16只,3NT、4HNE、Nrf2/NeuN染色各组16只,Western blot实验20只)。除sham组外,其余各组均采用间隔7 d分2次BCCAO;sham组只分离但不结扎双侧颈总动脉,其余步骤与模型组相同。
1.3 蛋白样品制备及Western blot分析于BCCAO后不同时间处死大鼠,按本室已经建立的方法[3]提取海马CA1区蛋白匀浆液,以牛血清白蛋白为标准蛋白,采用BCA法测定蛋白浓度。组织样品经蛋白处理液煮沸5 min 后进行7.5% SDS聚丙烯凝胶电泳(每个泳道50 μg蛋白),以湿转法电转移至PVDF膜上,3% BSA封闭1 h,加入相应的一抗Nrf2 (1 ∶200)、SOD2 (1 ∶200)、 HO-1 (1 ∶200),β-actin (1 ∶1 000),4 ℃过夜,TBST洗膜,加入相应的碱性磷酸酶标记的二抗室温孵育2 h,TBST洗膜,NBT/BCIP显色。
1.4 免疫荧光染色按本室已经建立的方法[3]制备海马连续冠状冰冻切片(25 μm)。切片用0.1 mol/L PBS洗涤10 min×3次,0.4%Trition-PBS打孔30 min。10%驴血清封闭1 h,加相应的一抗,4 ℃孵育过夜。0.1%Trition-PBS洗涤10 min×3次,加相应的荧光二抗,室温避光孵育1 h,0.1%Triton-PBS洗涤10 min×3次,封片剂封片后F1000激光扫描共焦显微镜观察,每张脑片的CA1区的相同位置分别采集3张图片,用于统计分析。
1.5 透射电镜观察大鼠海马CA1区细胞超微结构参照本室的方法[8]:将约1 mm3海马CA1组织放入0.1%戊二醛固定液4 ℃过夜。1%锇酸室温固定 2 h,丙酮脱水,树脂包埋。LKB-I 型切片机做超薄切片(60~70 nm),枸橼酸铅染色,透射电镜观察大鼠海马神经元的超微结构。
1.6 统计学分析采用Image J (Version 1.30; Wayne Rasband,NIH,USA)软件分析,用Sigma STAT 3.5统计软件,采用单因素方差分析。实验数据以x ±s表示。用Sigma Plot 10.0作图。
2 结果 2.1 BCCAO大鼠早期海马CA1区氧化应激指标的变化激光共聚焦结果(图 1A、B)显示:与sham组比较,BCCAO各组活性氧自由基荧光探针HEt原位荧光
强度均增强,21 d最强(P<0.05)。免疫荧光双染色结果(图 1A、C)显示:过氧亚硝酸自由基(ONOO-)标志蛋白3NT(3NT,绿色;NeuN,红色)在BCCAO各组较sham组明显增强(P<0.05);膜脂质损伤标志蛋白4HNE(4HNE,红色;NeuN,绿色)在BCCAO 3、7、21 d组较sham组增强(P<0.05)。Western blot检测结果(图 1D、E)显示:与sham组比较,3NT的表达在BCCAO 7、21 d组升高,4HNE的表达在BCCAO 3、7、21 d组升高(P<0.05)。
 |
| A:各组大鼠海马CA1区活性氧自由基荧光探针HEt原位荧光染色及3NT (绿)、4HNE (红)免疫荧光双染色结果;B:海马CA1区HEt荧光强度分析 a:P<0.05,与sham组比较;C:海马CA1区3NT及4HNE荧光强度分析 a:P<0.05,与sham组比较;D、E:分别为Western blot检测海马CA1区4HNE、3NT的蛋白表达及半定量分析 a:P<0.05,与sham组比较图 1 BCCAO对大鼠海马CA1区神经元氧化应激损伤标志蛋白表达的影响 |
免疫荧光双染色结果(图 2)显示:Nrf2(绿色)在sham组主要表达在细胞质,而BCCAO 1 h组可见Nrf2(绿色)与NeuN(红色,生存神经元细胞核标志性蛋白)重叠形成的黄色较sham组显著增强;BCCAO 3 d组Nrf2主要定位在细胞质;BCCAO 7、21 d组Nrf2免疫染色较sham组和BCCAO 1 h组减弱。Western blot检测结果(图 3)显示:sham组和BCCAO 1 h、1 d 组海马CA1区Nrf2蛋白表达较高,BCCAO 3 d组略有降低,与sham组比较差异无统计学意义(P>0.05);BCCAO 7、21 d组Nrf2蛋白表达与sham组比较均降低(P<0.05)。
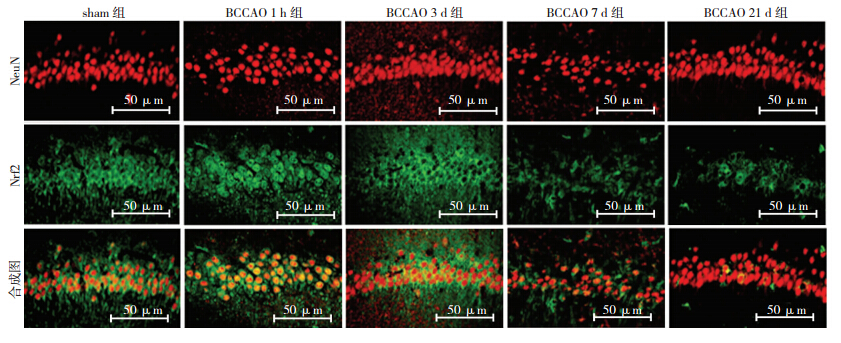 |
| 图 2 免疫荧光双染色观察各组大鼠海马CA1区NeuN、Nrf2的表达 |
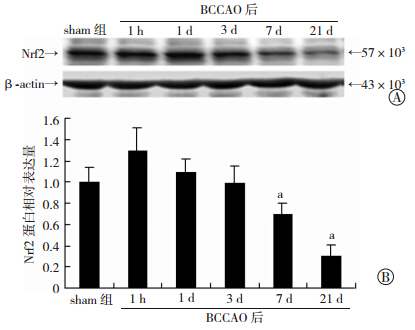 |
| A:Western blot检测;B:半定量分析 a:P<0.05,与sham组比较图 3 Western blot检测BCCAO对大鼠海马CA1区Nrf2蛋白表达的影响 |
Western blot检测结果(图 4)显示:与sham组比较,SOD2蛋白表达在BCCAO 1 h、1 d和3 d组升高,在BCCAO 7、21 d组降低(P<0.05);HO-1蛋白表达在BCCAO 1 h、1 d组较sham组升高(P<0.05),在BCCAO 3、7、21 d组均降低(P<0.05)。
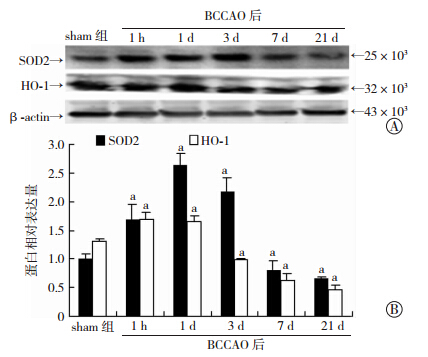 |
| A:Western blot检测;B:半定量分析 a:P<0.05,与sham组比较图 4 Western blot检测BCCAO对海马CA1区抗氧化蛋白SOD2和HO-1表达的影响 |
透射电镜观察结果(图 5)显示:sham组海马CA1 区神经元形态及染色质正常,胞质丰富,内质网、线粒体结构基本完整;血管基膜 均匀一致,完整性良好,内 皮细胞间的紧密连接完整;星形胶质细胞周边足突与血管 连接紧密,结构正常。BCCAO后各个时间点海马CA1区神经元、血管及星形胶质细胞均可见不同程度的超微结构改变。BCCAO 1 h和3 d组染色质减少,细胞质液化,线粒体嵴断裂、空泡化;血管内皮细胞向外伸出许多突起,附近的星形胶质细胞伪足肿胀,线粒体空泡化。BCCAO 21 d组海马CA1区神经元染色质边集、核固缩,胞质液化,大量线粒体空泡化,内质网严重扩张;血管外严重水肿,基底膜不均匀,紧密连接严重受损,星形胶质细胞细胞质电子密度升高,伪足与血管结构疏松。
 |
| 蓝色箭头示神经元细胞核;红色箭头示线粒体;绿色箭头示血管;黄色箭头示星形胶质细胞图 5 透射电镜观察BCCAO对海马CA1区神经元、血管及星形胶质细胞超微结构的影响 |
氧化应激损伤是机体受到有害刺激时体内氧化系统和抗氧化系统失衡,从而导致组织不可逆的损伤[9]。本研究首先采用HEt荧光原位检测BCCAO后海马CA1区神经元O2-自由基水平,结果发现HEt的荧光强度随时间依赖性增强,提示BCCAO触发了海马CA1区神经元的氧化应激信号。活性氧族可与活性氮自由基联合作用产生硝化应激,进一步损伤细胞[10]。本研究发现BCCAO后7 d和21 d海马CA1区硝化应激标志蛋白3NT蛋白表达较sham组显著升高,进一步的研究证明BCCAO后7 d和21 d海马CA1区神经元4HNE水平显著升高。4HNE为膜脂质损伤的标志蛋白,细胞膜脂质过氧化损伤是细胞反应氧化应激的早期损伤事件[11]。以上结果提示:BCCAO可诱导海马CA1区活性氧和活性氮的持续增加,并导致海马CA1区神经元膜脂质损伤。
Nrf2/ARE是机体抵抗内外界氧化应激最重要的防御性系统。正常生理情况下,Nrf2被Keap1锚定在细胞质,并被泛素化或蛋白酶所降解[12];当发生氧化应激时,Nrf2与Keap1蛋白解耦连,转入细胞核,与抗氧化应激顺式作用元件(antioxidant responsive elements,ARE)序列结合,诱导其下游抗氧化酶、Ⅱ相解毒酶基因的表达[13]。本研究发现BCCAO后1 h和3 d Nrf2蛋白表达与sham组相比差异无统计学意义,但BCCAO 7、21 d组Nrf2蛋白水平较sham组显著降低。有趣的是共聚焦结果显示Nrf2的阳性染色于sham组在细胞质,BCCAO 1 h分布于整个神经元,而BCCAO 3 d主要在细胞质,BCCAO 7 d和21 d组Nrf2蛋白水平及细胞核免疫表达均显著下降。本课题组最近的研究[3]及Wang等[14]研究报道脑缺血可影响Nrf2的亚细胞分布及活性,大豆异黄酮或CO可诱导脑缺血后Nrf2的核转位并上调其下游抗氧化酶蛋白水平。超氧化物歧化酶(superoxide dismutase,SOD)和HO-1为Nrf2的重要下游底物。SOD2在抗氧化过程中可直接清除自由基,防止机体受到氧化应激损伤,可提示机体的抗氧化能力[15]。HO-1为血红素代谢过程的限速酶,是有效的抗氧化应激调节蛋白,在海马神经元、星形胶质细胞和大脑皮质细胞均高表达[16, 17, 18]。本研究发现BCCAO后1 h 和3 d 海马CA1区SOD2和HO-1的蛋白表达均保持较高水平,但BCCAO 7、21 d显著下降,并均较sham组显著降低,此变化趋势与Nrf2的变化相吻合。结合以往的报道,本研究的结果提示Nrf2于BCCAO 1 h可能发生了短暂核转位,但随着低灌注时间的延长,Nrf2核转位被抑制并被泛素化降解,从而导致其下游抗氧化酶表达的下调。
脑内星形胶质细胞的数量是神经元的数倍,其伪足同时包绕着血管壁和神经元的突触,形成神经-血管单元,在中风、痴呆等缺血性脑病中发挥重要作用[19, 20]。脑缺血后星形胶质细胞功能障碍会导致神经元损伤[21]。线粒体是活性氧自由基产生的主要场所,也是自由基攻击的主要靶细胞器。本研究电镜结果显示,BCCAO后不同时间窗海马CA1区神经-血管单元均有不同程度损伤,并于21 d损伤最严重,呈现星形胶质细胞伪足肿胀、线粒体嵴断裂和空泡化;血管基底膜不均匀,血管外水肿;神经元核膜损伤、线粒体嵴断裂、内质网扩张等超微病理改变。结果提示:BCCAO后海马CA1区神经血管单元的损伤可能与氧化应激有关,并具有时间依赖性。
综上所述,本研究结果发现BCCAO后活性氧和活性氮的逐渐增加导致了海马CA1区神经元膜脂质损伤,而同时抗氧化物质Nrf2、SOD2和HO-1表达相对降低,最终氧化-抗氧化失衡导致了神经元超微结构损伤。本研究为血管性痴呆的早期预防和治疗提供了重要的时间窗。
| [1] | Sakr H F, Khalil K I, Hussein A M, et al. Effect of dehydroepiandrosterone (DHEA) on memory and brain derived neurotrophic factor (BDNF) in a rat model of vascular dementia[J]. J Physiol Pharmacol, 2014, 65(1): 41-53. |
| [2] | Otori T, Katsumata T, Muramatsu H, et al. Long-term measurement of cerebral blood flow and metabolism in a rat chronic hypoperfusion model [J]. Clin Exp Pharmacol Physiol, 2003, 30(4): 266-272. |
| [3] | Wang R, Tu J, Zhang Q, et al. Genistein attenuates ischemic oxidative damage and behavioral deficits via eNOS/Nrf2/HO-1 signaling[J]. Hippocampus, 2013, 23(7): 634-647. |
| [4] | Pellegrini-Giampietro D E, Zukin R S, Bennett M V, et al. Switch in glutamate receptor subunit gene expression in CA1 subfield of hippocampus following global ischemia in rats[J]. Proc Natl Acad Sci U S A, 1992, 89(21): 10499-10503. |
| [5] | Ock C Y, Kim E H, Choi D J, et al. 8-Hydroxy-deoxyguanosine: not mere biomarker for oxidative stress, but remedy for oxidative stress-implicated gastrointestinal diseases [J]. World J Gastroenterol, 2012, 18(4): 302-308. |
| [6] | Smith J A, Park S, Krause J S, et al. Oxidative stress, DNA damage, and the telomeric complex as therapeutic targets in acute neurodegeneration[J]. Neurochem Int, 2013, 62(5): 764-775. |
| [7] | Diaz-Ruiz A, Vacio-Adame P, Monroy-Noyola A, et al. Metallothionein-Ⅱ inhibits lipid peroxidation and improves functional recovery after transient brain ischemia and reperfusion in rats[J]. Oxid Med Cell Longev, 2014, 2014: 436-429. |
| [8] | Zhou C, Tu J, Zhang Q, et al. Delayed ischemic postconditioning protects hippocampal CA1 neurons by preserving mitochondrial integrity via Akt/GSK3beta signaling [J]. Neurochem Int, 2011, 59(6): 749-758. |
| [9] | 马婧怡, 张万鑫, 陈虹, 等. 松果菊苷对血管性痴呆大鼠氧化应激损伤的保护作用 [J]. 中国药理学通报, 2014, 30(5): 638-642. |
| [10] | Zhang J, Veasey S. Making sense of oxidative stress in obstructive sleep apnea: mediator or distracter?[J]. Front Neurol, 2012, 3: 179. |
| [11] | Deng Y, Thompson B M, Gao X, et al. Temporal relationship of peroxynitrite-induced oxidative damage, calpain-mediated cytoskeletal degradation and neurodegeneration after traumatic brain injury[J]. Exp Neurol, 2007, 205(1): 154-165. |
| [12] | Sekhar K R, Yan X X, Freeman M L. Nrf2 degradation by the ubiquitin proteasome pathway is inhibited by KIAA0132, the human homolog to INrf2[J]. Oncogene, 2002, 21(44): 6829- 6834. |
| [13] | Tanito M, Agbaga M P, Anderson R E. Upregulation of thioredoxin system via Nrf2-antioxidant responsive element pathway in adaptive-retinal neuroprotection in vivo and in vitro[J]. Free Radic Biol Med, 2007, 42(12): 1838-1850. |
| [14] | Wang B, Cao W, Biswal S, et al. Carbon monoxide-activated Nrf2 pathway leads to protection against permanent focal cerebral ischemia [J]. Stroke, 2011, 42(9): 2605-2610. |
| [15] | 张斯萌, 王文, 黄丹, 等. 急性脑卒中患者血清氧化应激指标测定及临床意义[J]. 微循环学杂志, 2012, 22(4): 42-43. |
| [16] | Schipper H M. Heme oxygenase-1 in Alzheimer disease: a tribute to Moussa Youdim [J]. J Neural Transm (Vienna), 2011, 118(3): 381-387. |
| [17] | Jeong G S, Lee D S, Kim D C, et al. Neuroprotective and anti-inflammatory effects of mollugin via up-regulation of heme oxygenase-1 in mouse hippocampal and microglial cells[J]. Eur J Pharmacol, 2011, 654(3): 226-234. |
| [18] | Kwon K J, Kim J N, Kim M K, et al. Neuroprotective effects of valproic acid against hemin toxicity: possible involvement of the down-regulation of heme oxygenase-1 by regulating ubiquitin-proteasomal pathway[J]. Neurochem Int, 2013, 62(3): 240-250. |
| [19] | Gabryel B, Kasprowska D, Kost A, et al. Astrocytes in ischemic stroke: a potential target for neuroprotective strategies[J]. Postepy Hig Med Dosw (Online), 2015, 69: 384-397. |
| [20] | Yata K, Nishimura Y, Unekawa M, et al. In vivo imaging of the mouse neurovascular unit under chronic cerebral hypoperfusion[J]. Stroke, 2014, 45(12): 3698-3703. |
| [21] | Takano T, Oberheim N, Cotrina M L, et al. Astrocytes and ischemic injury[J]. Stroke, 2009, 40(3 Suppl): S8-S12. |



