脱嘌呤脱嘧啶核酸内切酶1(apurinic/apyrimidinic endonuclease 1,APE1)是DNA碱基切除修复(base excision repair,BER)的核心修复酶,其活性直接决定了细胞BER的整体功能。现有的研究显示,APE1是一个多功能蛋白,主要功能有C端的脱嘌呤脱嘧啶(apurinic/apyrimidinic,AP)核酸内切酶和N端的氧化还原功能[1]。APE1在肿瘤组织的高表达与肺癌、肝癌、卵巢癌及骨肉瘤患者预后差呈正相关,提示其在肿瘤发生、发展中具有重要作用。进一步功能研究提示,APE1与肿瘤细胞耐药、血管形成、放疗耐受等重要的肿瘤生物学特征也密切相关,以APE1为抗癌靶点具有潜在研究价值[2, 3, 4]。AP核酸内切酶活性是APE1核心功能,也是哺乳动物细胞生存所必需的生物学活性。在肿瘤学研究中,AP核酸内切酶活性的测定对于分析肿瘤细胞DNA修复能力强弱,发现APE1抑制剂等都十分重要,是DNA修复研究的重要研究方法。目前AP核酸内切酶活性的检测主要依赖与同位素标记的探针底物,在推广应用上受到了很大的限制。因此,本研究拟建立一种基于远红外荧光的AP核酸内切酶检测方法。
1 材料与方法 1.1 主要材料γ-32P-ATP 250 μCi (Perkin Elmer公司,美国),含有AP位点的DNA探针,序列如下:5′-GTGGATCCGT-ACTCTG F GTACGTGTCAACACGAATTCGA-3′(F代表AP位点),其互补链序列为:5′-TCGAATTCGTGTTGACACGTACCCAGAGTACGGATCCAC-3′,由TaKaRa公 司(大连)合成,含AP位点的探针5′端由IR700标记 (美国IDT公司专利),由IDT公司(美国)合成。T4 PNK 试剂盒(NEB公司,美国),UreaGel变性丙烯酰胺凝胶制胶试剂盒(National Diagnostics公司,美国),10×TBE(Life Technologies公司,美国),过硫酸铵(APS)、四甲基乙二胺(TEMED)(Sigma Aldrich公司,美国)。
1.2 自制APE1纯化蛋白含有APE1全场表达序列的pET11a-hAPE1载体由美国NIH老化研究所David Wilson Ⅲ教授馈赠。该载体可表达无任何外源性多肽标签的野生型人APE1蛋白,与内源性APE1蛋白一致。将pET11a-hAPE1质粒转化至BL21(DE3)大肠杆菌中,得到单克隆扩增并作为种子菌液接种至1 L LB培养基中,37 ℃振摇3~4 h至培养液光密度值为0.6,加入0.5 mmol/L IPTG继续在20 ℃振摇过夜。收集细菌,用30 mL Buffer A[50 mmol/L两性离子缓冲剂-氢氧化钾(HEPES-KOH),pH=7.5,5%甘油(glycerol),50 mmol/L KCl]重悬细菌沉淀。用超声法破碎细菌释放蛋白,而后以20 000×g离心去除碎片及未破碎细菌,上清用于离子交换法纯化。首先将上清上柱至Q20阴离子交换柱,监测UV吸收值直至恒定不变。收集穿透液并上柱至S10阳离子交换柱,监测UV吸收值直至恒定不变,而后用Buffer B(50 mmol/L HEPES-KOH,pH=7.5,5% glycerol,700 mmol/L KCl)与Buffer A梯度混合液洗脱结合在S10阳离子交换柱上的蛋白(>95%为APE1蛋白),用4 mL组分分离收集管收集各个组分,并提取峰值对应的洗脱组分进行进一步浓度、纯度及活性的检测。
1.3 远红外荧光探针制备反应体积20 μL,IR700标记的、含AP位点的DNA探针(10 pmol/μL) 2 μL ,10×PNK Buffer 2 μL,互补探针(10 pmol/μL) 4 μL,超纯水12 μL,放入 PCR仪,95 ℃ 5 min,由95 ℃降到25 ℃,每循环(1 min)降1 ℃,共70个循环。制备好后置于4 ℃避光保存备用,可保存1个月。
1.4 同位素标记探针反应体积20 μL,含AP位点的DNA探针(10 pmol/μL) 2 μL ,超纯水5 μL,10×PNK Buffer 1 μL,γ-32P-ATP(10 μCi/μL 1 uL,T4 PNK 1 μL,混匀后瞬时离心后放于PCR仪,37 ℃ 30 min,95 ℃ 10 min,4 ℃ 6 min,反应完成后加入2倍量互补探针(10 pmol/μL) 4 μL,超纯水6 μL,再次放入PCR仪,95 ℃ 5 min,由95 ℃ 降到25 ℃,每循环(1 min)降1 ℃,共70个循环。
1.5 同位素探针法检测AP内切酶活性反应体积10 μL,含不同量(10~1 000 pg)的APE1纯化蛋白,1 pmol γ-32P-ATP标记的底物和AP反应缓冲液(10 mmol/L HEPES-NaOH,pH=7.5,100 mmol/L NaCl,2 mmol/L MgCl2);37 ℃孵育10 min,加入10 μL 2×Stop Buffer甲酰胺终止反应后于95 ℃变性5 min,含有8 mol/L尿素的15%变性聚丙烯酰胺凝胶预电泳30 min,冲孔,上样,电泳300 V 70 min后,于暗室中X光胶片-70 ℃压片过夜,第2天显影、定影。
1.6 荧光探针法检测AP内切酶活性反应体积10 μL,含不同量(10~1 000 pg)的APE1纯化蛋白,1 pmol荧光标记的底物和AP反应缓冲液(10 mmol/L HEPES-NaOH,pH=7.5,100 mmol/L NaCl,2 mmol/L MgCl2);37 ℃孵育10 min,加入10 μL 2×Stop Buffer甲酰胺终止反应95 ℃ 5 min,含有8 mol/L 尿素的15%变性聚丙烯酰胺凝胶先冲孔预电 泳30 min,取10 μL反应产物,上样电泳300 V 70 min,切下凝胶荧光扫描(LI-COR ODYSSEY红外线双色扫描激光成像系统)。
2 结果 2.1 同位素法检测AP核酸内切酶活性用同位素法检测AP内切酶活性,不同量APE1蛋白可以将不同比例的底物转化为产物,10 pg APE1蛋白转化的底物在同位素法的结果中无法显示,100 pg大致能转化10%的产物,而1 000 pg则可将全部1 pmol 的底物转化为产物。从图 1中可以看出,同位素法得到的图像清晰,无杂带,便于计算转化率和酶活性。但由于同位素显影过程需放置于-70 ℃过夜成像,因此整个操作过程大约需要1 d,而且受到同位素半衰期的影响,实验安排受到极大限制。
 |
| 图 1 同位素法检测AP内切酶活性 |
用远红外荧光法检测AP内切酶活性,不同量APE1蛋白可以将不同比例的底物转化为产物,在同位素法的结果中无法显示的10 pg APE1蛋白转化的底物在远红外荧光法中可清晰显示,100 pg大致能转化30%的产物,而1 000 pg则可将接近95%的1 pmol的底物转化为产物,但仍有少部分无法转换为产物,更加符合酶促反应的规律。从图 2中可以看出,远红外法由于探针为商业化合成,灵敏度较高,因此底物出现了双条带,分子量较大的为未变性的底物,为双链DNA,在PAGE胶中泳动速度较慢。整个操作过程大约需要2 h,而且实验安排非常灵活,不受场地、底物批号的影响。
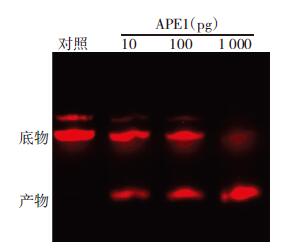 |
| 图 2 远红外法检测AP内切酶活性 |
AP核酸内切酶活性是APE1核心功能,也是哺乳动物细胞生存所必需的生物学活性。Xanthoudakis等[5]的研究显示,AP核酸内切酶活性位点E96、Y177等突变的小鼠均无法存活,亦凸显了AP核酸内切酶的活性。在人类细胞中,APE1承担了>95%的AP核酸内切酶活性,仅有少数的候选酶具有替代的微弱的活性,在Li等[6]的研究中也提示用纯化蛋白和细胞核提取物进行AP核酸内切酶检测具有同等的趋势,再次确证了APE1在细胞内的重要性。
AP核酸内切酶活性的检测是一个在APE1研究中非常重要的手段,目前基本的方法主要包括同位素标记法和分子信标法。同位素标记法是在一段含有AP位点的寡核苷酸的5′端用γ-32P-ATP标记,而后将该底物与纯化APE1蛋白或细胞核提取物进行反应,将反应物用变性PAGE胶分离后进行同位素显影,通过比对具有不同分子质量的产物和底物的量来测定AP内切酶活性的方法。而分子信标法则利用5′端荧光标记的AP位点探针(AP位点距5′端<5 nt)与3′含有荧光淬灭基团进行退火得到无荧光信号的底物,当AP位点被加入的APE1蛋白切开后,则释放荧光标记的产物,从而测定AP核酸内切酶的活性[7]。两种方法各有优缺点,同位素法较灵敏,可靠性高,可重复性好,但操作繁琐,对身体和环境均有不利影响;分子信标法无辐射污染,定量方便、快速,但重复性较差,灵敏度不如同位素法。本研究正是结合两种方法创立了一种基于远红外标记的AP核酸内切酶活性的检测方法,该方法具有很好的可重复性,较同位素法具有灵敏度更高、无放射污染、操作快速等特点,适合普通实验室推广。
| [1] | Li M, Wilson D M 3rd. Human apurinic/apyrimidinic endonuclease 1. Antioxid Redox Signal, 2014, 20(4): 678-707. |
| [2] | Wang D, Luo M, Kelley M R. Human apurinic endonuclease 1 (APE1) expression and prognostic significance in osteosarcoma: enhanced sensitivity of osteosarcoma to DNA damaging agents using silencing RNA APE1 expression inhibition. Mol Cancer Ther, 2004, 3(6): 679-686. |
| [3] | Wang D, Zhong Z Y, Li M X, et al. Vector-based Ape1 small interfering RNA enhances the sensitivity of human osteosarcoma cells to endostatin in vivo. Cancer Sci, 2007, 98(12): 1993-2001. |
| [4] | Wang D, Xiang D B, Yang X Q, et al. APE1 overexpression is associated with cisplatin resistance in non-small cell lung cancer and targeted inhibition of APE1 enhances the activity of cisplatin in A549 cells. Lung Cancer, 2009, 66(3): 298-304. |
| [5] | Xanthoudakis S, Smeyne R J, Wallace J D, et al. The redox/DNA repair protein, Ref-1, is essential for early embryonic development in mice. Proc Natl Acad Sci U S A, 1996, 93(17): 8919-8923. |
| [6] | Li M, Völker J, Breslauer K J, et al. APE1 incision activity at abasic sites in tandem repeat sequences. J Mol Biol, 2014, 426(11): 2183-2198. |
| [7] | Simeonov A, Kulkarni A, Dorjsuren D, et al. Identification and characterization of inhibitors of human apurinic/apyrimidinic endonuclease APE1. PLoS One, 2009, 4(6): e5740. |



