2. 400038 重庆,第三军医大学医学检验系临床微生物学及免疫学教研室
2. Department of Clinical Microbiology and Immunology, Faculty of Laboratory Medicine, Southwest Hospital, Third Military Medical University, Chongqing, 400038, China
类鼻疽(Melioidosis)是一种由类鼻疽伯克霍尔德氏菌(Burkholderia pseudomallei,B. pseudomallei,BP)引起的一种热带疾病,发病率及病死率高,病程长,易复发[1, 2, 3]。类鼻疽伯克霍尔德氏菌是兼性胞内菌,它侵入人体后虽然可以引起人免疫细胞的一系列反应,但却能通过一系列的逃逸机制阻止内吞体与溶酶体的融合,逃避免疫细胞对它的清除作用,从而存活增殖并引起人体的一系列炎症性疾病。这一机制是如何产生的?细菌和宿主免疫细胞的相互作用的机制如何?目前还鲜有报道。要研究这一机制,建立类鼻疽伯克霍尔德氏菌感染细胞的模型是必要的前提。Burkholderia thailandensis (B.thailandensis,BT)是一种对人和动物都不致病的类鼻疽伯克霍尔德氏菌,由于它和BP无论菌落特征还是表型都很相似,所以生物学研究上常把BT作为BP研究的对照菌株。THP-1是人急性单核细胞,聚乙二醇(PEG)分子能改变细胞的生物膜结构,使两细胞发生疏散和重组,从而使细胞发生融合,进而对细菌胞内生存产生影响,因此本实验拟用PEG对细胞进行预处理以诱导细胞融合后再用细菌感染,观察PEG诱导细胞融合后是否提高细菌的入胞率及这种情况下细胞培养上清的细胞因子有何变化。故本研究拟以人急性单核白血病细胞THP-1为模型,以本室保存并已进行全基因组测序的菌株BPC006(GenBank:CP003781&CP003782)为病原菌代表,用购买的无毒株BT为对照菌株,评价细菌与细胞孵育时间对细菌侵入细胞数量的影响,另外还评价了用PEG与THP-1共同孵育5 min后对侵入细胞的细菌数量的影响。同时通过电镜从形态学上评价细菌侵入细胞的病理损伤变化,并检测人血清及感染后THP-1细胞分泌的各种细胞因子的变化,来评价感染模型的稳定性。
1 材料与方法 1.1 菌株、细胞株、试剂及仪器类鼻疽伯克霍尔德氏菌株BPC006 (GenBank: CP003781&CP003782)和人急性单核白血病细胞THP-1 均由本室保存。类鼻疽伯克霍尔德氏菌无毒株菌株BT编号为E264购自ATCC;PEG型号为3640,相对分子质量3 350,购自美国Sigma 公司;酵母提取物、胰蛋白胨购自美国Sigma 公司,NaCl(国产分析纯)购自国药集团化学试剂有限公司,琼脂购自Promega公司;BILON-COS-211C恒温摇床购自购自上海比朗仪器有限公司; Thermo Forma 3111型细胞培养箱购自美国Forma公司;紫外分光光度计8453购自Agilent;1640细胞培养基和胎牛血清均购自Hyclone公司;人IL-1β、IL-6 和TNF-α ELISA预包被试剂盒购自深圳达科为公司;透射电镜(Philips TECNAI 10)由第三军医大学分析中心提供。
1.2 方法 1.2.1 比较B.pseudomallei和B.thailandensis的生长规律BP和BT通过三线法划线接种于固体LB培 养基中,37 ℃培养,48 h后分别挑单个菌落转种于加有5 mL液体LB的摇瓶中置于温控摇床中,37 ℃,200 rpm 扩大培养,4 h后分别取100 μL加入10 mL液体LB里,37 ℃,200 rpm扩大培养。分别收集4 h、6 h、8 h、10 h、12 h和14 h的菌液100 μL加入900 μL无菌生 理盐水重悬,并用无菌生理盐水倍比稀释,分别取100 μL 菌液涂板,培养48 h后计数并比较BP和BT的生长规律,定量细菌浓度,确定感染细胞的细菌浓度。
1.2.2 比较B.pseudomallei和B.thailandensis的胞内生存情况取培养好的THP-1加入15 mL离心管,800 rpm离心10 min后轻柔弃上清,再用1640培养基重悬,以每孔细胞浓度为1×106个,2 mL/孔接种于6孔板中,每孔加入10 μL浓度为1×1010/mL的菌液感染细胞。37 ℃、5%CO2孵箱中共孵2 h,后取出以800 rpm离心10 min,轻柔弃去上清,37 ℃预热的无菌PBS洗两次,加入含250 μg/mL卡那霉素的1640培养基重悬以杀灭胞外细菌,后按2 mL/孔加入6孔板中共孵2 h,共孵后取出轻轻吹打板壁以免细胞粘壁,加入EP管中800 rpm离心10 min,上清收集测细胞因子,底部沉淀加入1 mL 1% Triton裂解15 min后用无菌PBS倍比稀释涂板计数。收集感染4 h、8 h、12 h、20 h、24 h、44 h的细胞及相同时相的用无毒株BT感染的细胞,计算方法为:摄取率(%)=(细胞裂解出的细菌数/感染初始细菌数)×100%。
1.2.3 透射电镜观察细菌的入胞情况透射电镜观察细菌的入胞情况,从形态学上观察病原菌入侵宿主细胞内的情况。将收集的细胞以800 rpm离心10 min 后,在4 ℃的条件下,用2.5%戊二醛固定样品,送至第三军医大学电镜室进行透射电镜检测。
1.2.4 聚乙二醇诱导细胞融合对细菌胞内生存的影响[4]THP-1加入15 mL离心管,800 rpm离心10 min 后轻柔弃上清,再用1640培养基重悬后,按500 μL/L 的量加入PEG诱导,置37 ℃共孵5 min,后800 rpm离心10 min,轻柔弃去上清,再加入1640培养基,以每孔2 mL ,浓度为1×106/孔接种于6孔板中,细菌以MOI=100 ∶1的菌量感染细胞。37 ℃、5%CO2孵箱中共孵2 h,后取出800 rpm离心10 min,轻柔地弃去上清,37 ℃预热的无菌PBS洗两次,加入含250 μg/mL卡那霉素的1640培养基重悬以杀灭胞外细菌,后按2 mL/孔加入6孔板中共孵2 h,后取出轻轻吹打板壁以免细胞粘壁,加入EP管中800 rpm离心10 min,收集上清测细胞因子,底部沉淀加入1% Triton 1 mL裂解15 min 后用无菌PBS倍比稀释涂板计数。同时做无毒株E264的侵袭实验。分别收集感染4 h、8 h、12 h的细胞及相同时间无毒株BT感染的细胞。
1.2.5 TNF-α、IL-6和IL-1β的检测[4, 5]检测不同感染时相下细胞培养上清中TNF-α、IL-6和IL-1β的含量,评价感染后THP-1细胞的炎症反应,按试剂盒说明书进行。
1.2.6 患者血清中IL-1β、和TNF-α的检测检测不同患者血清中IL-1β和TNF-α的含量,评价感染后人体的炎症反应,按试剂盒说明书进行。
1.3 统计学处理感染模型稳定性验证 所有实验均做3次以上重复,数据统计采用t检验分析差异显著性,GraphPad Prism 5.0 软件作图,以得到感染模型建立的最佳条件。
2 结果 2.1 B.pseudomallei和B.thailandensis生长规律的比较BP和BT在4~8 h内生长相对后期较缓慢,8 h以后生长增快,12~14 h细胞增长速度比8~12 h的速度还快。BT比BP生长得快些,但两者区别不大,见图 1。
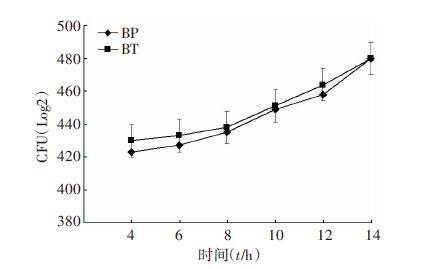 |
| 图 1 BP和BT生长曲线 |
短时间(0~4 h)内观察,虽然4 h内BP的数量[(20.13±0.79)CFU(log2)]多于BT[(19.33±1.43)CFU(log2)],但BT生长速度超过了BP,且两者 数量相差的趋势愈来愈明显,8 h后BT数量[(25.65± 0.57)CFU(log2)]明显多于BP[(22.72±2.29)CFU(log2)]。
2.3 透射电镜观察细菌的入胞情况BP感染16 h后投射电镜下即可见细菌侵入细胞内如(图 2A、C),而BT感染的细胞在44 h后才可见细菌侵入细胞的现象(图 2D)。同时无细菌感染的阴性对照24 h细胞尚是完好且无细菌侵入现象(图 2B)。
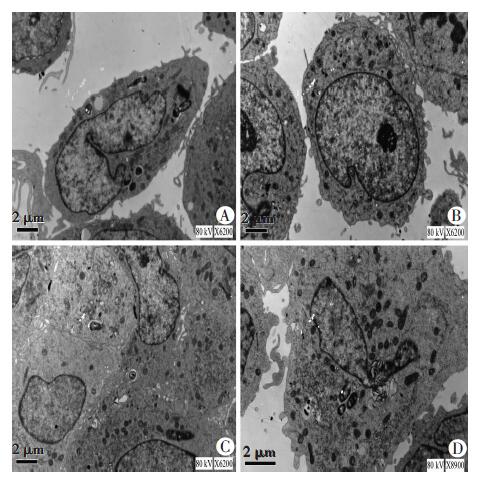 |
| A:BP感染16 h,B:无细菌感染24 h,C:BP感染24 h,D:BT感染44 h图 2 不同细菌感染的不同感染时相细菌的胞内生存状态和THP-1细胞病理损伤表现 |
在PEG3350诱导下,8 h内BP和BT在细胞的胞 内拷贝数是下降的,8~12 h两者均呈上升趋势,而12~ 24 h生长趋于停滞,如图 3。
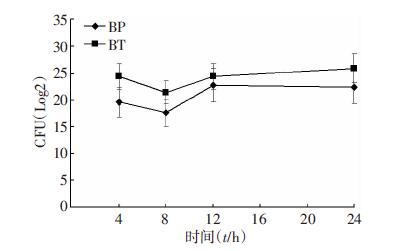 |
| 图 3 PEG诱导细胞后细菌胞内生存的情况 |
BP与BT感染的细胞上清中的细胞因子水平都增高,而未感染的细胞上清则无任何变化。其中BP感染上清的炎症因子TNF-α的含量在8 h内无明显变化,12 h达分泌峰值后持续下降,44 h降至与4 h感染时差不多水平,而BT感染的上清则在感染后持续上升,并在20 h达峰值后渐次下降(图 4A)。 在PEG预处理的情况下,两者都是先升高后再持续下降,但BT感染的上清的TNF-α在4 h时升高的更明显,8 h后BP和BT感染上清的TNF-α开始降低且两者差别不大(图 4B)。而在炎症因子IL-6的检测中,除未感染的细胞上清无任何变化外,BP和BT感染上清的IL-6含量差别更加明显,BP感染上清的IL-6呈明显的双峰形,在8h达第一个峰值后开始下降,在12到20 h几乎达到最低值,20 h后又开始持续升高并在24 h达峰值后再次下降,而BT感染上清的IL-6含量则在4 h升高后在8 h至24 h维持在峰值附近,24 h后再下降(图 4C)。用PEG3350预处理后BP感染上清的IL-6含量在8h内无变化,8 h后开始增高。而BT感染上清则在4 h先升高,8 h后降至与BP感染上清差不多的最低水平后再增高,且BT感染上清的IL-6含量都比BP感染的高(图 4D)。而IL-1β的检测中,BP和BT感染细上清的IL-1β含量都很高,4 h就都超过了试剂的检测上限。
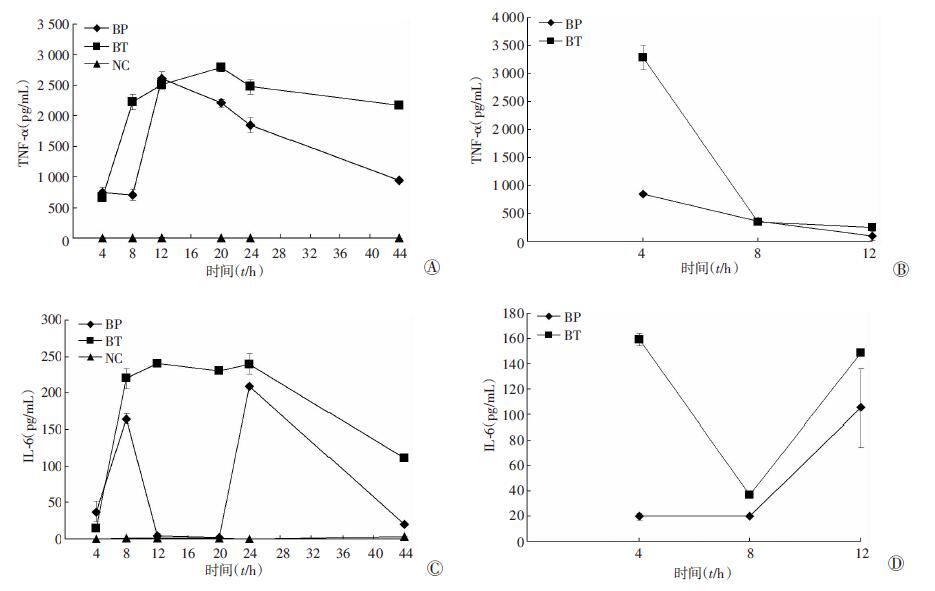 |
| A:BP、BT感染及未感染的细胞上清中TNF-α的检测;B:PEG诱导后的BP、BT感染的细胞上清中TNF-α的检测; C:BP、BT感染及未感染的细胞上清中IL-6的检测;D:PEG诱导后的BP、BT感染的细胞上清中IL-6的检测图 4 不同感染时相及不同细菌感染下细胞培养上清中细胞因子含量变化 |
患者血清中在TNF-α和IL-1β检测中除了1例标本的检测值:TNF-α为9.48 pg/L;IL-1β为131.81 pg/L 外,其余检测值都低于试剂的检测下限,升高的那例患者病情危重,临床诊断为严重败血症,右上臂蜂窝织炎及糖尿病。肝功能严重受损,血液黄疸严重。
3 讨论类鼻疽伯克霍尔德氏菌分布广、致病性强[6, 7, 8, 9],临床表现又不典型,易被误诊。由于类鼻疽是一种兼性胞内菌,侵入人体后虽然引起人体免疫细胞的一系列反应,却又能逃逸机体免疫清除作用而继续生长繁殖,这一感染逃逸机制至今仍未阐明。本文旨在以类鼻疽 感染人单核细胞的研究为切入点,从基本的细胞模型构建开始,为今后类鼻疽感染机制的研究工作奠定基础。
THP-1来源于人急性单核细胞,具有悬浮生长、培养简单的特点,是模拟研究类鼻疽伯克霍尔德氏菌感染人体免疫细胞的理想模型。因此我们通过建立稳定的类鼻疽伯克霍尔德氏菌感染THP-1细胞模型对探讨类鼻疽伯克霍尔德氏菌感染与免疫系统作用机制具有重要意义。
通过实验我们摸索了BP和BT的生长规律,为后续实验细菌感染复数(MOI)的确定奠定了基础。透射电镜不仅能确定细菌胞内感染成功,而且能观察到细胞的病理损伤情况,实验中BP感染的细胞在16 h即可看到细菌,而BT感染的细胞要到44 h才能看到细菌,这提示BP对人体具有比BT更强的侵袭力。在细菌感染细胞后观察细菌在胞内生存情况,发现BT复制率比BP高,这可能是因为BT对人体不致病,所以细胞对BT的免疫排斥没有BP强。这一现象在PEG3350预处理细胞后细菌胞内生存情况中也存在,但PEG3350诱导时细菌的生存情况是先下降再升高之后处于一个平台期。这可能是因为细菌开始侵入细胞时,由于免疫杀伤作用使其数量减少,之后细菌逃避宿主细胞免疫清除并开始增殖,在一段时间后达到拷 贝峰值,而后处于生长增殖的平台期。这一规律在IL-6 的检测中也有体现,BP感染的细胞上清的IL-6含量也是先升高后下降,这可能是细菌开始进入细胞时刺激细胞的免疫机制使其分泌的细胞因子升高,之后病原菌为逃避细胞的免疫防御而下调自身免疫原性,从而与宿主细胞和平共处,使细胞分泌的细胞因子下降。之后随着病原菌复制的增多,菌体的免疫原性或者分泌性抗原的增加使宿主的免疫反应性增强,分泌更多的细胞因子。随着感染时间延长,细胞免疫病理损伤越加严重,最终细胞崩解增加,使分泌的细胞因子再次下降。而BT感染细胞分泌的IL-6则只升高而无这一双峰变化也从另一方面加强这一推论的可能性。而PEG3350预处理的细胞可能是细胞膜的融合,结构性的改变促使其对细菌的初始入侵不够敏感,之后才调动免疫机制反应而使细胞因子升高。TNF-α的检测中可能由于BP逃逸细胞免疫的能力比BT强,故其感染开始时相对BT刺激细胞分泌的细胞因子不明显,后期随着细菌增殖的增多,免疫原性增加,刺激了细胞免疫反应性,而感染后期随着细胞的崩解,细胞因子分泌再次降低。而PEG3350预处理的细胞融合后降低了其免疫反应性,分泌的细胞因子持续下降。患者血清中的细胞因子含量除了一例临床症状特别严重的患者升高外,其他患者都降低,是否可以认为细胞因子的检测不能作为临床上类鼻疽感染的一个辅助检测指标这有待进一步研究确认。
本研究构建的类鼻疽伯克霍尔德氏菌感染THP-1细胞模型能较好地反映出类鼻疽伯克霍尔德氏菌感染人单核细胞的病理变化,为进一步研究该菌与宿主细胞的相互作用,阐明其致病机制和免疫机制具有重要的指导意义。
| [1] | Fang Y, Chen H, Li YL, et al. Melioidosis in Hainan, China: a restrospective study[J]. Transactions of the Royal Society of Tropical Medicine and Hygiene, 2015,109(10): 636-642. |
| [2] | Currie B J, Dance D A, Cheng A C. The global distribution of Burkholderia pseudomallei and melioidosis: an update[J]. Trans R Soc Trop Med Hyg, 2008, 102 Suppl 1: S1-S4. |
| [3] | Wiersinga W J, Currie B J, Peacock S J. Melioidosis[J]. N Engl J Med, 2012, 367(11): 1035-1044. |
| [4] | Sun G W, Lu J, Pervaiz S, et al. Caspase-1 dependent macrophage death induced by Burkholderia pseudomallei[J]. Cell Microbiol, 2005, 7(10): 1447-1458. |
| [5] | Chen Y L, Chen Y S, Lin H H, et al. Immunostimulatory flagellin from Burkholderia pseudomallei effects on an increase in the intracellular calcium concentration and up-regulation of TNF-alpha by mononuclear cells[J]. Microbiol Immunol, 2007, 51(1): 81-86. |
| [6] | Wuthiekanun V, Chierakul W, Rattanalertnavee J, et al. Serological evidence for increased human exposure to Burkholderia pseudomallei following the tsunami in southern Thailand[J]. J Clin Microbiol, 2006, 44(1): 239-240. |
| [7] | Subran B, Ackermann F, Watin-Augouard L, et al. Melioidosis in a European traveler without comorbidities: a case report and literature review[J]. Int J Infect Dis, 2013, 17(9): e781-e783. |
| [8] | Schultze D, Muller B, Bruderer T, et al. A traveller presenting with severe melioidosis complicated by a pericardial effusion: a case report[J]. BMC Infect Dis, 2012, 12: 242. |
| [9] | 马广强,王倩,朱金华, 等.广西地区类鼻疽伯克霍尔德氏菌的分布调查[J].第三军医大学学报, 2013, 35(2): 142-144. |



