2. 400037 重庆,第三军医大学新桥医院心血管内科,全军心血管病研究所
2.Department of Cardiology Xinqiao Hospital, Third Military Medical University, Chongqing, 400037, China
内皮前体细胞(endothelial progenitor cells,EPCs)为损伤性血管重塑的最重要细胞来源。移植EPCs可以促进损伤血管的再生修复[1]。但EPCs体外扩增难度大,其有限的来源已成为EPCs移植促使损伤性血管再生修复的瓶颈[2]。因此,提升EPCs的体内、外增殖与分化潜能具有极为重要的意义。EPCs的增殖与分化主要受外环境因素的影响,但最终还是由基因的选择性表达予以决定。因此,深入研究EPCs内在的增殖、分化调控机制显得尤为重要。
血管内皮生长因子(vascular endothelial growth factor,VEGF)是调控EPCs增殖、分化的重要因子之一。E2-2是干细胞分化转录调控的关键因子之一,能与VEGF受体2(VEGFR2)的启动子特异结合,阻止成熟内皮细胞(endothelial cells,ECs)VEGFR2的表达,抑制成熟ECs的增殖与迁移。但E2-2与EPCs增殖的调控机制尚不完全清楚。
本实验首先分离、培养和鉴定小鼠EPCs,其次构建小鼠E2-2基因的shRNA重组慢病毒载体,随后将E2-2基因的shRNA病毒感染EPCs,CCK-8法检测被感染EPCs的增殖情况并绘制其增殖曲线。RT-PCR、Western blot分别检测EPCs的E2-2及核抗原PCNA的表达变化并予以定量分析,进一步研究E2-2与EPCs的内在关系,以期为深入探讨EPCs的内在增殖调控机制奠定基础。
1 材料与方法 1.1 材料本研究使用的材料包括EGM-2培养基(Clonetics);FITC标记的Lectin(SIGMA);DiI-Ac-LDL(Biomedical Technologies Inc);内皮前体细胞分离试剂盒及F液(天津灏洋生物);Anti-Mouse CD34 FITC、Anti-Mouse Ly-6A/E(Sca-1)FITC与Anti-Mouse CD309 (FLK-1)PE抗体(Ebioscience);RT-PCR试剂盒、T4 DNA连接酶(大连宝生物);胶回收试剂盒与质粒抽提试剂盒(Roche);寡核苷酸Oligos、慢病毒载体FT203-PLVX及测序(广州辉骏),Lipofectamine® 2000(Invitrogen); CCK-8试剂盒(Toyobo);E2-2鼠单抗(Santa Cruz);PCNA兔多克隆抗体(Millipore)。
1.2 方法 1.2.1 EPCs的分离、培养及形态鉴定20只昆明小鼠[昆明医学院实验动物中心提供,生产许可证号:SCXK(滇)2005-0008,雌雄不拘,4周龄,体质量18~20 g,饲养于恒温18~20 ℃和恒湿50%~80%条件的SPF级动物实验,自由摄取标准饮料与无菌水]EPCs的分离、培养及吞噬荧光染料的形态鉴定参照文献[3, 4, 5]进行。
1.2.2 EPCs的表型流式细胞仪检测鉴定经胰酶消化后,用PBS洗涤原代培养7~12 d的EPCs,并重悬至细胞浓度为1×105/mL。参照各抗体使用说明书,分别用Anti-Mouse CD34 FITC、Anti-Mouse Ly-6A/E (Sca-1) FITC或Anti-Mouse CD309 (FLK-1) PE抗体与EPCs于37 ℃避光孵育1~2 h。以未加抗体的细胞作对照,流式细胞仪检测各抗体标记细胞的百分率。
1.2.3 E2-2最佳RNA干扰靶点的序列确定基于小鼠E2-2全长mRNA序列,筛选3个RNA干扰靶序列,分别为:①GCTGAGTGATTTACTGGAT;②CCC- AGTACTATCAGTATTC;③CGTCAGCTAGTGTTTCTAA,并合成其相应的siRNAs。即:①5′-GCUGAGUGAUUU-ACUGGAUUU-3′/ 3′-UUCGACUCACUAAAUGACCUA-5′;② 5′-CCCAGUACUAUCAGUAUUCUU-3′/3′-UUGGGUCA-UGAUAGUCAUAAG-5′; ③5′-CGUCAGCUAGUGUUUCUAAUU-3′/3′-UUGCAGUCGAUCACAAAGAUU-5′。分别用该3个siRNAs转染EPCs,以未转染的EPCs作对照,具体按操作说明进行。然后用RT-PCR检测各siRNAs对E2-2的抑制情况,以确定最佳的siRNA沉默靶序列。
1.2.4 小干扰RNA对E2-2蛋白表达的影响用Western blot法,将1.2.3中的各细胞总蛋白转置PVDF膜上,置于含E2-2鼠单抗(1 ∶500)的封闭液中,4 ℃ 过夜,同辣根过氧化物酶标记的相应二抗(1 ∶600)共同孵育,室温1.5 h,并与化学发光底物结合5 min。β-actin作内参。
1.2.5 慢病毒载体E2-2 shRNA的构建与鉴定设计与合成针对最佳siRNA的E2-2的shRNA靶序列(正义链:5′-GATCGCGTCAGCTAGTGTTTCTAATTCTC-GAGAATTAGAAACACTAGCTGACGTTTTT-3′,反义链:5′-AATTAAAAACGTCAGCTAGTGTTTCTAATTCTCGA- GAATTAGAAACACTAGCTGACGC-3′),并克隆至FT203- pLVX-shRNA2-zsGreen-PGK-Puro(FT203-pLVX)载体的BamHⅠ和EcoRⅠ酶切位点间,构建FT203-pLVX/E2-2shRNA重组慢病毒载体。转化感受态菌。测序鉴定FT203-pLVX/E2-2 shRNA重组慢病毒载体构建的正确性。
1.2.6 重组E2-2 shRNA慢病毒的包装与滴度测定将293T细胞接种于6孔板中,密度为5×105/孔,常规培养至70%~80%汇片生长时,在基因转染试剂及包装质粒(PLP1、PLP2、PLP-VSVG)的作用下,将测序正确的FT203-PLVX/E2-2shRNA质粒DNA转染293T细胞,8 h后更换新鲜培养基,继续培养至48 h,在倒置显微镜下观测其绿色荧光蛋白(GFP)的表达变化。继续培养至72 h,4 000×g 4 ℃ 离心10 min,收集细胞上清液。上清液经 0.45 μm无菌滤器过滤,收集滤液。经适当浓缩后,将滤液分装,-80 ℃存放备用。
将293T细胞接种于24孔板并用上述滤液予以感染,以倍比稀释法测定其滴度,并予以计算,公式为:滴度=(P×N/100×V)×1/DF,P:GFP阳性克隆数,N:105(每孔细胞数),V:病毒液稀释容量(mL),DF:稀释倍数。
1.2.7 EPCs的FT203-PLVX/E2-2shRNA慢病毒感染按1 ∶50(病毒液与培养液体积比)比例感染接种在6孔板中的第1代或原代EPCs,以未感染的细胞为对照,培养24~72 h,倒置显微镜下观测细胞GFP的表达变化。
1.2.8 FT203-PLVX/E2-2shRNA病毒对EPCs增殖的影响将原代分离或第1代的EPCs以3 000/(150 μL·孔)的密度接种于96孔板中,常规培养7 d,按1 ∶50(病毒液与培养液体积比)比例加入FT203-PLVX/E2-2shRNA病毒液;以未感染和经空病毒感染的EPCs作对照,单纯培养液作空白对照。感染后24、48、72、96 h分别取出1块96孔板,每孔更换含CCK-8(10 μL/孔)的新鲜培养液,继续培养3.5 h后,酶标仪检测其光密度值[D(450)]。以光密度值为纵轴,培养时间为横轴,绘制EPCs生长曲线。该实验重复3次。
1.2.9 沉默E2-2对EPCs核抗原基因PCNA表达的影响根据小鼠PCNA的mRNA序列设计与合成其检测引物,上游:5′-CTTGGCAATGGGAACA-3′,下游:5′-ACAGTGGAGTGGCTTT-3′。以经FT203-PLVX/E2-2shRNA病毒液感染的EPCs总RNA为模板,RT-PCR法分别检测E2-2与PCNA的表达变化,以经空病毒感染及未经感染的EPCs的同样检测为对照,β-actin基因的相同检测作内参。
1.2.10 沉默E2-2对EPCs的PCNA基因编码蛋白表达的影响Western blot将1.2.9的各细胞总蛋白转置PVDF膜上,分别置于含E2-2鼠单抗(1 ∶500)与PCNA兔单抗(1 ∶700)的封闭液中,4 ℃,24 h后同辣根过氧化物酶标记的相应二抗(1 ∶600)共同孵育(室温)1.5 h,并与化学发光底物结合5 min。β-actin作内参。
1.2.11 E2-2影响PCNA表达的定量分析采用Image-Pro Plus图像分析软件(Media Cybernetics Inc,USA)对1.2.9的RT-PCR检测结果中的PCNA基因表达变 化行灰度级(gray level,GL)定量分析,对1.2.10 的Western blot检测结果中的PCNA蛋白表达情况行光密度值定量分析,以此量化E2-2对PCNA表达的影响。
1.3 统计学分析 用SPSS 16.0统计软件对实验数据进行方差分析,结果以x±s表示。 2 结果 2.1 EPCs的分离、培养及鉴定骨髓单个核细胞经EPCs分离液分离后,用EPCs培养基EGM-2培养4~6 d,细胞呈“克隆”样生长。原代培养7~12 d与第1代培养48~72 h的EPCs呈三角形、多边形、圆形、椭圆形、少部分呈梭形(图1A)。荧光倒置显微镜下,EPCs摄入DiI-Ac-LDL后,细胞质呈艳红色(图1B);摄入Lectin后,细胞质呈艳绿色(图1C);同时摄入二者时,细胞质呈橙绿色或橙黄色(图1D)。
 |
| A:EPCs;B:EPCs+Lectin;C:EPCs+DiI-Ac-LDL;D:MERGE 图 1 内皮前体细胞的Lectin、DiI-Ac-LDL荧光染料标记染色的倒置显微镜观察 |
流式细胞仪检测表明,EPCs的CD34、Sca-1及 FLK-1的阳性率分别为85.8%、83.0%与54.0%(图2)。
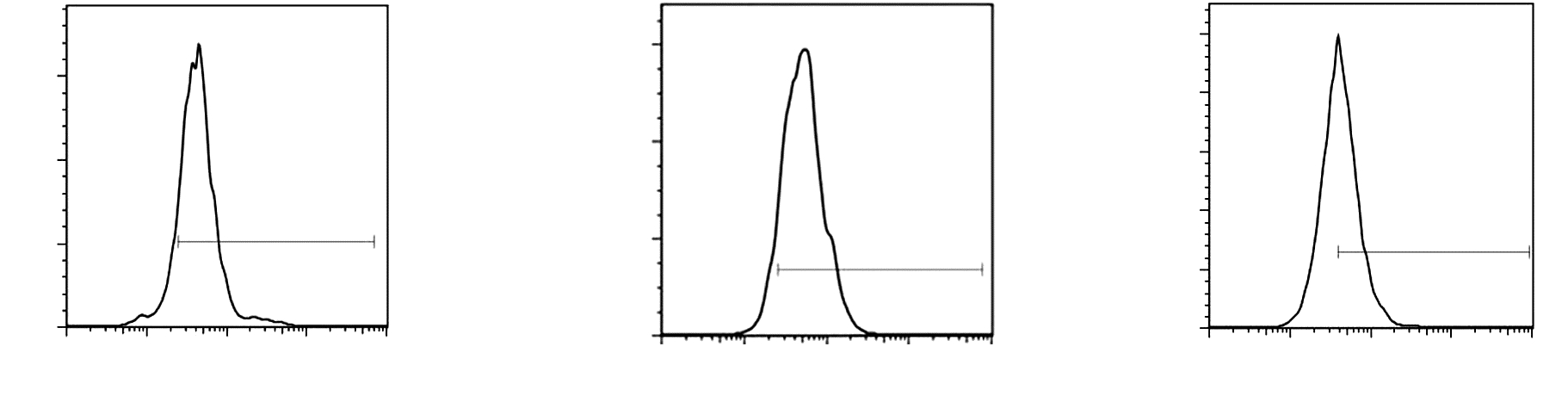 |
| A:CD34阳性率;B:Sca-1阳性率;C:FLK-1阳性率 图 2 流式细胞仪检测内皮前体细胞的CD34、Sca-1及FLK-1的阳性率 |
采用RT-PCR法从3个siRNA中筛选出最佳RNA 干扰靶序列为CGTCAGCTAGTGTTTCTAA(靶点3,图3)。
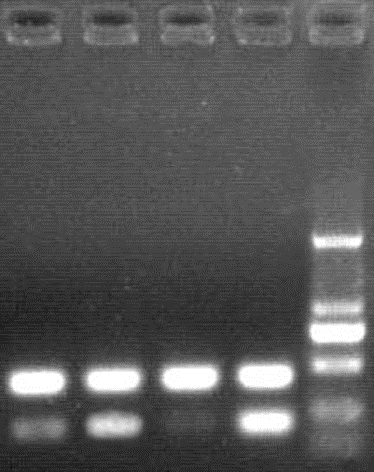 |
| 靶点1;2: 靶点2;3: 靶点3;4: 对照;M:DNA标准(DL 2000) 图 3 内皮前体细胞的E2-2基因3个RNA干扰靶点的RT-PCR检测分析 |
Western blot检测结果显示,与对照比较,3个siRNA 均可干扰E2-2蛋白的表达,其干扰程度依次为靶点3>靶点1>靶点2(图4)。
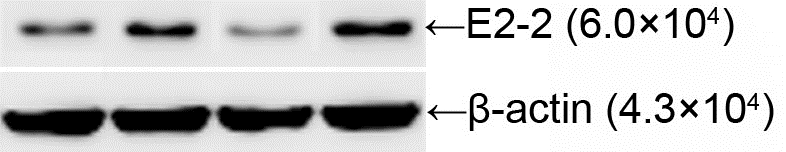 |
| 靶点1;2: 靶点2;3: 靶点3;4: 对照 图 4 内皮前体细胞E2-2的RNA干扰的Western blot检测分析 |
FT203-PLVX/E2-2shRNA重组慢病毒载体经测序证实(图5),携带E2-2shRNA的FT203-PLVX/E2-2shRNA重组慢病毒载体被成功构建。
 |
| 图 5 E2-2基因重组慢病毒载体发夹结构的序列测定 |
将测序正确的重组慢病毒FT203-PLVX/E2-2shRNA质粒DNA导入293T细胞(图6A),常规培养48 h后,荧光倒置显微镜下可见亮绿色荧光蛋白(GFP)表达(图6B)。倍比稀释法检测证实,其上清液的病毒滴度约为1×108 TU/mL。
 |
| A:正常293T细胞;B:FT203-PLVX/E2-2 shRNA重组慢病毒包装 图 6 经E2-2 shRNA重组慢病毒包装的293T细胞中GFP表达的荧光倒置显微镜观察 |
未经感染的EPCs不表达GFP(图7A),经重组慢病毒FT203-PLVX/E2-2shRNA感染的EPCs,荧光倒置显微镜下可见亮绿色GFP表达(图7B)。
 |
| A:未感染组;B:E2-2 shRNA慢病毒感染组 图 7经E2-2 shRNA重组慢病毒的EPCs中GFP表达的荧光倒置显微镜观察 |
CCK-8法检测表明,经FT203-PLVX/E2-2shRNA慢病毒感染的EPCs的增殖快于未经感染或经空病毒感染的EPCs,48 h开始显得更为明显(P < 0.01,图8)。
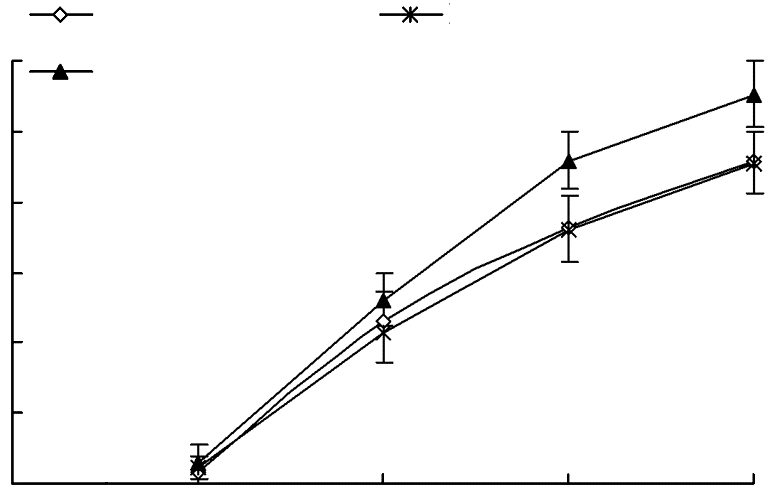 |
| a:P < 0.01,与EPCs+E2-2 shRNA比较 图 8 E2-2 shRNA重组慢病毒沉默EPCs的E2-2基因对其增殖影响的CCK-8检测分析 (n=3,x±s) |
RT-PCR检测与定量分析结果显示,以经FT203-PLVX/E2-2shRNA病毒感染48 h的EPCs总RNA为模板,未观察到E2-2基因的表达,可观察到核抗原基因PCNA的较强表达,以空病毒感染48 h的EPCs总RNA为模板,均能检测到E2-2与PCNA基因的表达(图9,表1)。Western blot检测及其定量分析结果表明,与空慢病毒感染的EPCs相比,FT203-PLVX/E2-2shRNA病毒感染48 h的EPCs,能检测到E2-2蛋白的微弱表达与PCNA蛋白的明显表达(图10,表1)。结果提示,FT203-PLVX/E2-2shRNA病毒能有效沉默EPCs的E2-2基因并上调其PCNA基因的表达。
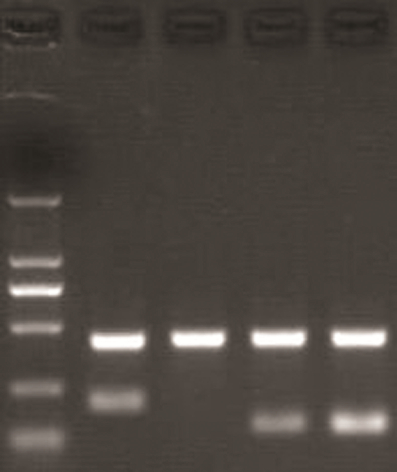 |
| M:DNA标准(DL 2000);1,3:空病毒感染的EPCs;2,4:FT203-PLVX/E2-2shRNA病毒感染的EPCs 图 9 E2-2 shRNA重组慢病毒沉默EPCs的E2-2基因对其PCNA基因表达的RT-PCR检测结果 |
 |
| 1:FT203-PLVX/E2-2shRNA病毒感染的EPCs;2:空病毒感染的EPCs 图 10 E2-2 shRNA重组慢病毒沉默EPCs的E2-2基因对其PCNA蛋白表达的Western blot检测结果 |
| (n=3,x±s) | ||
| 被检基因 | GL(mRNA水平) | 光密度值(蛋白水平) |
| 空病毒感染EPCs的PCNA | 119.84±6.24 | 0.98±0.09 |
| E2-2 shRNA病毒感染EPCs的PCNA | 168.71±7.36a | 1.39±0.13a |
| 空病毒感染EPCs的β-actin | 212.48±8.69 | 1.70±0.26 |
| a: P < 0.01,与空病毒感染EPCs的PCNA比较 | ||
血管发生(vasculogenesis)与血管生成(angiogenesis)依赖于成熟ECs的增殖、迁移与重塑,是血管形成的两个重要过程。EPCs是完全分化的血管ECs的前体细胞(包括从成血管母细胞到完全分化的ECs之间的各阶段细胞),其增殖、分化能力旺盛,可趋化到血管新生部位并分化为成熟ECs[6]。EPCs与血管形成关系密切,在临床的血管损伤、动脉粥样硬化及各种血管性缺血性疾病中有着广泛的应用前景。多种组织,包括骨髓、脐血、外周血与胚胎均蕴含EPCs。其中骨髓EPCs的含量最高。尽管EPCs来源广泛,但其增殖能力有限,其体外大量扩增比较困难,严重制约了其临床的广泛应用。
我们采用EPCs专用分离试剂,从小鼠骨髓成功分离获得EPCs。经EGM-2培养基(特制培养基)培养 4~7 d,大多EPCs呈“克隆”性生长。原代培养7~12 d 及第1代培养24~72 h的EPCs呈三角形、多边形、圆形、椭圆形、少部分呈梭形。用荧光吞噬染料鉴定证实,EPCs摄入DiI-Ac-LDL后,细胞质呈亮红色,摄入Lectin后,细胞质呈亮绿色,两者共同摄入的EPCs,其细胞质呈橙绿色或橙黄色。EPCs既表达干细胞标志,如CD34、Sca-1,又表达内皮细胞标志,如FLK-1[7]。本实验分离培养的EPCs,经流式细胞仪检测表明,其CD34、Sca-1及FLK-1的阳性率分别为85.8%、83.0%与54.0%。
E2-2属HLH转录因子家族一成员,又名TCF4,在大鼠、小鼠及人均有表达[8]。已有研究显示,E2-2是促进干细胞分化的关键转录调控因子,在神经系统、淋巴细胞发育等过程中均具重要调控作用[9, 10]。E2-2能使成熟ECs的增殖、迁移与管样形成受抑,进而阻碍ECs介导的血管生成[11, 12]。VEGF是调控EPCs增殖以及ECs多种生物学功能的关键生长刺激因子,其受体FLK-1是EPCs的特异性标记分子,E2-2与FLK-1启动子特异性结合能下调成熟ECs中FLK-1的表达,但沉默E2-2后,EPCs的将有何变化尚不清楚。
本研究首先分离、培养EPCs,并对其进行荧光染料标记与表面标志的流式检测鉴定,随后采用慢病毒介导shRNA沉默其E2-2基因。shRNA病毒对靶基因的沉默效率通常不会是100%,本研究中E2-2靶基因的表达均会残留一定水平,但图9未能观察到靶基因的表达,其原因可能是电泳时间过长消耗掉了本来表达比较弱的E2-2基因DNA所致。本研究CCK-8法检测表明,与对照比较,沉默E2-2基因后,EPCs的增殖明显增强。RT-PCR、Western blot及定量结果显示,沉默E2-2基因后,EPCs核抗原基因PCNA及其编码蛋白表达明显上调。这些结果提示,E2-2蛋白是阻止EPCs增殖的关键因子之一,沉默相关因子基因可能是提升EPCs的增殖能力进而实现EPCs体外大量扩增的有效途径。
| [1] | Wassmann S, Werner N, Czech T, et al. Improvement of endothelial function by systemic transfusion of vascular progenitor cells[J]. Circ Res, 2006, 99(8): e74-e83. |
| [2] | Wohrle J, Birkemeyer R, Markovic S, et al. Prospective randomised trial evaluating a paclitaxel-coated balloon in patients treated with endothelial progenitor cell capturing stents for de novo coronary artery disease[J]. Heart, 2011, 97(16): 1338-1342. |
| [3] | Sekiguchi H, Ii M, Jujo K, et al. Improved culture-based isolation of differentiating endothelial progenitor cells from mouse bone marrow mononuclear cells[J]. PLoS One, 2011, 6(12): e28639. |
| [4] | Ii M, Nishimura H, Iwakura A, et al. Endothelial progenitor cells are rapidly recruited to myocardium and mediate protective effect of ischemic preconditioning via “imported” nitric oxide synthase activity [J]. Circulation, 2005, 111(9): 1114-1120. |
| [5] | 刘晓丽, 杨海捷, 苏勇, 等. E2-2基因腺病毒载体的构建及其对EPCs生长、增殖及ID1表达的影响[J]. 第三军医大学学报, 2014, 36(16): 1664-1669. |
| [6] | Morris L M, Klanke C A, Lang S A, et al. Characterization of endothelial progenitor cells mobilization following cutaneous wounding[J] . Wound Repair Regen,2010,18(4): 383-390. |
| [7] | Wang H, Yu Y, Guo R W, et al. Inhibitor of DNA binding-1 promotes the migration and proliferation of endothelial progenitor cells in vitro[J]. Mol Cell Biochem, 2010, 335(1/2): 19-27. |
| [8] | Navarrete K, Pedroso I, De-Jong S, et al. TCF4 (e2-2; ITF2): a schizophrenia-associated gene with pleiotropic effects on human disease[J]. Am J Med Genet B Neuropsychiatr Genet, 2013, 162B(1): 1-16. |
| [9] | Lazorchak A, Jones M E, Zhuang Y. New insights into E-protein function in lymphocyte development[J]. Trends Immunol, 2005, 26(6): 334-338. |
| [10] | de-Pooter R F, Kee B L. E proteins and the regulation of early lymphocyte development[J]. Immunol Rev, 2010, 238(1): 93-109. |
| [11] | Tanaka A, Itoh F, Nishiyama K, et al. Inhibition of endothelial cell activation by bHLH protein E2-2 and its impairment of angiogenesis [J]. Blood, 2010,115(20): 4138-4147. |
| [12] | Yang W, Itoh F, Ohya H, et al. Interference of E2-2-mediated effect in endothelial cells by FAM96B through its limited expression of E2-2[J]. Cancer Sci, 2011, 102(10): 1808-1814. |



