前交叉韧带(anterior cruciate ligament,ACL)对于膝关节的稳定和功能起着至关重要的作用[1, 2]。研究发现在正常韧带-骨界面存在一个复杂的、连续分布的移行带(continuous gradients layers),由浅至深依次为纤维层(成纤维细胞和Ⅰ型胶原)、非钙化纤维软骨(卵圆形软骨细胞和Ⅱ型胶原)、钙化纤维软骨(肥大软骨细胞和X型胶原)、软骨下骨[3]。该缓冲界面可使不同类型组织之间的复杂载荷和应变再次分布、分散剪切、避免应力集中,确保韧带-软骨-软骨下骨间的解剖完整和力学稳定。鉴于此,本课题组认为恢复韧带-骨界面间连续的、具有异质性过渡结构的韧带-骨连接体是重建ACL损伤的生物学目标。本研究采用取材方便、来源广泛、与交叉韧带力学性能相仿的脱细胞兔跟腱为支架材料,通过胶原水凝胶将异质性细胞群种植于该支架内预先特定的区域,构建一种具有纤维形成、软骨形成及骨形成3个功能区域的细胞-肌腱复合物重建兔前交叉韧带研究韧带-骨界面的再生,在本实验中支架被分成单独的5段,成纤维细胞被种植于支架的中间(纤维生成区,FB),软骨细胞被种植于成纤维细胞的两侧(软骨生成区,CH),成骨细胞则被种植于支架的两端(成骨生成区,OS),成功构建这一拟生理的“移行结构”化细胞-肌腱复合物后[4],将该复合物重建新西兰大白兔ACL 8周后行组织学、免疫荧光及显微CT分析,了解移植物与骨隧道间韧带-纤维软骨-骨力学缓冲界面的形成情况。
1 材料与方法 1.1 实验动物及主要试剂、仪器成年新西兰大白兔24只,体质量2~2.5 kg,均为雄性,由第三军医大学新桥医院实验动物中心提供。兔成纤维细胞(ATCC,American type culture collection),Ⅱ型胶原蛋白酶、胰蛋白酶、FBS(HyClone公司,美国);DMEM培养基、TGF-β1、抗坏血酸、胶原酶(Sigma公司,美国);微量注射器(浙江三爱仪器厂),显微CT(micro computed tomography),Instron4301(instron corporation,UK)等。
1.2 移行结构化细胞-肌腱复合物的构建按照本课题组前期所描述的方法构建“移行结构化”细胞-肌腱复合物[4]。实验分组(n=6)及具体构建方法如下:单纯脱细胞支架组、软骨细胞(CC)+成纤维细胞(Fb)+CC组、成骨细胞(OB)+Fb+OB组、OB+CC+Fb+CC+OB组。移行结构化细胞-肌腱复合物原理图见图1。参照Rossi等[5]的方法,一种作为三维基质携带种子细胞种植于多孔脱细胞支架内的胶原水凝胶被制备,此水凝胶在4 ℃时不会凝胶,37 ℃ 孵箱内静置时则会发生凝胶现象。因此,在4 ℃ 时可以混悬种子细胞后再注入支架,使细胞在各自既定区域内增殖、分化。首先溶解100 mg的可溶于酸的牛皮肤Ⅰ型胶原于40 mL 0.1%的无菌乙酸溶液(用无菌双蒸水配制,220 μm细菌滤过器过滤除菌)中(溶液A),接着分别配制0.34 mol/L的NaOH和10×DMEM液,220 μm细菌滤过器过滤除菌后,按体积比1 ∶2的比例将0.34 mol/L的NaOH和10×DMEM液混匀(溶液B),最后将溶液A与溶液B按4 ∶1的体积比混匀(溶液C),220 μm细菌滤过器过滤除菌后,在超净台内向溶液C内加入1%的青霉素/链霉素即为本实验所需的胶原水凝胶溶液。将脱细胞兔跟腱(长40 mm)用70%乙醇浸泡1 d后用无菌PBS漂洗过夜后,用1 mL微量注射器分别取1×106的成纤维细胞或1×106的软骨细胞或1×106的成骨细胞液态水凝胶悬液,分别沿支架纵轴注射入支架的FB段、CH段(两侧各0.5 mL)和OS段(此过程在10 min内完成)。待水凝胶完全固化后,将复合物置于含10%胎牛血清,1.5 mg/mL β-磷酸甘油,100 U/mL青霉素,100 g/mL链霉素,TGF-P 10 ng/mL,抗坏血酸50 μg/mL 的DMEM/F12 高糖培养液中,静置培养3周,即为本实验所构建的ACL替代物;CC+Fb+CC组除成骨段只用等量水凝胶处理外,其余各步同实验组;OB+Fb+OB组除成软骨段只用等量的水凝胶处理外,其余各步同实验组。
 |
| FB:纤维生成区;CH:软骨生成区;OS:成骨生成区图 1 移行结构化细胞-肌腱复合物原理图 |
24只新西兰大白兔,实验前运动良好,可奔跑,未见关节肿胀、跛行及其他异常,膝关节前抽屉实验均(-)。术前2 h,取构建好的移行结构化细胞-肌腱复合物,置于等渗盐水内自然复温。分别在移植物两端,用直径0.1 mm可吸收缝合线编织移植物。随机取一侧后肢做膝前正中切口,沿髌韧带外侧进入关节腔(关节腔内未见明显异常),髌骨向内侧脱位后切除滑膜、髌下脂肪垫、内侧半月板前角及半月板横韧带,显露ACL,并标记起止点后切除ACL。术中行前抽屉实验示阳性。用1 mm克氏针以正常ACL起止点为标志分别钻取胫骨股骨隧道,用电钻成型骨隧道使之与移植物直径相匹配,并在骨隧道出口处用克氏针钻取骨桥,将移行结构化细胞-肌腱复合物依次穿过胫骨股骨隧道,于屈膝60°位收紧打结固定于骨桥上,并检查前抽屉实验及Lachman实验阴性。庆大霉素盐水冲洗关节腔,关闭切口(图2)。术后石膏固定3周,每天肌注青霉素2次(40万U/次),连续1周。笼内饲养,自由活动。于术后8周处死实验兔,分别行组织学及显微CT观察。
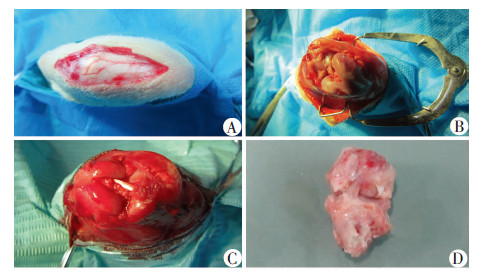 |
| A:手术切口;B:标记ACL的起止点;C:重建后的前交叉韧带外观;D:8周后的胫骨-移植物-股骨标本外观图 2 移行结构化细胞-肌腱复合物重建兔ACL动物模型 |
取股骨-移植物-胫骨复合体组织,10% 中性福尔马林固定,脱钙,石蜡包埋,制成5 μm厚切片,以小鼠抗兔Ⅱ型胶原2A1(collagen 2A1,COL 2A1,稀释浓度为1 ∶50)和山羊抗兔骨钙素(osteocalcin,OCN,稀释浓度为1 ∶100)作为一抗标记组织切片,以FITC标记的驴抗小鼠(稀释浓度为1 ∶50)及Cy3标记的驴抗山羊(稀释浓度为1 ∶100)荧光抗体为二抗,DAPI(蓝色)行细胞核标记,观察复合物内软骨细胞段及成骨细胞段的软骨、骨的形成情况,同时用苏木精-伊红和阿利新蓝染色分别观察复合组织工程韧带关节腔内纤维组织,骨隧道内软骨及骨的连续分布情况。
1.5 显微CT检测取股骨-移植物-胫骨复合体组织,两端各保留长约5 cm的胫骨和股骨,清除其他韧带及关节囊组织,用10%中性福尔马林固定后,行显微CT逐层扫描并重建,观察移植物成骨段在骨隧道腔径的变化及隧道内的成骨情况。
2 结果 2.1 组织学和免疫荧光分析采用连续切片及特殊组织学染色观察股骨-移植物-胫骨复合体组织内的基质分布情况。通过阿利新蓝染色观察移植物-骨隧道内的糖胺聚糖(glucosamine glycolic acid,GAG)形成,结果显示GAG只存在于CC+ Fb+CC组和OB+CC+Fb+CC+OB组的CH段(移植物-骨隧道界面)内,其余区域内未发现有明显的 GAG形成(图3);免疫荧光发现COL2A1只存在于CC+ Fb+CC组和OB+CC+Fb+CC+OB组内,其余各组未发现有明显的COL2A1形成(图4B、D),OCN只存在于OB+Fb+OB组和OB+CC+Fb+CC+OB组内,其余区域内未发现有明显的OCN形成(图4C、D);同时,在OB+CC+Fb+CC+OB组内发现既有COL2A1,也有OCN的存在,且呈现自CH段至OS段的COL2A1-OCN连续分布现象(图4D),然而,在单纯脱细胞支架组既未发现有COL2A1,也未发现有OCN的存在(图4A)。
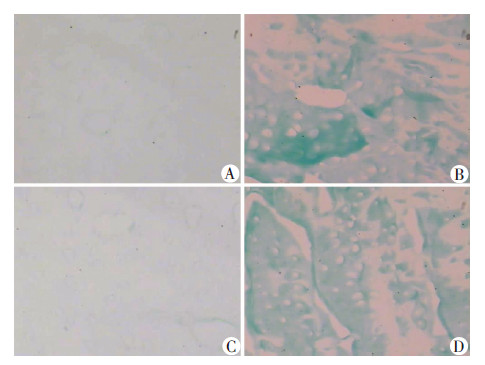 |
| A:单纯脱细胞支架组;B:CC+Fb+CC组;C:OB+Fb+OB组;D:OB+CC+Fb+CC+OB组 图 3 阿利新蓝染色观察韧带-骨隧道界面GAG 生成情况 (×200) |
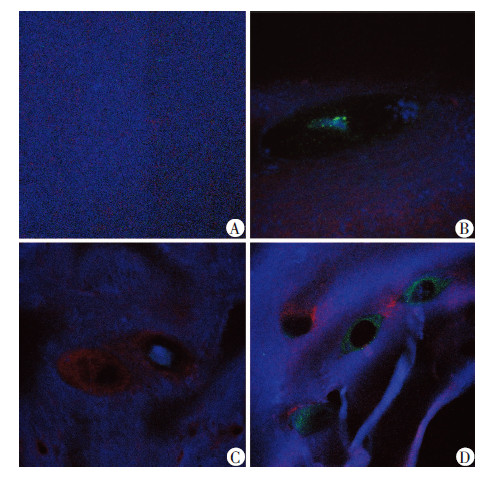 |
| A:单纯脱细胞支架组;B:CC+Fb+CC组;C:OB+Fb+OB组;D:OB+CC+Fb+CC+OB组图 4 免疫荧光观察移植物-骨隧道界面骨、软骨的 生成情况 (×400) |
在关节腔内纤维生成区内(FB段),HE染色观察到几乎与脱细胞前跟腱一致的细胞及胶原纤维分布,新生成的相互连接的纤维明显缩小了支架的孔径及孔隙率,而单纯脱细胞支架组则呈现与细胞接种前完全一致的结构(图5A),但由于接种细胞的同源性,在各组间未发现有明显差异(图5B~D)。
 |
| A:单纯脱细胞支架组;B:CC+Fb+CC组;C:OB+Fb+OB组;D:OB+CC+Fb+CC+OB组 图 5 HE染色分析关节内移植物区域纤维生成情况 (×200) |
取股骨-移植物-胫骨复合体组织,清除其他韧带及关节囊组织,用10%中性福尔马林固定后,行显微 CT逐层扫描。结果显示,OB+Fb+ OB组和OB+CC+Fb+CC+OB组骨隧道腔直径明显缩小,充填大量骨组织,而单纯脱细胞支架组和CC+Fb+CC组内仍可见骨隧道腔存在,而且未见有明显的骨组织形成(图6)。
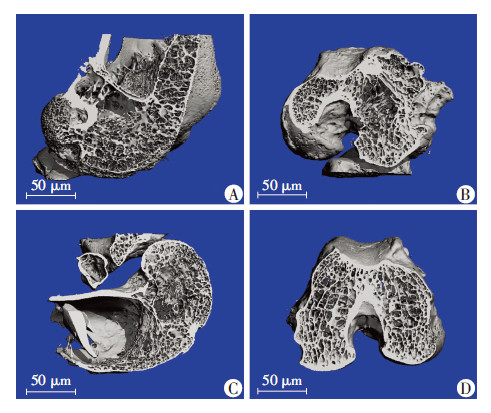 |
| A:单纯脱细胞支架组;B:CC+Fb+CC组;C:OB+Fb+OB组;D:OB+CC+Fb+CC+OB组 图 6 显微CT观察骨隧道内腔径及骨组织形成情况 |
交叉韧带损伤的重建是当前再生医学和矫形外科共同面临的难题。目前,尽管同种异体肌腱移植、同种异体骨-肌腱-骨移植等方法已成为治疗交叉韧带损伤的主流策略,但同种异体移植物来源受限且成本高昂,同时远期疗效不满意,且长期随访结果显示,重建后仍有10%~25%的失败率[6]。
主要原因如下:①异体肌腱移植主要的问题是排斥反应,未经抗原处理的异种肌腱直接使用后可引起宿主的排斥反应,导致移植失败;②“雨刷效应”使骨隧道扩大、移植物磨损,最终导致移植物松弛乃至断裂。对失败病例翻修时发现:腘绳肌腱重建结构偏向于纤维特征,而髌韧带重建结构偏向于软骨特征。另有研究观察重建术后肌腱-骨隧道界面的组织学变化:2周可见瘢痕组织充填间隙,1个月后演变为致密结缔组织,6周后可见Ⅰ型胶原大量分布,至3个月仍未发现明显新生骨和软骨形成,未见有拟生理结构的纤维组织-纤维软骨-骨的“移行结构”形成[7]。因此,最大限度地降低移植物的免疫原性,从界面组织工程学角度,体外构建拟生理的(韧带-软骨-软骨下骨)复合物,重建韧带-骨连接体或许将有效提高交叉韧带重建的远期成功率。
兔跟腱是一种细胞成分少的致密结缔组织,主要由抗原性相对较弱的Ⅰ型胶原组成,并且来源广泛、制备便捷、与兔交叉韧带生物力学性能极其相似。目前用于降低组织器官抗原性的策略主要是脱细胞法。主要有射线照射、反复冻融、胰蛋白酶、95%乙醇、Triton X-100、脱氧胆酸盐、SDS等,但各自均有不足之处。反复冻融可以高效地裂解组织和器官内的细胞,并能降低支架材料的免疫原性,但并不能清除膜性和细胞内成分[8];胰蛋白酶能有效地提高后续脱细胞试剂对组织的穿透力,但有破坏组织的超微结构[9];Triton X-100在组织中有很好的细胞清除作用,但对组织的超微结构破坏和蛋白聚糖的清除作用较弱[10, 11, 12]。SDS能高效地清除细胞核残余物、胞浆蛋白,但有减少糖胺聚糖、生长因子以及毁坏胶原纤维的趋势[13, 14, 15, 16]。综合考虑反复冻融、胰蛋白酶、Triton X-100及SDS的脱细胞作用,本课题组前期研究表明,联合运用该4种方法对跟腱进行脱细胞处理,并行组织学、电镜扫描及细胞兼容性检测,结果显示该方法处理后跟腱,脱细胞效果显著,腱束间孔径增加(100~300 μm),孔隙率几乎达到了50%以上,并且细胞兼容性良好,有利于异质性细胞的种植[4, 17]。这一结果与既往研究相似[9, 18]。
众多研究提示,界面组织工程的设计,要求体现细胞、结构的非均一性及功能的移行化,以达到移植物与宿主间的生物愈合[19, 20, 21]。文献[22]指出:理想的韧带-骨移行结构替代物应体现理化性质(如硬度、孔隙、亲/疏水性)、生长信号(如细胞黏附、生长、分化因子)以及细胞表型的连续过渡。Bi等[23]将异质性细胞群落(heterogenous cell population,如成纤维系、成软骨系和成骨系)与多相材料复合带动了异种界面重建的飞跃。文献[24]强调了细胞间相互作用和同种多相支架(single scaffold with three phases)在韧带-骨界面替代中的重要作用,其小组利用聚乳酸-乙醇酸共聚物(PLGA)网架(A相)、PLGA微球(B相)和PLGA/生物玻璃(C相)构建同种三相支架,将成纤维细胞和成骨细胞分别植入A、C相共培养后发现Ⅰ型胶原和矿化区域的形成,B相见明显细胞迁移、基质形成和血管生成,但无明确的纤维软骨。后续将成纤维细胞、软骨细胞、成骨细胞扩大培养,术后2个月可见连续的纤维软骨样组织桥接于A、C相之间,软骨样细胞栖息于Ⅰ、Ⅱ型胶原和蛋白多糖的基质内,成功地在软组织、骨界面间实现软骨缓冲区的再生。尽管如此,该材料用以替代韧带仍存在生物力学特征(如韧性、弹性模量、组织兼容性等)的差异。
因此,本研究采用取材方便、来源广泛,与交叉韧带力学性能相仿的兔跟腱,通过反复冻融、Trypsin、Triton X-100、SDS进行序贯性脱细胞处理。前期实验结果显示:与新鲜跟腱相比,脱细胞跟腱腱束间腱细胞消失,孔径及孔隙率都显著增加;并且通过细胞兼容性的检测,我们发现细胞与该脱细胞支架材料细胞兼容性良好,适于异质性细胞的生长[4]。接着,将支架人为地分为3个功能区(FB区、CH区、OS区),采用胶原水凝胶赋型将成纤维细胞接种于FB区成纤维、软骨细胞种植于CH区成软骨及成骨细胞种植于OS区成骨,构建移行结构化组织工程细胞-肌腱复合物,通过体外实验证实这一结构被成功构建后移植入体内观察其的体内愈合效果。
我们将构建好的移行结构化组织工程细胞-肌腱复合物植入兔体内8周后行组织学、免疫荧光及显微CT分析,结果显示软骨标志物只在软骨段内生成,即复合物-骨隧道界面;而骨标志物只在成骨段内生成,即骨隧道内;并在移植物-骨隧道界面发现有COL2A1-OCN(软骨-骨)的连续分布现象。此外,无特异性的纤维生成段内(关节腔部分),新生的相互连接的胶原纤维明显缩小了支架的孔径及孔隙率,有效地修复了纤维生成段的胶原结构。
本研究的主要贡献为在脱细胞异体肌腱内一种细胞间相互作用可控性、基质分布不均一性的多组织(纤维-纤维软骨-骨)过渡结构不仅在体外被成功复制,而且通过在体动物实验证明该复合物移植体内后,在骨隧道内骨化明显,关节腔内则以韧带形式存在,形成了以韧带-纤维软骨-骨过渡层次的拟生理结构。然而,本实验仍存在不足之处:生物力学研究正在进行中,未出结果;且观察时间较短,有待于进一步实验数据的验证。同时,我们还发现,异质性细胞在脱细胞支架内的分化、基质形成并不显著。这可能与细胞在脱细胞支架内的生长及分化能力降低有关系,后期研究可行软骨及成骨基因的转染修饰,促进骨软骨标志物在支架内的大量生成。
| [1] | Moffat K L, Sun W H, Pena P E, et al. Characterization of the structure-function relationship at the ligament-tobone interface[J]. Proc Natl Acad Sci U S A, 2008, 105(23): 7947-7952. |
| [2] | Spalazzi J P, Gallina J, Fung-Kee-Fung S D, et al. Elastographic imaging of strain distribution in the anterior cruciate ligament and at the ligament-bone insertions[J]. J Orthop Res, 2006, 24(10): 2001-2010. |
| [3] | Subit D, Masson C, Brunet C, et al. Microstructure of the ligament-to-bone attachment complex in the human knee joint[J]. J Mech Behav Biomed Mater, 2008, 1(4): 360-367. |
| [4] | Wang Z, Zhang Y, Zhu J, et al. In vitro investigation of a tissue-engineered cell-tendon complex mimicking the transitional architecture at the ligament-bone interface[J]. J Biomater Appl, 2015, 29(8): 1180-1192. |
| [5] | Rossi L, Boccardo F, Corvo R. Endothelial cells increase the radiosensitivity of oropharyngeal squamous carcinoma cells in collagen gel[J]. Oral Oncol, 2004, 40(2): 214-222. |
| [6] | Lui P, Zhang P, Chan K, et al. Biology and augmentation of tendon-bone insertion repair[J]. J Orthop Surg Res, 2010, 5: 59. |
| [7] | Lu H H, Subramony S D, Boushell M K, et al. Tissue engineering strategies for the regeneration of orthopedic interfaces[J]. Ann Biomed Eng, 2010, 38(6): 2142-2154. |
| [8] | Cao D, Liu W, Wei X, et al. In vitro tendon engineering with avian tenocytes and polyglycolic acids: a preliminary report[J]. Tissue Eng, 2006, 12(5): 1369-1377. |
| [9] | Whitlock P W, Smith T L, Poehling G G, et al. A naturally derived, cytocompatible, and architecturally optimized scaffold for tendon and ligament regeneration[J]. Biomaterials, 2007, 28(29): 4321-4329. |
| [10] | Crapo P M, Gilbert T W, Badylak S F. An overview of tissue and whole organ decellularization processes[J]. Biomaterials, 2011, 32(12): 3233-3243. |
| [11] | Brown B N, Valentin J E, Stewart-Akers A M, et al. Macrophage phenotype and remodeling outcomes in response to biologic scaffolds with and without a cellular component[J]. Biomaterials, 2009, 30(8): 1482-1491. |
| [12] | 解传飚, 林月秋, 阮默, 等. EDC交联改性的脱细胞异种(猪)肌腱生物学特性研究[J]. 中国临床解剖学杂志, 2010, 28(4): 425-429. |
| [13] | 冷元曦, 林月秋, 阮默, 等. 肌腱移植材料的研究进展[J]. 中国矫形外科杂志, 2009, 17(22): 1704-1706. |
| [14] | Yang B, Zhang Y, Zhou L, et al. Development of a porcine bladder acellular matrix with well-preserved extracellular bioactive factors for tissue engineering[J]. Tissue Eng Part C Methods, 2010, 16(5): 1201-1211. |
| [15] | 胡成栋, 刘曦, 张伯勋, 等. 脱细胞鸡肌腱的制备与体外生物力学测定的实验研究[J]. 河北医药, 2011, 33(18): 2761-2763. |
| [16] | 梁黎明, 柴家科, 杨红明, 等. 脱细胞肌腱制备的实验研究[J]. 中国美容医学, 2006, 15(3): 239-240. |
| [17] | 王直兵, 张峡, 郭新宇, 等. 脱细胞跟腱复合人成纤维细胞共培养的实验研究[J].中国修复重建外科杂志, 2013, 27(7): 805-809. |
| [18] | Ni M, Rui YF, Tan Q, et al. Engineered scaffold-free tendon tissue produced by tendon-derived stem cells[J]. Biomaterials, 2013, 34(8): 2024-2037. |
| [19] | He J, Zhang W, Liu Y, et al. Design and fabrication of biomimetic multiphased scaffolds for ligament-to-bone fixation[J]. Mater Sci Eng C Mater Biol Appl, 2015, 50: 12-18. |
| [20] | Li X, He J, Bian W, et al. A novel silk-TCP-PEEK construct for anterior cruciate ligament reconstruction: an off-the shelf alternative to a bone-tendon-bone autograft[J]. Biofabrication, 2014, 6(1): 015010. |
| [21] | Li X, He J, Bian W, et al. A novel silk-based artificial ligament and tricalcium phosphate/polyether ether ketone anchor for anterior cruciate ligament reconstruction-safety and efficacy in a porcine model[J]. Acta Biomater, 2014, 10(8): 3696-3704. |
| [22] | Dormer N H, Berkland C J, Detamore M S. Emerging techniques in stratified designs and continuous gradients for tissue engineering of interfaces[J]. Ann Biomed Eng, 2010, 38(6): 2121-2141. |
| [23] | Bi Y, Ehirchiou D, Kilts T M, et al. Identification of tendon stem/progenitor cells and the role of the extracellular matrix in their niche[J]. Nat Med, 2007, 13(10): 1219-1227. |
| [24] | Spalazzi J P, Dagher E, Doty S B, et al. In vivo evaluation of a multiphased scaffold designed for orthopaedic interface tissue engineering and soft tissue-to-bone integration[J]. J Biomed Mater Res A, 2008, 86(1): 1-12. |



