牙囊是牙齿发育期间包绕牙胚的疏松结缔组织,其组织来源于外胚间充质,是牙骨质、牙槽骨和牙周膜的起源组织,含有干细胞和形成牙周组织的前体细胞亚群[1, 2]。这些细胞不仅在牙齿萌出中发挥着重要作用[2],而且在一定条件刺激下可以形成牙骨质、牙周膜以及牙槽骨[3, 4]。经典牙齿发育学说中,在牙胚的生长发育过程中,牙囊的大部分组织与牙髓组织被牙冠或者赫特维希上皮根鞘所隔离,使得牙囊组织中的牙囊干细胞与牙髓组织中的牙髓干细胞存在直接或间接的接触[5]。因此在牙胚的发育过程中,牙髓干细胞可能对牙囊干细胞具有促进增殖、分化的作用,但目前相关报道较少。为了进一步验证这个假设,本实验通过体外建立人牙囊细胞(human dental follicle stem cells,HDFSCs)与人牙髓细胞(human dental pulp stem cells,HDPSCs)共培养体系,探索HDPSCs通过细胞间的间接接触对HDFSCs增殖、成骨分化的作用。
1 材料与方法 1.1 材料 1.1.1 主要实验仪器超净工作台(苏州安泰空气技术公司);梯度PCR仪(Eppendorf公司);CO2培养箱(Thermo Scientific公司);倒置相差显微镜(Carl Zeiss公司);分选型流式细胞仪(BD influx公司);正置荧光显微镜(Nikon公司);荧光定量PCR仪(Bio-Rad 公司)。
1.1.2 主要试剂DMEM/F12 1 ∶1培养基(Gibco公司);胎牛血清(FBS,Gibco公司);PBS(HyClone公司);兔抗人波形丝蛋白抗体(ImmunoWay公司);鼠抗人角蛋白(CK-14)抗体(Santa Cruz 公司);羊抗兔抗体(中杉金桥公司);羊抗鼠抗体(Abbkine公司);鼠抗人CD34、CD73、CD105及Strol-1抗体(BD Biosciences公司);RNA抽提试剂盒、反转录试剂盒及Syber Green荧光定量PCR检测试剂盒(TaKaRa公司);CCK-8试剂盒(Dojindo公司);Transwell小室(Corning公司)。
1.2 方法 1.2.1 细胞的分离、原代及传代培养HDFSCs来源于重庆医科大学附属口腔医院因正畸需要拔除的第三磨牙(经患者知情同意),要求患者牙齿健康、无牙周炎症、牙冠形成但牙根还未完全形成、年龄18~30岁。 取出牙囊组织后立即转入含双抗的无血清DMEM/F12 1 ∶1培养液中,含2%双抗的PBS反复冲洗。采用改良的组织块-消化联合法分离培养HDFSCs。步骤:眼科剪将牙囊组织剪成约1 mm×1 mm×1 mm大小组织块,转入0.1%的Ⅰ型胶原酶37 ℃水浴消化1 h,每5分钟震荡1次,再加入0.25%胰蛋白酶37 ℃水浴消化5 min,53 612×g常温离心5 min,弃上清液,10%FBS、1%双抗的DMEM/F12 1 ∶1培养液3 mL重悬细胞,置入T25培养瓶内,放入37 ℃、5% CO2饱和湿度孵箱中静置孵育,每3天换液1次,倒置相差显微镜下观察细胞生长状况,待细胞融合度达80%时进行传代。利用上皮细胞与牙囊细胞对胰酶的耐受性差异,去除上皮细胞,纯化牙囊细胞,第3代细胞用于后续实验。
HDPSCs来源于重庆医科大学附属口腔医院因正畸需要拔除的正畸牙和第三磨牙(经患者知情同意),要求患者牙齿健康、无牙周炎症、年龄12~30岁。取得的牙齿用0.9%的生理盐水反复冲洗3次,无菌条件下劈开牙冠及牙根,取出牙髓,采用改良的组织块-消化联合法分离培养人牙髓细胞。具体步骤同HDFSCs。
1.2.2 细胞来源的免疫组化鉴定及细胞表型的流式细胞术鉴定取对数生长期的第3代HDFSCs和HDPSCs,制备细胞爬片,PBS清洗3遍,4%多聚甲醛固定20 min,PBS清洗3遍,0.5% Triton X-100处理20 min,1%BSA 37 ℃封闭30 min,甩去血清,分别滴加相应的一抗,4 ℃湿盒过夜。次日,室温复温1 h,PBS振洗3次,滴加二抗37 ℃孵育1 h,PBS浸洗3次,DAB显色,苏木精胞核衬染,脱水封片。阴性对照用PBS代替一抗染色,其余步骤同前。正置荧光显微镜下进行观察、拍照。
为了鉴定HDFSCs和HDPSCs的免疫表型,依照抗体说明书,取第3代细胞分别与抗体CD34、CD73、CD105和Stro-1室温避光孵育45 min,PBS洗涤重悬后,上机检测分析。
1.2.3 多向分化潜能检测取处于对数生长期的第3代HDFSCs和HDPSCs分别以5×104/孔的密度接种到6孔板中,待细胞融合度达到30%时,将培养基换为以下诱导培养基进行培养。
1.2.3.1 成骨诱导将培养基换为成骨诱导培养液,对照组采用常规培养液,每2天换液1次。3周后,根据茜素红钙染色试剂盒说明书进行染色。倒置相差显微镜对染色结果进行观察、拍照。
1.2.3.2 成软骨诱导将培养基换为成软骨诱导液,对照组采用常规培养液,每2天换液1次。3周后,根据阿利新蓝染色试剂盒说明书进行染色。倒置相差显微镜对染色结果进行观察、拍照。
1.2.3.3 成脂诱导将培养液换为成脂诱导液,对照组采用常规培养液,每2天换液1次。3周后,根据油红染色试剂盒说明书进行染色。倒置相差显微镜对染色结果进行观察、拍照。
1.2.4 体外共培养体系的建立本实验采用Bai等[12] 研究中使用的0.4 μm孔径Transwell小室构建HDFSCs和HDPSCs体外共培养体系,实验中用到6孔 板和24孔板小室。6孔板中下室接种5×104 HDFSCs ,24孔板中下室接种1×104 HDFSCs,常规培养24 h后,HDPSCs以相同数目接种到上室,作为共培养组。下室接种相同数目HDFSCs,上室不接种HDPSCs,作为对照组。共培养组与对照组保持在同一条件下,每3天换液1次。
1.2.5 CCK-8测定HDFSCs增殖活性采用24孔板的共培养体系,每组设6个复孔,每孔加1 mL培养基常规培养;空白对照组只加入1 mL培养基。24 h后开始实验,移除Transwell小室,待检测孔PBS冲洗3次,再加入500 μL培养基和50 μL CCK-8溶液,孵箱中孵育3 h后,每孔吸出100 μL到新的96孔板中,于酶标仪450 nm波长测光密度值[D(450)],连续检测7 d。以培养时间为横轴,光密度值为纵轴绘制生长曲线。
1.2.6 实时荧光定量PCR检测mRNA的表达TaKaRa试剂盒提取共培养1周后6孔板中共培养组和对照组HDFSCs总RNA,根据试剂盒说明书进行反转录,反转录所得cDNA利用Syber Green检测试剂盒进行荧光定量PCR检测,均采用20 μL反应体系,引物见表1。PCR反应条件:95 ℃预变性3 min,95 ℃ 10 s;60 ℃ 30 s,72 ℃ 90 s,40个循环。Bio-Rad CFX Manager实时荧光定量PCR仪监测记录数据,结果采用2-△△Ct法进行计算。本实验重复3次。
| 引物 | 引物序列 | 产物长度(bp) |
| ALP | 上游 5′-TAAGGACATCGCCTACCAGCTC-3′ | 170 |
| 下游 5′-TCTTCCAGGTGTCAACGAGGT-3′ | ||
| Runx2 | 上游 5′-CTTTACTTACACCCCGCCAGTC-3′ | 127 |
| 下游 5′-AGAGATATGGAGTGCTGCTGGTC-3′ | ||
| BSP | 上游 5′-GATTTCCAGTTCAGGGCAGTAG-3′ | 169 |
| 下游 5′-CCCAGTGTTGTAGCAGAAAGTG-3′ | ||
| OPN | 上游 5′-CAGTTGTCCCCACAGTAGACAC-3′ | 127 |
| 下游 5′-GTGATGTCCTCGTCTGTAGCATC-3′ | ||
| Col-1 | 上游 5′-AACATGGAGACTGGTGAGACCT-3′ | 145 |
| 下游 5′-CGCCATACTCGAACTGGAATC -3′ | ||
| GAPDH | 上游 5′-GAGCCAAAAGGGTCATCATCTC-3′ | 542 |
| 下游 5′-AAAGGTGGAGGAGTGGGTGTC-3′ |
采用SPSS 19.0统计软件进行相关数据分析,实验数据以x±s方式表示,两组间比较采用t检验。
2 结果 2.1 两种细胞培养情况HDFSCs接种第2天即可见少量散在的贴壁细胞及组织,第3天可见长梭形细胞从组织块边缘呈放射状爬出,具有典型的成纤维样间充质来源细胞特征,胞核圆形、居中,细胞质丰富,细胞成簇生长,伸展良好。另有少量上皮细胞散在于培养瓶中,利用上皮细胞和HDFSCs对胰蛋白酶耐受性差异,经过多次差别消化法纯化后,上皮细胞明显减少,大部分细胞在20 h内贴壁,生长良好。细胞生长最初5代,约3 d可长满瓶底;6~10代,6~8 d长满瓶底,细胞增殖速度明显降低,细胞趋于老化。HDPSCs形态、生长特点与 HDFSCs相似。见图1。
 |
| 图 1 倒置显微镜观察HDFSCs和HDPSCs形态学变化 |
经免疫组化染色,两种细胞均表现为波形蛋白阳性着色,细胞质为棕黄色,CK-14阴性着色,细胞质不着色,细胞核为蓝色。见图2,提示细胞来源于外胚间充质。结合取材部位,可以判定取得细胞为 HDFSCs和HDPSCs。流式细胞术结果显示:HDFSCs和HDPSCs均表达间充质干细胞表面标志物Stro-1,其阳性率为 12.41%和11.58%,CD105阳性率为95.23%和93.30%,淋巴细胞表面标志物CD73阳性率为98.96%和99.31%,阴性表达造血干细胞表面标志物CD34,只有0.76%和0.46%。见图3,提示这两种细胞符合间充质干细胞特征。
 |
| A、B:HDFSCs;C、D:HDPSCs;A、C:波形蛋白(+);B、D:CK-14(-) 图 2 荧光显微镜观察两种细胞变化 |
 |
| A~D:HDFSCs;E~H:HDPSCs;A、E:CD34(-);B、F:CD73(+);C、G:CD105(+);D、H:Stro-1(+) 图 3 流式细胞术检测两种细胞表型 |
HDFSCs和HDPSCs分别经成骨、成软骨和成脂诱导液诱导3周后,茜素红染色后见钙结节成红色,阿利新蓝染色后细胞质呈蓝色,油红染色后见脂滴呈鲜红色,提示HDFSCs和HDPSCs均具有向成骨、成软骨以及成脂多向分化的潜能。见图4。
 |
| 图 4 倒置显微镜观察两种细胞多向分化潜能 |
各组HDFSCs增殖活力随着时间延长而增强。第1~3天,共培养组与对照组增殖活力无明显差别;从第4天开始,共培养组增殖活力明显强于对照组(P < 0.05,图5)。
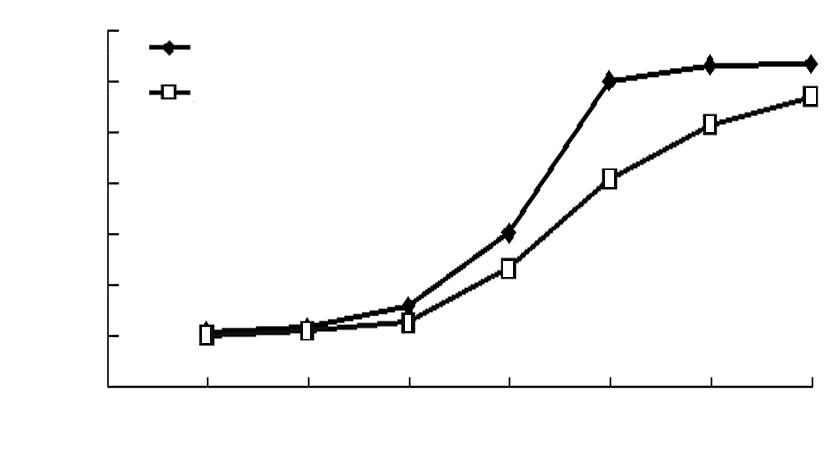 |
| a: P < 0.05,与对照组比较 图 5 GGK-8检测共培养组与对照组HDFSCs增殖活力 (n=3,x±s) |
与HDPSCs体外共培养1周后,共培养组成骨相关基因ALP、Runx2、BSP、OPN、Col-Ⅰ的相对表达量显著高于对照组(P < 0.05),见图6。
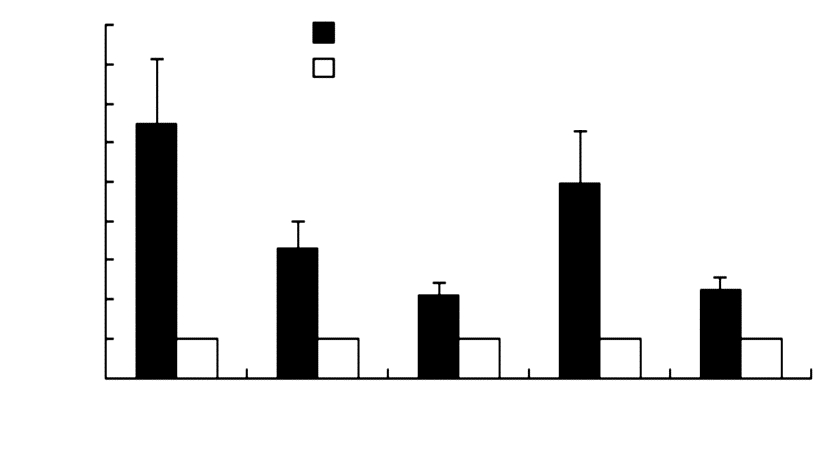 |
| a: P < 0.0.05,与对照组比较 图 6 qRT-PCR检测共培养组与对照组基因的相对表达量 (n=3,x±s) |
在牙胚发育的早期,神经嵴外胚间充质细胞与口腔早期上皮细胞通过一系列的相互作用形成牙始基[6]。神经嵴外胚间充质细胞分化成牙囊组织,随后形成牙周组织。沿着这个分化体系,外胚间充质细胞与一些外在因素(如生长因子、局部组织微环境等)间的相互作用对牙囊细胞的分化起着重要作用[7]。HDFSCs和HDPSCs共培养体系可以在一定程度上模拟牙胚发育的微环境。
本实验采用改良的组织块-消化联合法[8]分离、培养HDFSCs和HDPSCs,相对组织块法[9]而言,该方法培养效率更高,细胞增殖速度和传代较快,保障了本实验细胞来源。通过免疫组化、流式细胞术以及多向诱导成功对两种细胞的来源、表型及多向分化潜能进行了鉴定。证明所取细胞来源于外胚间充质干细胞,与以往报道一致[10, 11]。
研究细胞间的相互作用可以用细胞共培养的方式,目的是研究某种细胞或其分泌因子对另一种细胞的作用。本实验采用0.4 μm孔径的聚碳酸酯膜对HDFSCs和HDPSCs进行隔离,这就使得细胞不能通过但分子能够通过聚碳酸酯膜[12]。因此,我们就可以研究HDPSCs分泌的可溶性因子对HDFSCs产生的作用。通过与HDPSCs共培养,HDFSCs增殖活力增强,成骨基因表达增强,提示HDFSCs的增殖活力、成骨分化可以由来源于HDPSCs的可溶性因子调控,但具体调控机制及信号分子通路还需进一步研究。
综上所述,形态学、分子生物学及基因学的研究结果均支持了HDPSCs对HDFSCs的增殖、成骨分化起着积极作用,可试将本研究模型作为骨再生的一种新思路,但体内微环境十分复杂性,细胞间相互作用机制仍然不清楚[13],仅仅依靠HDFSCs和HDPSCs体外共培养很难复制体内真实环境,尚需进一步的体内实验研究。
| [1] | Lee S M, Zhang Q, Le A D. Dental Stem Cells: Sources and Potential Applications[J]. Curr Oral Health Rep, 2014, 1(1): 34-42. |
| [2] | Dorotheou D, Gkantidis N, Karamolegkou M, et al. Tooth eruption: altered gene expression in the dental follicle of patients with cleidocranial dysplasia[J]. Orthod Craniofac Res, 2013, 16(1): 20-27. |
| [3] | Chandki R, Kala M, Banthia P, et al. From stem to roots: Tissue engineering in endodontics[J]. J Clin Exp Dent, 2012, 4(1): e66-e71. |
| [4] | Mori G, Ballini A, Carbone C, et al. Osteogenic differentiation of dental follicle stem cells[J]. Int J Med Sci, 2012, 9(6): 480-487. |
| [5] | Morsczeck C, Gotz W, Schierholz J, et al. Isolation of precursor cells (PCs) from human dental follicle of wisdom teeth[J]. Matrix Biol, 2005, 24(2): 155-165. |
| [6] | Lumsden A G. Spatial organization of the epithelium and the role of neural crest cells in the initiation of the mammalian tooth germ[J]. Development, 1988, 103(Suppl): 155-169. |
| [7] | Achilleos A, Trainor P A. Neural crest stem cells: discovery, properties and potential for therapy[J]. Cell Res, 2012, 22(2): 288-304. |
| [8] | 常秀梅, 张克荣, 王书文, 等. LIM矿化蛋白1在成骨分化前后人牙囊细胞中的表达[J]. 临床口腔医学杂志, 2014, 30(6): 336-339. |
| [9] | 魏迪欣, 陈沛, 轩东英, 等. 体外培养人牙囊细胞的生物学特性[J]. 广东牙病防治, 2012, 20(8): 400-404. |
| [10] | Tran H L, Doan V N. Human dental pulp stem cells cultured onto dentin derived scaffold can regenerate dentin-like tissue in vivo[J]. Cell Tissue Bank, 2015, . |
| [11] | Juuri E, Isaksson S, Jussila M, et al. Expression of the stem cell marker, SOX2, in ameloblastoma and dental epithelium [J]. Eur J Oral Sci, 2013, 121(6): 509-516. |
| [12] | Bai Y, Bai Y, Matsuzaka K, et al. Formation of bone-like tissue by dental follicle cells co-cultured with dental papilla cells[J]. Cell Tissue Res, 2010, 342(2): 221-231. |
| [13] | Kawai T, Katagiri W, Osugi M, et al. Secretomes from bone marrow-derived mesenchymal stromal cells enhance periodontal tissue regeneration[J]. Cytotherapy, 2015, 17(4): 369-381. |



