2. 421001 湖南 衡阳,南华大学第一附属医院骨科;
3. 400038 重庆,第三军医大学西南医院关节外科
2. Department of Orthopedics, First Affiliated Hospital, South China University, Hengyang, Hunan Province, 421001;
3. Department of Joint Surgery, Southwest Hospital, Third Military Medical University, Chongqing, 400038,China
关节软骨由软骨细胞及细胞外基质构成,当关节软骨在过度负荷状态下或遭受外源性损伤时,软骨细胞的新陈代谢平衡被打破,致使细胞外基质分解加速、基质成分构成比例改变及软骨下骨重建,最终导致骨性关节炎(osteoarthritis,OA)[1, 2, 3, 4]。研究发现,OA患者软骨细胞的骨架结构蛋白表达较正常软骨细胞低,而杨氏模量及粘弹性比正常关节软骨细胞高[5]。完整的波形蛋白中间纤丝网络结构有利于维持软骨细胞表型及合成基质,破坏软骨细胞骨架的成分,将会导致软骨细胞表型改变、软骨基质成分合成减少[6, 7]。因此,研究软骨细胞骨架改变及其与软骨细胞表型改变的关系,有利于阐明OA的发生与发展机制。但目前的一些实验研究大多基于二维方式培养软骨细胞,易导致软骨细胞发生去分化表现,未能模拟体内关节软骨的三维空间,即使采用支架材料的三维培养软骨细胞,也只是破坏了软骨细胞骨架结构的单一成分,不能系统分析软骨细胞骨架结构各成分作用及其相互作用,而且支架材料降解产物通常为酸性物质及有毒性物质,可引起机体严重的炎症反应。本实验采用三维微团培养(pellet culture)法培养新西兰兔膝关节软骨细胞,通过秋水仙碱(Colchicine)、细胞松弛素B(Cytochalasin B)及丙烯酰胺(Acrylamide)分别调节软骨细胞骨架的微管、肌动蛋白微丝及波形蛋白中间纤丝,从形态上及分子生物学方面分析软骨细胞骨架蛋白结构改变与成软骨细胞表型改变关系。
1 材料与方法 1.1 实验动物与主要材料新西兰大白兔12只(SPF级),雌雄不限,2~3月龄,体质量2.0~3.0 kg(第三军医大学实验动物中心提供)。Ⅱ型胶原酶、Pronase酶、地塞米松、抗坏血酸、秋水仙碱、细胞松弛素B(Sigma公司),ITS(Gibco公司),重组人TGF-β1(Peprotech公司),丙烯酰胺(Amresco公司),HE染色液、阿利新蓝 8GX(Solarbio公司),CollagenⅠ一抗、CollagenⅡ一抗、羊抗兔二抗、DAB染色试剂盒(Bioss公司),RNA提取试剂盒、逆转录试剂盒、PCR反应试剂盒(Qiagen公司)。CO2培养箱(Thermo Forma公司)、倒置显微镜 IX71(Olympus公司)、生物安全柜(Thermo Scientific公司)、逆转录及PCR仪(Bio-Rad公司)。
1.2 方法 1.2.1 软骨细胞的提取无菌条件下获取新西兰大白兔膝关节软骨(约1 mm×1 mm),0.25% Pronase酶消化1 h,0.025% Ⅱ型胶原酶消化过夜,40 μm细胞滤网过滤,10%胎牛血清高糖培养基重悬细胞,3 d后首次换液,以后每隔2天换液,细胞长满95%培养瓶后传代,以第1代软骨细胞为种子细胞。
1.2.2 软骨细胞三维微团培养细胞计数,使每15毫升离心管细胞数为2×105个,加入软骨细胞诱导 培养基(DMEM高糖培养基,含有2%胎牛血清、1%青霉素-链霉素溶液、1% ITS、50 μg/mL抗坏血酸、100 nmol/L 地塞米松及10 ng/mL TGF-β)重悬细胞,离心后静置于37 ℃、5% CO2孵箱中培养,3 d后首次换液,以后每隔2天换液,培养2周。
1.2.3 实验分组将三维微团培养后形成的软骨细胞微团组织分为对照组、秋水仙碱组、细胞松弛素B组及丙烯酰胺组,加入秋水仙碱、细胞松弛素B及丙烯酰胺分别处理软骨细胞微团组织,每隔2天更换培养基及药物,继续培养1周。
1.2.4 指标检测①大体观:观察对照组及不同药物处理组形成软骨细胞微团组织的形态、大小、色泽及硬度。②组织切片常规染色:按试剂盒要求行组织切片HE及阿尔新蓝染色。③组织切片免疫组化染色:按常规SABC法进行COLⅠ及COLⅡ免疫组化染色。④RT-PCR检测ColⅠ、ColⅡ mRNA的表达差异:将软骨细胞微团组织匀浆后按照试剂盒要求提取总RNA、逆转录为cDNA,并按以下条件进行PCR:95 ℃ 5 min,95 ℃ 10 s、60 ℃ 30 s,扩增40个循环。其中GAPDH为内参基因,引物序列:GAPDH上游:5′-GGTGAAGGTCGGAGTGAACG-3′,下游:5′-AGTTAAAAGCAGCCCTGGTGA-3′,片段大小为65 bp;COLⅠ上游:5′-GGACACAATGGATTGCAAGG-3′,下游:5′-TAACCAC-TGCTCCACTCTGG-3′,片段大小为461 bp;COLⅡ上游:5′-ACACTGCCAACGTCCAGATC-3′,下游:5′-GTGATGTTCTGGGAGCCCTC-3′,片段大小为 64 bp。实验结果用CFX Manager软件进行分析,实验数据以2-△△Ct公式计算。
1.3 统计学处理计量数据以x±s表示,应用SPSS 18.0统计软件,组间比较行单因素方差分析。
2 结果 2.1 软骨细胞二维培养原代培养的软骨细胞在6 h后就有少量的粘附贴壁细胞,3 d后约90%的软骨细胞贴壁生长,呈长梭 状。首次换液2 d后,细胞呈多边形,增殖迅速,7~9 d 后可达90%融合。传代细胞24 h基本贴壁铺展,呈均一的多边形(图 1)。
 |
| A:原代软骨细胞第3天;B:第1代软骨细胞第8天 图 1 软骨细胞二维培养形态学特征 |
软骨细胞行三维微团培养 2周,形成肉眼明显可 见的细胞微团组织,呈圆形,直径约3 mm,厚约0.5 mm,柔软有弹性。加药物处理1周,大体外观上对照组与秋水仙碱组、细胞松弛素B组相比无明显差异,与丙烯酰胺组相比有较大差异(图 2)。
 |
| A:对照组;B:秋水仙碱组;C:细胞松弛素B组;D:丙烯酰胺组 图 2药物处理1周后各组兔软骨细胞三维微团培养大体观 |
软骨细胞微团组织行石蜡切片,HE染色显示对照组、秋水仙碱组及细胞松弛素B组细胞较密集、均一,丙烯酰胺组细胞较少、分散(图 3);阿尔新蓝染色显示对照组、秋水仙碱组及细胞松弛素B组深染,丙烯酰胺组染色较浅(图 4)。
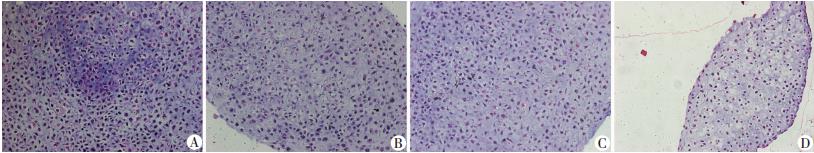 |
| A:对照组;B:秋水仙碱组;C:细胞松弛素B组;D:丙烯酰胺组 图 3 不同药物处理组软骨细胞微团组织切片HE染色观察 (×40) |
 |
| A:对照组;B:秋水仙碱组;C:细胞松弛素B组;D:丙烯酰胺组 图 4 不同药物处理组软骨细胞微团组织切片阿尔新蓝染色观察 (×40) |
软骨细胞微团组织行石蜡切片,免疫组化染色显示对照组、秋水仙碱组及细胞松弛素B组COLⅡ染色深,COLⅠ染色浅,而丙烯酰胺组COLⅡ染色较浅,COLⅠ染色较深(图 5、6)。
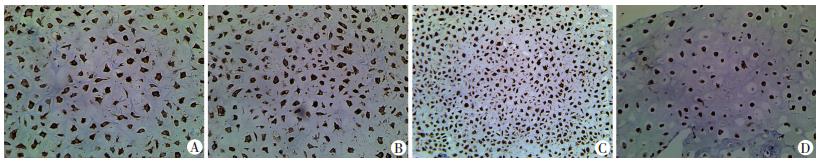 |
| A:对照组;B:秋水仙碱组;C:细胞松弛素B组;D:丙烯酰胺组 图 5 不同药物处理组软骨细胞微团组织切片COLⅠ染色观察 (×40) |
 |
| A:对照组;B:秋水仙碱组;C:细胞松弛素B组;D:丙烯酰胺组 图 6不同药物处理组软骨细胞微团组织切片COLⅡ染色观察 (×40) |
软骨细胞微团组织行PCR反应,统计数据分析显示对照组与秋水仙碱组、细胞松弛素B组相比,COLⅠ(1.21±0.21 vs 1.55±0.06、1.70±0.67)及COLⅡ(1.10±0.12 vs 0.91±0.21、0.90±0.30)表达差异均无统计学意义(P>0.05);而对照组COLⅡ表达明显多于丙烯酰胺组(0.26±0.63),COLⅠ表达明显低于丙烯酰胺组(9.63±0.38),差异有统计学意义(P < 0.05)。
3 讨论关节软骨的功能主要由软骨细胞维持。在生理状态下,软骨细胞通过合成及分解代谢维持软骨基质的平衡;在关节过度负荷、关节外伤及畸形等异常力学刺激作用下,软骨细胞新陈代谢失衡,软骨基质丢失,引起关节软骨退变,最终导致OA[1, 2, 3, 4]。因此,力学刺激的改变被认为是OA发生、发展的主要因素,而软骨细胞作为关节软骨的唯一细胞,其力学性能具有重要的意义。对于OA的防治,需要从细胞水平理解关节软骨的力学传导机制。
软骨细胞骨架由肌动蛋白微丝、微管及波形蛋白中间纤丝构成。肌动蛋白微丝主要为软骨细胞提供力学结构,同时在一定程度上影响软骨细胞表型的表达;微管在胞质中形成网络结构,作为运输路轨并起支撑作用;而中间纤丝也可引起软骨细胞表型的改变。Trickey等[8]通过加入细胞松弛素D和丙烯酰胺,破坏软骨细胞的肌动蛋白微丝和中间纤丝,发现人关节软骨的弹性模量和粘弹性显著降低。相反,使用秋水仙碱调节软骨细胞的微管对软骨细胞的力学特性不会有明显影响。另有研究[9, 10]证明,破坏波形蛋白中间丝,影响软骨细胞骨架,继而引起软骨细胞的结构改变,能显著减低人关节软骨细胞的硬度。本研究发现,软骨细胞三维微团培养后加入丙烯酰胺破坏波形蛋白中间丝,形成的细胞微团组织小、质量轻,HE染色显示软骨细胞变得更分散,细胞形态缩小,而加入秋水仙碱及细胞松弛素B则不会影响软骨细胞形态,从细胞形态学方面充分说明了波形蛋白中间丝对软骨细胞的独特作用。
软骨细胞骨架结构改变,不仅会影响软骨细胞的力学性能,更会引起其生物学性能的变化。研究显示,完整的波形蛋白中间纤丝网络结构有利于维持软骨细胞表型及合成基质[6];破坏软骨细胞骨架蛋白结构会减少软骨细胞合成Ⅱ型胶原和蛋白聚糖,在人和小鼠的OA关节软骨中,软骨细胞波形蛋白的表达发生了不同程度的变化[7, 11, 12]。本研究发现,通过秋水仙碱、细胞松弛素B调节软骨细胞骨架的微管、肌动蛋白微丝,不会影响软骨细胞COLⅡ及蛋白多糖的表达,而应用丙烯酰胺破坏形蛋白中间纤丝,可明显下调COLⅡ及蛋白多糖的表达,这和以上文献报道的结果类似,从生物学方面佐证了波形蛋白中间丝对软骨细胞的独特作用。
以往研究软骨细胞力学及生物学,大多采用单纯二维培养或粘附生物支架培养软骨细胞。采用二维方法培养软骨细胞,在培养过程中往往造成软骨细胞去分化表现,未能模拟真正的软骨细胞形态[13];应用三维生物支架培养软骨细胞,单一的天然生物材料支架降解速度过快,且生物力学性能差,而人工合成生物材料支架降解产物为毒性物质,可引起机体严重的炎症反应[14, 15, 16, 17]。我们采用三维微团培养培养软骨细胞,2周 后软骨细胞可形成肉眼明显可见的细胞微团组织,继续培养1周,阿尔新蓝染色、免疫组化染色及PCR分析显示软骨细胞COLⅡ及蛋白聚糖分泌多,而COLⅠ分泌极少,避免了软骨细胞在培养过程中出现去分化现象;采用三维微团培养培养软骨细胞,同时避免了三维支架降解产物对机体的炎症反应,更符合软骨细胞生长的生理环境。通过加入不同药物改变软骨细胞骨架成分,系统分析比较不同细胞骨架成分对软骨细胞的作用,有利于从力学方面阐述OA的发病机制。
综上所述,软骨细胞作为关节软骨的唯一细胞,其形态和结构完整影响关节软骨正常功能的发挥。软骨细胞存在于充满压缩力、剪切力、液体静压、渗透压及牵拉力的动态力学环境中,力学刺激改变影响软骨细胞骨架结构,继而引起生物学性能发生改变,最终导致OA发生。因此,从细胞及分子水平理解软骨细胞力学生物学特性是十分必要的,可能为治疗OA及其他关节软骨病变提供新思路。
| [1] | Buckwalter J A. The role of mechanical forces in the initiation and progression of osteoarthritis[J]. HSS J, 2012, 8(1): 37-38. |
| [2] | Felson D T. Osteoarthritis as a disease of mechanics[J]. Osteoarthritis Cartilage,2013, 21(1): 10-15. |
| [3] | Griffin T M, Guilak F. The role of mechanical loading in the onset and progression of osteoarthritis[J]. Exerc Sport Sci Rev, 2005, 33(4): 195-200. |
| [4] | Guilak F. Biomechanical factors in osteoarthritis[J]. Best Pract Res Clin Rheumatol, 2011,25(6): 815-823. |
| [5] | Trickey W R, Lee G M, Guilak F. Viscoelastic properties of chondrocytes from normal and osteoarthritic human cartilage[J]. J Orthop Res, 2000, 18(6): 891-898. |
| [6] | Blain E J, Gilbert S J, Hayes A J, et al. Disassembly of the vimentin cytoskeleton disrupts articular cartilage chondrocyte homeostasis[J]. Matrix Biol, 2006, 25(7): 398-408. |
| [7] | Duan W, Wei L, Cao X, et al. Effect of the disruption of three cytoskeleton components on chondrocyte metabolism in rabbit knee cartilage[J]. Chin Med J (Engl), 2014, 127(21): 3764-3770. |
| [8] | Trickey W R, Vail T P, Guilak F. The role of the cytoskeleton in the viscoelastic properties of human articular chondrocytes[J]. J Orthop Res, 2004, 22(1): 131-139. |
| [9] | Haudenschild D R, Chen J, Pang N, et al. Vimentin contributes to changes in chondrocyte stiffness in osteoarthritis[J]. J Orthop Res, 2011,29(1): 20-25. |
| [10] | Chahine N O, Blanchette C, Thomas C B, et al. Effect of age and cytoskeletal elements on the indentation-dependent mechanical properties of chondrocytes[J]. PLoS One, 2013, 8(4): e61651. |
| [11] | Lambrecht S, Verbruggen G, Verdonk P C, et al. Differential proteome analysis of normal and osteoarthritic chondrocytes reveals distortion of vimentin network in osteoarthritis[J]. Osteoarthritis Cartilage, 2008,16(2): 163-173. |
| [12] | Capin-Gutierrez N, Talamas-Rohana P, Gonzalez-Robles A, et al. Cytoskeleton disruption in chondrocytes from a rat osteoarthrosic (OA)-induced model: its potential role in OA pathogenesis[J]. Histol Histopathol, 2004, 19(4): 1125-1132. |
| [13] | Chen J L, Duan L, Zhu W, et al. Extracellular matrix production in vitro in cartilage tissue engineering[J]. J Transl Med, 2014, 12: 88. |
| [14] | Demoor M, Ollitrault D, Gomez-Leduc T, et al. Cartilage tissue engineering: molecular control of chondrocyte differentiation for proper cartilage matrix reconstruction[J]. Biochim Biophys Acta, 2014, 1840(8): 2414-2440. |
| [15] | 谭洪波,段小军,杨柳,等.透明软骨材料经脱细胞处理后细胞外基质成分变化的比较[J].第三军医大学学报, 2013, 35(19): 2028-2032. |
| [16] | Shen B, Wei A, Tao H, et al. BMP-2 enhances TGF-beta3-mediated chondrogenic differentiation of human bone marrow multipotent mesenchymal stromal cells in alginate bead culture[J]. Tissue Eng Part A, 2009, 15(6): 1311-1320. |
| [17] | Haleem A M, Chu C R. Advances in tissue engineering techniques for articular cartilage repair[J]. Oper Tech Orthop, 2010,20(2): 76-89. |



