针对视网膜色素变性(retinitis pigmentosa,RP)等不可逆性感光细胞死亡所导致的视功能障碍,目前研究较多的治疗方法有视网膜细胞移植、基因治疗、干细胞移植研究等,但仍然无有效的治疗手段。神经干细胞移植为目前最有前景的治疗方法之一,但作用机制仍不清楚。过去认为干细胞的治疗作用仅仅是通过细胞替代(cell replacement)发挥作用,但这一治疗机制 由于仅有少部分在移植后期1~2个月细胞发生移行、整合而遭到质疑。先前的研究表明移植细胞和宿主细胞间存在连续的细胞内的分子交换,神经干细胞/前体细胞(NPCs)的移植可以发挥神经保护和免疫调节作用,能够通过预防组织损伤来促进组织修复,延缓病理发展,挽救内源性神经细胞[1],而胞外囊泡(extracellular vesicles,EVs) 可能在移植干细胞和神经宿主细胞中发挥重要作用。Fruhbeis等[2]的研究也进一步强调了干细胞来源的EVs在信号传播中的重要作用。
胞外囊泡(EVs)是细胞外的纳米级囊泡,包含不同类型,包括外泌体(exosomes,EXOs)、微囊泡(Multi-vesicles,MVs)、凋亡小体、外泌体类似囊泡和膜颗粒。多种细胞可分泌释放该种囊泡,并且可从体液中分离检出。EVs内含多种物质如:蛋白、脂质、mRNA和miRNA,是健康或疾病条件下细胞间通讯的重要载体[3]。此外,这些具有生物活性的囊泡经过纳米、siRNA等修饰可用于疾病治疗,使得它们今后的深入应用研究更具吸引力。然而,神经系统中EVs的研究较少,特别是神经干细胞EVs与目标细胞间的通讯交流方面。同时,由于细胞可同时分泌不同的EVs,但是尚未建立区分不同种类囊泡的标准或者在分泌之初就将他们分离提取的物理方法,妨碍对囊泡在信息传递中作用的全面理解。本实验确定了一种操作简便的小鼠神经干细胞C17.2细胞EXOs提取方法,在此基础上将从C17.2细胞系中提取分离的EVs用染料进行标记,和小鼠成纤维细胞3T3-fGFP细胞系共孵育,并使用不同的阻断剂筛选主要的内吞通路,对3T3-fGFP细胞摄取C17.2细胞EVs的途径和通路机制进行初步研究。
1 材料与方法 1.1 主要试剂及仪器DMEM/F12培养基、高糖DMEM(Hyclone公司,美国);胎牛血清、胰蛋白酶、青链霉素(Gibco公司,美国); Total Exosome Isolation (from cell culture media) (Life technologies公司,美国); RIPA、PMSF、BCA检测试剂盒、考马斯亮蓝染色试剂盒、超敏ECL化学发光试剂盒(南京Beyotime公司); PVDF (Immobilon公司,美国);封闭蛋白干粉(武汉博士德公司);CD63、HSP70、山羊抗兔HRP结合的二抗 (美国System Biosciences公司);抗β-actin鼠单克隆抗体、山羊抗小鼠HRP结合的二抗(北京康为世纪公司);WGA Alexa Fluor 647 conjugate(Invitrogen 公司,美国);PKH26 Red Fluorescent Cell Linker Kit、Dynasore水合物、甲基-β-环糊精、细胞松弛素-D(sigma公司,美国),Dynole34-2(Tocris公司,美国),pitstop2(Abcam公司,美国) ,超速离心机(Optima L-100XP,Beckman,美国);原子力显微镜(Asylum Research Corp MFP-3D,美国); 透射电镜(JEM-1400 Plus,JEOL,日本);酶标仪(Bio-Rad,美国);共聚焦显微镜(Leica sp5,德国)。
1.2 方法 1.2.1 细胞培养 1.2.1.1 小鼠神经干细胞C17.2细胞培养小鼠神经干细胞C17.2细胞系用含10%胎牛血清、1%青
链霉素DMEM/F12培养基培养。将消化为单个细胞的C17.2以10×106个/10 mL培养基的密度接种于T75培养瓶,放置于37 ℃、含5%CO2的细胞培养箱中培养。待细胞贴壁后换用不含FBS的培养基,培养12 h 后收集培养上清,-20 ℃保存备用。
小鼠胚胎成纤维细胞3T3-GFP细胞系,用含10%新生牛血清、1%青链霉素高糖DMEM培养基培养。放置于37 ℃、含5%CO2的细胞培养箱中培养。
1.2.2 EVs制备 1.2.2.1 差速离心法细胞培养上清40 mL,先以 300×g、4 ℃离心15 min弃沉淀取上清,再以1 000×g、 4 ℃ 离心15 min弃沉淀取上清。将收集上清以4 ℃、24 000 r/min超速离心70 min去上清,沉淀用200 μL 0.9% 生理盐水重悬[4],所获得样品标识为样品a(EVs)。
1.2.2.2 Total Exosome Isolation Kit试剂盒提取法将收集细胞培养上清以2 000×g、30 min离心(除去细胞和碎片)后弃沉淀取上清。根据试剂盒说明书,上述准备的上清中加入Total Exosome Isolation试剂,涡旋混匀置于4 ℃过夜,将样品以10 000×g,4 ℃离心1 h后去上清。沉淀用200 μL 0.9%生理盐水重悬,所获得样品标识为样品b(EXOs)。
1.2.3 EVs鉴定 1.2.3.1 透射电镜分别取两种样品悬液50 μL滴加在红蜡上,将聚醋酸甲基乙烯酯/碳-包被的铜网放于液滴中,室温静置20 min。滤纸吸走多余的液体,用2%多聚甲醛(2%PFA)固定2 min。铜网用双蒸水清洗3次,用2%磷钨酸(2%PTA)复染1 min,滤纸吸走铜网上多余的液体后室温过夜干燥。ImageJ软件分析图像。
1.2.3.2 原子力显微镜分别将两种样品溶液用0.9%生理盐水稀释,吹打均匀。制备新鲜解离的云母片,固定于载玻片表面。用悬涂法2 000 r/min转速滴加50 μL样品于云母片上,待液体干燥。室温下使用硅探针及轻敲模式对样品进行检测[5]。MFP3D/Igor Pro软件分析图像。
1.2.3.3 蛋白表达将两种样品分别用200 μL RIPA buffer+ PMSF蛋白酶抑制剂混合液裂解蛋白,用BCA法测蛋白浓度,95 ℃加热5 min,调整至上样量相同(30 μg),12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),浓缩胶80 V,35 min;分离胶120 V,60 min。电泳后取凝胶用考马斯亮蓝染色试剂盒室温染色2 h,脱色液脱色18 h至条带明显。PVDF膜转膜,室温5%脱脂奶粉(0.5%TBST配制)封闭2 h,分别加入HSP70 (1 ∶1 000)、CD81 (1 ∶1 000)、CD63 (1 ∶1 000)、CD9 (1 ∶1 000)、β-actin(1 ∶20 000)一抗,4 ℃孵育过夜。TBST漂洗,HSP70、CD81、 CD63、CD9加入HRP标记的羊抗兔IgG二抗(1 ∶10 000),β-actin加入 HRP标记的羊抗小鼠IgG二抗(1 ∶1 000)室温孵育2 h,一抗和二抗均用封闭稀释液稀释,TBST漂洗,超敏ECL化学发光显影[6]。Image J软件分析检测样品的内参量和目的蛋白量。
1.2.4 染料标记EVs用PKH26 Red Fluorescent Cell Linker Kit染料对EVs进行标记。EVs用1 mL稀释液C重悬,新鲜准备终浓度4×10-6 mol/L的PKH26染料。根据试剂说明书,加1 mL EVs到1 mL染料孵育3 min,加入等体积血清孵育1 min终止反应,用等量含血清培养基稀释终止的反应液,用不含血清培养基进一步洗3遍。沉淀用200 μL PBS重悬。
1.2.5 摄取EVs实验将标记的EVs以5 μL原始浓度分别在不同时间点加入预先种有细胞的24孔板中,设4个时间点:2、4、6、8 h(n=5)。将不同时间孵育的细胞爬片用PBS洗3次,4%PFA固定10 min,10%DAPI染核10 min。用共聚焦显微镜进行图像采集,ImageJ软件分析图像。
1.2.6 摄取通路研究用50 μmol/L dynasore 水合物、10 μmol/L dynole34-2、10 μmol/L Cytochalasin D、 30 μmol/L pitstop2、50 μmol/L甲基-β-环糊精在37 ℃ 条件下预处理的细胞30 min。加入5 μL原始浓度EVs溶液,同时设置溶剂对照组(DMSO)和空白对照组。孵育4 h后PBS洗3次,4%PFA固定10 min。以上平行试验所用MVs来自同一次提取EVs。用共聚焦显微镜进行图像采集,ImageJ软件分析图像。
1.3 统计学方法数据以x±s表示,采用SPSS 18.0统计软件进行统计分析。本研究中计量数据经W检验呈正态分布,数据以 x±s进行描述,经Levene检验证实组间方差齐,摄取通路各阻断剂组与对照组间摄取EVs数量的差异比较采用单因素方差分析。摄取动力学不同时间点组因方差不齐,采用多组独立样本秩和检验分析。
2 结果 2.1 C17.2细胞培养及提取流程相差显微镜下观察的小鼠神经干细胞 C17.2生长良好,细胞核清晰细胞质均匀,没有出现明显分化现象。
2.2 两种样品透射电镜比较透射电镜结果证实C17.2细胞培养上清来源的样品a和样品b均可见脂质双层膜结构(图 1A、C),呈圆形或类圆形。电镜显示样品a直径不均一,从 20~500 nm不等,大多集中于(46.79±30.16)nm(n= 428),且较容易聚集成团(图 1A)。样品b直径也不均一,且大多集中于(42.36±27.21)nm(n=198)(图 1C)。透射电镜染色表明两种样品均存在“杯型”的直径40~200 nm的亚结构(图 1B、D),与先前文献描述相一致。对比两种样品的透射电镜图像发现样品a直径大于样品b。
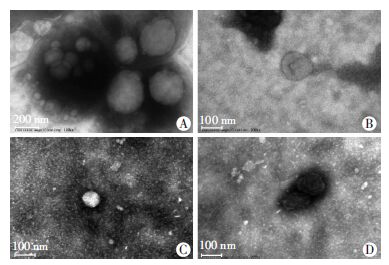
|
| A:样品a(EV)透射电镜观察,可见样品a中有圆形或类圆形膜结构且易聚集成团;B:样品a(EV)透射电镜观察,可见样品a中存在“杯型”结构的囊泡;C:样品b(EXO)透射电镜观察,可见样品b中有圆形或类圆形膜结构且呈单个分布;D:样品a(EV)透射电镜观察,可见样品a中存在“杯型”结构的囊泡 图 1 两种方法提取样品透射电镜鉴定结果 |
C17.2细胞来源纯化的两种样品在云母上的原子力显微镜图像及分析结果显示:①样品a的高度分布多集中于(4.57±2.57)nm(n=3 135),样品b的高度分布多集中于(8.40±11.07)nm(n=3 232),并且样品b的平均高度大于样品a(图 2B、C),C图为B图标准化后图像;②样品a的直径分布多集中于(61.27±25.23)nm (n=26 382),样品a直径分布的峰值约在30 nm左右,并且样品a除了主峰,还存在一个偏小的副峰,峰值约为15 nm左右;样品b的直径分布多集中于(87.58±56.24)nm (n=47 590),样品b的平均直径大于样品a(图 2D~F);此外样品a和样品b中均有少量直径大于1 000 nm的囊泡存在。
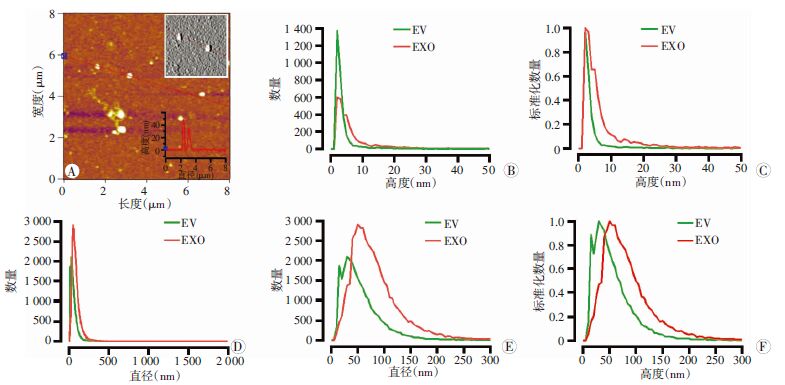
|
| A:原子力显微镜采集图片;B、C:两种样品高度计数分布,C为B标准化图;D~F:两种样品直径计数分布,E为D放大图,F为D标准化图 图 2 两种方法提取样品原子力显微镜观察及高度、直径分布 |
SDS-PAGE结果显示,两种方法所得样品所含蛋白种类丰富,表达丰度并无统计学差异。相对分子质量的蛋白更多。通过Western blot检测可知两种样品均有HSP70、CD63、CD9、CD81 4种外泌体标记物蛋白表达。且在相同上样量条件下HSP70的表达强度两者接近,但CD63、CD9和CD81 3种蛋白在样品a中表达更强。见图 3。
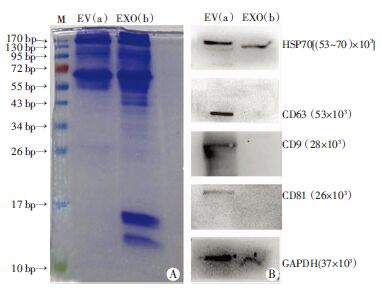
|
| A:SDS-PAGE电泳后考马斯亮蓝染色显示两种样品蛋白种类及含量接近;B:Western blot检测结果 图 3 两种方法提取样品SDS-PAGE电泳和Western blot检测结果 |
超速离心提取染料标记的EVs(红色)与3T3-fGFP细胞(绿色)共孵育实验结果显示(图 4),3T3-fGFP细胞可以摄取小鼠神经干细胞EVs,共定位免疫荧光共聚焦图显示EVs和胞膜位于相同的Z轴,因此证实了他们的内化。 正交图显示红色染料标记的EVs 位于3T3-fGFP细胞内(图 4E)。黄色部分为细胞膜与MV重叠部分,提示细胞膜可包裹EVs内吞入细胞。 根据2 h(1.441 7±0.241 3)、4 h(3.432 9±0.290 8)、6 h(17.898 6±2.371 6)、 8 h(29.292 8±4.362 7)(n=5)4个不同时间点EVs进入目标细胞情况的提示,在孵育的早期时间点荧光 强度非常弱,随着时间的延长更多的EVs被靶细胞内化,内化数量随着时间的延长而增加(P>0.05)。
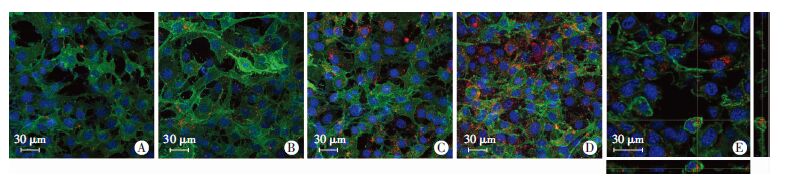
|
| A:3T3-fGFP 与EVs共孵育2 h;B:3T3-fGFP 与EVs共孵育4 h;C:3T3-fGFP 与EVs共孵育6 h;D:3T3-fGFP 与EVs共孵育8 h;E:共定位免疫荧光共聚焦正交图 图 4 不同时间点观察3T3-fGFP细胞摄取EVs情况 |
为研究3T3细胞主要的EVs摄取通路,本实验使用dynamin抑制剂dynasore和dynole34-2、clathrin通路阻断剂pitstop2、肌动蛋白抑制剂细胞松弛素D(cytochalasinD)以及膜脂质抑制剂甲基-β-环糊精(M-β-C)处理4H后细胞仍然存活(图 5)。细胞松弛素D药物处理的细胞由于肌动蛋白的破坏而导致的变形,并且与对照组相比其细胞内荧光强度明显降低,EVs多位于细胞膜边缘(图 5D)。其它抑制剂处理的细胞形态结构完好。DMSO和甲基-β-环糊精处理与对照组相比,在内化EVs数量上没有显著差异(P>0.05)。其它处理组内化EVs数量有显著性减少(P<0.01)。见图 6。
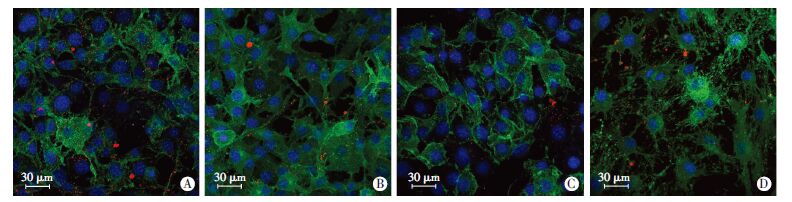
|
| A:3T3-fGFP与EVs 共孵育4 h;B:加入MDSO的3T3-fGFP与EVs 共孵育4 h;C:加入dynasore的3T3-fGFP与EVs 共孵育4 h;D:加入细胞松弛素D的3T3-fGFP与EVs 共孵育4 h 图 5 3T3-fGFP细胞摄取EVs主要通路的筛选 |

|
| 1:3T3-Fgfp+EV(空白对照);2:3T3-fGFP+DMSO+EV(溶剂对照);3:3T3-fGFP+dynasore+EV;4:3T3-fGFP+dynole+EV;5:3T3-fGFP+pitstop2+EV;6:3T3-fGFP+M-β-C +EV;7:3T3-fGFP+CytoD+EV; a:P<0.01,与空白对照组比较 图 6 药物处理3T3-GFP细胞对EVs摄取量的影响 (n=5, x±s) |
多细胞生物的细胞外空间有大量的可移动的膜限制性囊泡,称之为“胞外囊泡”(EVs)。EVs是由脂质双层膜组成的复杂的膜性结构,包括来自供体细胞的跨膜蛋白和其内部的可溶性的亲水成分。胞外囊泡在尺寸、内容物、膜组成和起源上均不相同,代表一个重要的细胞间通讯模式,可作为细胞间转移膜蛋白、胞质蛋白、脂质和RNA的载体。
怎样获得高纯度和特征明确的囊泡群体,对于详细理解不同细胞间通讯是非常重要的。目前有多种方法来分离特殊的胞外囊泡群体,从超速离心方案[7],到新的替代方法如:过滤、磁珠免疫亲和性捕获[8]和微流体方法[9]。但目前仍然缺少国际统一的分离制备不同亚型囊泡的最佳方法,以确保含量、纯度、生物活性的一致性。目前分离胞外囊泡最经典的方法是用去除了胞外囊泡的胎牛血清培养细胞,获得培养上清液,然后从非膜的颗粒中用它们相对低的浮力密度被有效分离出来[10]。商品化试剂盒操作流程简单快速,不需要特殊的设备例如超速离心机,并且适用于小体积的样本,在一个实验中能够处理多个样品。但是这些试剂盒常常无法对不同大小的囊泡和不具有膜结构的高分子聚合进行区分,不可避免的混有其他的微泡和蛋白分子及蛋白复合物。由于目前对于差速离心提取方法没有国际统一的操作流程,本实验采用Cossetti C 等使用的超速离心提取步骤。为了确定上述超速离心方案提取的小鼠神经干细胞外泌体的可靠性,本实验将差速离心法提取的EVs和商品化的试剂盒Total Exosome Isolation kit提取的外泌体进行了对比研究。
目前测定囊泡尺寸大小的金标准仍是透射电镜技术(TEM)[11],但是由于胞外囊泡体积较小,仅仅由透射电镜进行纯度和特征形态分析是很局限的,为了对原始未经固定、染色或标记的胞外囊泡进行更彻底的特征描述,本实验中使用了透射电镜和原子力显微镜对两种方法分离的样品进行形态学分析。原子力显微镜(AFM)是不需要导电试样的扫描探针型显微镜,利用粗细只有一个原子大小的探针探索物体表面,通过检测样品与探针之间的原子排斥力来反映样品表面形貌和其他表面结构。在原子力显微镜检测中,本实验将0.9%生理盐水稀释的样品用悬涂法涂布于云母片上,此方法制片速度快、涂布更均匀,干片表面的结晶颗粒干扰相对减少。使用轻敲模式采集图像,降低由于吸附液层引起的力,图像分辨率高,不会损伤样品表面。根据形态学分析的结果,TEM检测两种样品均存在圆形和“杯状”外形,并且通过TEM和AFM检测发现两种样品的尺寸分布相似或相近。考虑到外泌体是特异性的直径在30~100 nm的囊泡,证实了试剂盒提取的囊泡中很可能除了外泌体外还包含其他的微泡。本实验所采用的超速离心方案得到的胞外囊泡量较多,但容易聚集成块,这一现象在形态学鉴定中也得到证实。同时,本实验的结果也证明了,所采用的差速离心方案所获得的样品形态学分析表明是外泌体和更小的微泡组成的复合物,且以外泌体为主。
外泌体中包含能够反映起源细胞类型的特征蛋白,但也存在一些与其起源无关的保守蛋白。这些保守蛋白中的Alix、TSG101、CD63、CD9、CD81、HSP70被认为是外泌体特异性的蛋白标记物[12]。CD63、CD81和CD9属于Tetraspanins膜蛋白家族,通常聚集在细胞膜的微区域或是核内体上,在胞外囊泡中含量丰富。热休克蛋白(HSPs)在非压力和非转化细胞中HSPs作为细胞内的蛋白广泛存在于众多细胞的细胞质中并呈现低表达[13]。本实验中两种方法所得样品包含的蛋白种类、表达丰度相近,且在相同上样量的条件下外泌体的特异性蛋白标记物CD63、CD9和CD81在超速离心方法样品中表达更强,提示该方法提取物中外泌体含量高于试剂盒提取物。
由于外泌体在生理和病理条件下参与多种细胞功能和疾病状态,因此可作为一种物质交换的载体参与细胞间的物质交流。已有临床前证据指出外泌体具有治疗癌症的潜能,甚至将小鼠的外泌体RNA传递给人类的肥大细胞后,在受体细胞中发现了新的小鼠蛋白[14]。虽然外泌体和细胞间的相互作用已经证实,但是外泌体怎样进入细胞仍不明确。目前认为外泌体与目标细胞结合后可能的交流机制主要有3种[15]:①外泌体与细胞膜维持稳定,外泌体的膜蛋白裂解片段可作为目标细胞细胞表面受体的配体发挥作用;②外泌体和目标细胞融合;③外泌体被不同的内吞通路内化。尽管有以上3种可能的机制假说,但仍存在争议,并且不同来源的外泌体与目标细胞间存在特异性相互作用,同时被内化进入目标细胞的方式也不尽相同。
内吞作用可分为经典胞饮和吞噬作用。胞饮可进一步分为网格蛋白介导的内吞(clathrin-mediated endocytosis,CME)或非网格蛋白依赖的内吞(clathrin-independent endocytosis,CIE)。网格蛋白介导的内吞(clathrin-mediated endocytosis ,CME)是到目前为止所有不同的内吞机制中研究最多的重要机制[16],同时也是不同来源的外泌体内化进入目标细胞报道较多的方式之一。CME中外来物质与宿主细胞膜上的结合位点结合,在细胞膜内部网格蛋白聚集形成向内凹陷的网格将外来物包裹向内拉,肌动蛋白在向内牵拉的后期出现,当拉到极致呈现颈状时dynamin出现并完成剪切作用,使外来物内吞入宿主细胞。dynamin是一个100×103左右GTP结合蛋白质,具有鸟苷三磷酸酶(GTPase)活性,dynasore、dynole34-2为其抑制剂。pitstops 2可阻断细胞内CME,并且可能在阻断蛋白与Clathrin N端区域的结合中发挥特异性作用。细胞松弛素D是激动蛋白聚合抑制剂,能阻断肌动蛋白依赖的吞噬作用和大胞饮。甲基-β-环糊精是膜脂质抑制剂,它可耗尽细胞上的胆固醇,导致细胞表面结构的变化从而影响其他的内吞作用通路。本实验使用Clathrin依赖的载体通路阻断剂dynasore、dynole34-2、pitstop2和细胞松弛素D和非Clathrin依赖的载体通路阻断剂甲基-β-环糊精,进行摄取相关通路机制研究。结果提示,相同种属来源的神经干细胞与3T3-fGFP细胞之间可以发生以EVs为媒介的物质交流现象,且摄取数量随着时间的延长而增加,EVs进入细胞后向细胞核周围聚集。摄取通路研究发现,Clathrin依赖的内吞作用是3T3-fGFP细胞内吞神经干细胞EVs的重要通路。而胆固醇依赖的通路可能并不是3T3-fGFP细胞内吞的重要通路。我们的研究提示神经干细胞分泌的外泌体可能作为运输载体,介导了神经干细胞与3T3-fGFP细胞之间的物质交换和信息交流。为干细胞和3T3-fGFP细胞之间的深入功能研究奠定基础。
| [1] | De-Feo D, Merlini A, Laterza C, et al. Neural stem cell transplantation in central nervous system disorders: from cell replacement to neuroprotection[J]. Curr Opin Neurol, 2012, 25(3): 322-333. |
| [2] | Fruhbeis C, Frohlich D, Kuo W P, et al. Neurotransmitter-triggered transfer of exosomes mediates oligodendrocyte-neuron communication[J]. PLoS Biol, 2013, 11(7): e1001604. |
| [3] | Raposo G, Stoorvogel W. Extracellular vesicles: exosomes, microvesicles, and friends[J]. J Cell Biol, 2013, 200(4): 373-383. |
| [4] | Cossetti C, Iraci N, Mercer T R, et al. Extracellular vesicles from neural stem cells transfer IFN-gamma via Ifngr1 to activate Stat1 signaling in target cells[J]. Mol Cell, 2014, 56(2): 193-204. |
| [5] | Palanisamy V, Sharma S, Deshpande A, et al. Nanostructural and transcriptomic analyses of human saliva derived exosomes[J]. PLoS One, 2010, 5(1): e8577. |
| [6] | Burns G, Brooks K, Wildung M, et al. Extracellular vesicles in luminal fluid of the ovine uterus[J]. PLoS One, 2014, 9(3): e90913. |
| [7] | Valadi H, Ekstrom K, Bossios A, et al. Exosome-mediated transfer of mRNAs and microRNAs is a novel mechanism of genetic exchange between cells[J]. Nat Cell Biol, 2007, 9(6): 654-659. |
| [8] | Grant R, Ansa-Addo E, Stratton D, et al. A filtration-based protocol to isolate human plasma membrane-derived vesicles and exosomes from blood plasma[J]. J Immunol Methods, 2011, 371(1/2): 143-151. |
| [9] | Tauro B J, Greening D W, Mathias R A, et al. Comparison of ultracentrifugation, density gradient separation, and immunoaffinity capture methods for isolating human colon cancer cell line LIM1863-derived exosomes[J]. Methods, 2012, 56(2): 293-304. |
| [10] | Aalberts M, van-Dissel-Emiliani F M, van-Adrichem N P, et al. Identification of distinct populations of prostasomes that differentially express prostate stem cell antigen, annexin A1, and GLIPR2 in humans[J]. Biol Reprod, 2012, 86(3): 82. |
| [11] | van-der-Pol E, Hoekstra A G, Sturk A, et al. Optical and non-optical methods for detection and characterization of microparticles and exosomes[J]. J Thromb Haemost, 2010, 8(12): 2596-2607. |
| [12] | Schneider A, Simons M. Exosomes: vesicular carriers for intercellular communication in neurodegenerative disorders[J]. Cell Tissue Res, 2013, 352(1): 33-47. |
| [13] | Ghosh A, Davey M, Chute I C, et al. Rapid isolation of extracellular vesicles from cell culture and biological fluids using a synthetic peptide with specific affinity for heat shock proteins[J]. PLoS One, 2014, 9(10): e110443. |
| [14] | Tian T, Wang Y, Wang H, et al. Visualizing of the cellular uptake and intracellular trafficking of exosomes by live-cell microscopy[J]. J Cell Biochem, 2010, 111(2): 488-496. |
| [15] | Mathivanan S, Ji H, Simpson R J. Exosomes: extracellular organelles important in intercellular communication[J]. J Proteomics, 2010, 73(10): 1907-1920. |
| [16] | Canton I, Battaglia G. Endocytosis at the nanoscale[J]. Chem Soc Rev, 2012, 41(7): 2718-2739. |



