高胆红素血症是新生儿就诊和入院的常见原因之一。胆红素沉积于中枢神经系统可致不同程度的神经细胞损伤和功能障碍,但其具体分子机制尚不清楚[1]。以往胆红素神经毒性研究主要集中于神经元,如今越发重视胶质细胞在其中的作用,并把它作为防 治脑损伤的关键靶点[2]。研究认为胆红素胶质细胞毒性主要表现为神经炎症作用[3],胆红素可升高海马神经元IL-1β水平,但与对照组比,浓度仅增1.2 pg/mL[4]。 国外研究表明胆红素诱导的神经胶质细胞的TNF-α、IL-1β水平高于神经元几十倍,提示胆红素诱导的炎症主要与神经胶质细胞相关[3]。小胶质细胞和星形胶质细胞活化可介导神经炎症的产生,释放细胞因子、促炎症介质等,引起神经损伤[5]。其中,星形胶质细胞数量最多,与神经元联系紧密[6],它的损伤和神经元功能障碍高度相关[7]。
核因子-κB(nuclear factor kappa B,NF-κB)是一类与炎症、凋亡和免疫密切相关的核转录因子[8]。神经胶质细胞NF-κB激活和表达较神经元更显著[1, 9],表现神经保护或损伤作用。反式激活蛋白(TAT)是HIV病毒中的一种蛋白转导多肽,可携带其他蛋白进入细胞或透过血脑屏障;NBD是针对NF-κB活化设计的小分子多肽,能通过干预IKK激活抑制NF-κB的活化,不影响其基础表达[10]。胆红素可激活原代皮层星形胶质细胞NF-κB的表达,后者能调控胆红素诱导的炎症因子水平[11, 12, 13, 14]。反式激活蛋白-NEMO结合域(TAT-NBD)可进入细胞,通过血脑屏障直接作用于中枢神经系统,特异性抑制缺氧缺血、炎症、凋亡等病理过程介导的NF-κB激活[4, 15, 16]。本实验探究胆红素诱导原代星形胶质细胞的NF-κB 活化及炎症反应,观察TAT-NBD的干预作用,为防治新生儿胆红素脑病提供新思路和干预靶点。
1 材料与方法 1.1 实验动物SPF级SD大鼠70只,由重庆医科大学实验动物 中心(许可证号SCXK渝20020001)提供,体质量(250± 30)g,雌雄1 ∶1合笼,孕(21±3)d得新生SD鼠。
1.2 试剂与仪器DMEM培养基(Gibicol公司),胎牛血清(HyClone公司),胰蛋白酶、L-多聚赖氨酸、胆红素、二甲基亚砜(DMSO公司)、牛血清白蛋白(Sigama公司),TAT-NBD多肽(YGRKKRRQRRR-TALDWSWLQTE,上海科肽生物科技有限公司合成),3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT,上海生工),核蛋白提取试剂盒、ECL显影液(南京凯基),BCA蛋白试剂盒、荧光二抗(AF488)、抗荧光淬灭封片液(碧云天),GFAP 抗体、NF-κB p65抗体(CST公司),PVDF膜(孔膜径= 0.22 μm),ELISA检测试剂盒(欣博盛),非放射性红外EMSA试剂盒(Viagene Biotech Inc),CO2细胞培养箱(Thermo公司),荧光显微镜(Nikon)、酶标仪(Synergy H1266849)等。
1.3 实验方法 1.3.1 大鼠皮层星型胶质细胞原代培养、纯化和鉴定无菌条件下取2~3 d的SD幼鼠鼠脑,分离双侧大脑皮层,机械剪碎,胰蛋白酶消化法制备单细胞悬液,用完全培养基(DMEM+10% FBS)进行培养,用差速贴壁、拍击、传代方法除杂,得到星形胶质细胞。通过形态学、免疫细胞化学法(胶质纤维酸性蛋白GFAP染色)鉴定星形胶质细胞纯度。
1.3.2 药物配制及实验分组胆红素溶于DMSO配成50 mmol/L浓缩液,TAT-NBD溶于完全培养基配成10 mmol/L浓缩液,抽滤分装,-20 ℃避光保存。星形胶质细胞传至第2代培养7 d后,用查表法将各个培养瓶的细胞完全随机分组成对照组、胆红素组和TAT-NBD干预组,组内随机选取培养瓶细胞于不同时间点干预。牛血清白蛋白(BSA)溶于完全培养基配成BSA 终浓度为100 μmol/L的试验培养基,在此基础上,胆红素组给予胆红素50 μmol/L,使胆红素 ∶牛血清白蛋白=0.5;TAT-NBD干预组给予胆红素50 μmol/L 同时加入TAT-NBD 5 μmol/L;对照组分别加入等体积的DMSO和完全培养基。分别检测对照组、胆红素组1、2、4、8、12、24 h NF-κB的表达及2 h和12 h 3组NF-κB的变化,观察TAT-NBD单独组细胞形态学变化。
1.3.3 免疫细胞化学法观察各组星形胶质细胞的形态接种于玻片上的细胞按1.3.2随机分组处理24 h后,参照文献[9],用标准免疫荧光染色步骤进行固定、穿透、封闭、抗体孵育、DAPI染核、封片。一抗稀释浓度为GFAP(1 ∶2 000),荧光二抗稀释浓度为AF488(1 ∶200),荧光显微镜下观察。
1.3.4 改良MTT法测定细胞增殖活性改良MTT法测胆红素作用1、2、4、8、12、24 h各时间点细胞的相对存活率及TAT-NBD干预2 h和12 h的细胞相对存活率。检测、计算方法同文献[4]。
1.3.5 Western blot检测NF-κB p65蛋白的表达细胞按1.3.2随机分组并于相应时间点处理,按凯基说明书提取核蛋白并行定量(BCA法)分析。按照Western blot标准步骤进行电泳、转膜、封闭。一抗稀释浓度为NF-κB p65(1 ∶1 000),Histone 3(1 ∶1 000),Image J 软件测定NF-κB p65灰度值,以Histone 3灰度值作内参,二者灰度比值表示蛋白表达量。
1.3.6 EMSA检测NF-κB的活化、入核细胞随机分组处理12 h后,分别提取核蛋白并行定量(BCA法)分析,按非放射性红外EMSA说明书操作,调整蛋白浓度进行EMSA检测:配胶、平衡EMSA反应体系,上样,电泳结束立即于红外成像系统曝光,Image J 分析NF-κB的表达。
1.3.7 ELISA 法[4]检测原代培养上清液IL-1β、TNF-α、 IL-6表达细胞按1.3.2随机分组处理后收集各时间点培养基,按说明书操作,酶标仪测450 nm吸光度 [D(450)],建立标准曲线的直线回归方程,计算IL-1β、 TNF-α、IL-6浓度。
1.4 统计学分析采用SPSS 19.0统计软件,数据以x±s表示,经正态及方差齐性检验后,采用单因素方差分析。
2 结果 2.1 星形胶质细胞纯度鉴定GFAP鉴定,星形胶质细胞纯度达90% ~95%,可用于后续试验(图 1)。
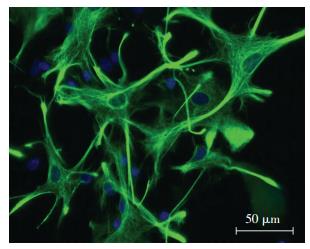 |
| 图 1免疫荧光鉴定星形胶质细胞的纯度 |
实验24 h,与对照组相比,胆红素组星形胶质细胞形态破坏,甚至破裂、溶解成团状,胞体上许多长而分支的突起损伤严重,细胞核出现核固缩、碎裂;TAT-NBD干预后能较好维持细胞和胞体上的突起的形态,细胞核较少固缩。TAT-NBD单独作用组的细胞形态与对照组无明显差异(图 2)。
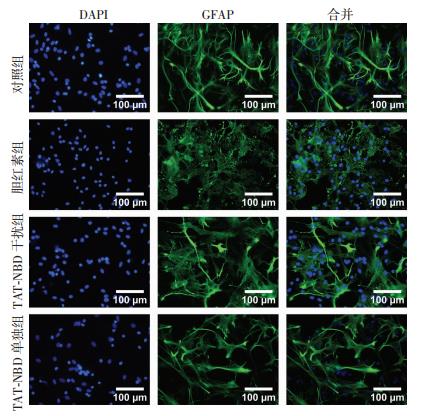 |
| 图 2 免疫荧光观察24 h各组细胞形态变化 |
胆红素组细胞相对存活率随胆红素作用时间延长逐渐降低,均明显低于对照组(P < 0.01)。TAT-NBD干预2 h和12 h,细胞相对存活率均明显高于同时间点胆红素组(P < 0.01,图 3)。
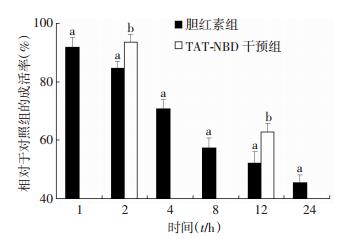 |
| a:P < 0.01,与同时间点对照组比较; b:P < 0.01,与同时间点胆红素组比较 图 3 改良MTT法检测各组不同时间点星形胶质细胞的相对存活率 |
同一时间点胆红素组与对照组NF-κB p65蛋白灰度比值差异有统计学意义(P < 0.01);2、12 h 时,胆红素组NF-κB p65蛋白灰度比值(0.965±0.049)和(1.354±0.120),明显高于组内其余各时间点(P<0.05,图 4A、B)。TAT-NBD干预2 h,NF-κB p65蛋白灰度比值(0.403±0.040),低于同时间点胆红素组(P < 0.01),与对照组(0.344±0.043)比较差异无统计学意义(P > 0.05);TAT-NBD干预12 h,NF-κB p65蛋白灰度比值(0.794±0.073),低于同时间点胆红素组,高于对照组(0.547±0.057,P < 0.01,图 4C)。
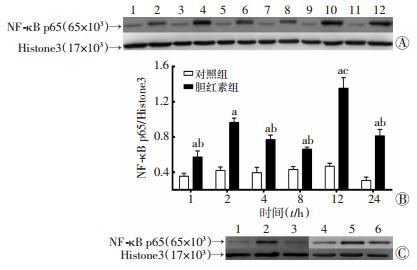 |
| A:Western blot检测 1、2:作用1 h时对照组、胆红素组;3、4:作用2 h时对照组、胆红素组;5、6:作用4 h时对照组、胆红素组;7、8:作用8 h时对照组、胆红素组;9、10:作用12 h时对照组、胆红素组;11、12:作用24 h时对照组、胆红素组;B:半定量分析 a:P < 0.01,与同时间点对照组比较;b:P < 0.05,与2 h和12 h胆红素组比较;c:P < 0.01,与2 h胆红素组比较;C:2、12 h NF-κB p65 Western blot检测 1~3:分别为作用2 h时对照组、胆红素组、TAT-NBD干预组;4~6:分别为作用12 h时对照组、胆红素组、TAT-NBD干预组 图 4 Western blot 检测星形胶质细胞NF-κB p65蛋白表达 |
TAT-NBD干预12 h,NF-κB灰度值(0.705±0.047),明显低于胆红素组(1.249±0.080,P < 0.01),高于对照组(0.512±0.024,P < 0.01,图 5)。
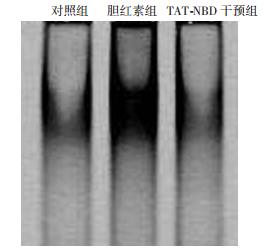 |
| 图 5 EMSA 法检测12 h星形胶质细胞NF-κB的活化 |
同一时间点胆红素组与对照组IL-1β、TNF-α、 IL-6比较,差异有统计学意义(P < 0.05);12 h时,胆红素组IL-1β、TNF-α、IL-6释放分别为(183.786± 10.211)pg/mL、(286.304±22.179)pg/mL和(304.616± 20.241)pg/mL,明显高于组内其他时间点(P < 0.01)(图 6)。TAT-NBD干预2 h,IL-1β、TNF-α、IL-6浓度 分别为(49.402±2.581)pg/mL、(60.943±3.375)pg/mL 和(55.275±2.110)pg/mL;TAT-NBD干预12 h,IL-1β、TNF-α、IL-6浓度分别为(111.950±5.764)pg/mL、 (119.976±6.070)pg/mL和(180.363±14.789)pg/mL,IL-1β、TNF-α均低于同时间点胆红素组,高于对照组(P < 0.01)。TNT-NBD干预2 h,IL-6浓度低于胆红素组(P < 0.01),干预12 h,IL-6浓度低于胆红素组,高于对照组(P < 0.01)。
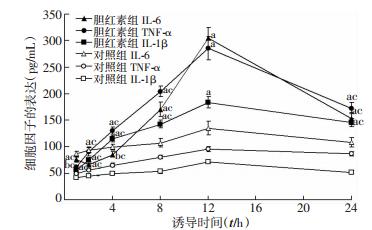 |
| a:P < 0.01,b:P < 0.05,与同一炎症因子同时间点对照组比较;c:P < 0.01,与同一炎症因子12 h胆红素组比较 图 6 ELISA检测星形胶质细胞炎症因子IL-1β、TNF-α、 IL-6的表达 |
越来越多的证据表明炎症反应与新生儿脑损伤密切相关,未成熟脑中,炎症损伤更甚,严重影响患儿预后[17]。中枢神经系统中,神经胶质细胞不仅是炎症反应的主要参与者[9],也为神经元存活和功能发挥提供支持、营养、保护作用。其中,星形胶质细胞数量最多,比神经元多5倍,有自我平衡、免疫特性[6],且两者相互胶粘,联系紧密。研究显示,胆红素诱导胶质细胞炎症较神经元更为显著[1, 9],星形胶质细胞释放促炎症因子、谷氨酸盐、ATP和自由基等会增加神经元对胆红素等神经毒素的易感性,降低神经元存活率,影响其功能恢复[3, 7]。因此,星形胶质细胞可能作为防治胆红素诱导神经损伤的干预靶点。
近年NF-κB被认为是炎症性脑损伤中的关键环节[1, 18]。NF-κB静息状态下位于细胞质中与核因子κB抑制性蛋白(IκB)紧密结合,致炎因子刺激下,IκB激酶(IKK)复合体诱导的磷酸化导致IκB变性被降解,激活的NF-κB移位入细胞核与多种基因启动子部位结合,参与调控细胞因子、化学因子等促炎症因子的表达[8]。胆红素诱导的脑损伤模型中,观察到NF-κB激活,其作用复杂,可表现为保护或损伤作用[18]。
研究表明,胆红素诱导的胶质细胞毒性表现为细胞形态学改变及存活率下降,也引起NF-κB的激活及炎症因子的释放,细胞存活率和NF-κB激活与胆红素作用时间相关[9, 13],这与本实验结果一致。已证实,胆红素能激活星形胶质细胞中的丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK)和NF-κB信号通路,诱导促炎症因子的基因表达和IL-1β、TNF-α、 IL-6的释放[9, 19]。此外,胆红素还能上调TNFR1(tumor necrosis factor receptor1)、IL-1R1(interlukin-1 receptor 1)的水平[16],并通过TNF-α TNFR1,IL-1β/IL-1R1信号激活NF-κB通路,诱导、加重炎症反应[12]。为了更好地模拟和探讨胆红素脑病患儿的临床病理机制,我们将胆红素体外模型的诱导时间定为24 h,以期在急性胆红素脑病早期进行干预。前期研究证实,胆红素诱导神经元的NF-κB活化并于4、24 h达高峰[4],本实验提示,胆红素诱导的星形胶质细胞NF-κB活化高峰是2 h和12 h,为以后的星形胶质细胞和神经元共培养等研究奠定基础。本研究中,胆红素诱导的星形胶质细胞NF-κB早期活化高峰为2 h,较国外研究4 h[3, 13]略有提前,可能与实验采用不同纯化方法有关。本实验采用的差速贴壁、拍击法较摇床振荡法除杂效率低,以致混入一定数量的小胶质细胞,而后者较星形胶细胞更早激活NF-κB、MAPK等信号通路并释放炎症因子[3],导致NF-κB活化高峰提前。而晚期活化高峰在12 h出现,可能是胆红素诱导炎症因子的大量释放和累积,介导TNF-α TNFR1,IL-1β/IL-1R1通路使星形胶质细胞NF-κB进一步活化[13]。
实验表明,NF-κB激活后,炎症因子释放量增加,活化高峰点尤甚,胆红素刺激星形胶质细胞分泌的IL-1β、TNF-α明显增加[9, 11, 12, 13, 14],先升后降,有时间依赖和累加效应;二者是较早释放的炎症因子,能直接引起神经损伤,还可诱导释放IL-6等因子[20],产生级联效应;此外,它们会增加血脑屏障通透性,诱导外周淋巴细胞和单核细胞入脑,诱发二次炎症,加重神经损伤。IL-6是一种基础表达水平较高的神经营养因子,释放水平高低表现为神经损伤或保护作用。本实验中,胆红素刺激IL-6先降后升,早期NF-κB激活抑制其释放,表现神经毒性,晚期NF-κB大量激活及TNF-α、IL-1β 释放明显升高IL-6水平,导致神经损伤。各炎症因子释放量低于国外研究,可能与实验细胞成熟度有关,未成熟分化细胞更易损伤[9, 11];合并感染[3]、缺氧缺血[14]可能通过激活NF-κB、MAPK等信号通路加重炎症损伤。
TAT-NBD是NF-κB特异性抑制剂,可下调胆红素诱导的NF-κB活化并保持基础表达水平[15]。本研究显示,TAT-NBD使胆红素诱导的NF-κB p65活化明显下降,且在2 h下降幅度较12 h更显著;同时间点炎症因子释放量明显下降,存活率明显增加,与Brites等[1, 9]的研究结果一致,提示靶向抑制NF-κB活化可减少炎症因子释放,发挥神经保护作用,对胆红素脑损伤患儿尽早干预可改善预后,干预时间窗有待进一步明确。
综上所述,TAT-NBD可能通过抑制星形胶质细胞NF-κB信号通路在胆红素脑病中发挥抗炎保护作用,但其具体分子机制仍需深入探讨。
志谢 感谢儿童发育疾病研究教育部重点实验室沈犁教授、易勤老师等在实验过程中给予的技术指导和热心帮助
| [1] | Brites D, Fernandes A, Falcao A S, et al. Biological risks for neurological abnormalities associated with hyperbilirubinemia[J]. J Perinatol, 2009, 29(Suppl 1): S8-S13. |
| [2] | Brites D. Bilirubin injury to neurons and glial cells: new players, novel targets, and newer insights[J]. Semin Perinatol, 2011, 35(3): 114-120. |
| [3] | Brites D. The evolving landscape of neurotoxicity by unconjugated bilirubin: role of glial cells and inflammation[J]. Front Pharmacol, 2012, 3: 88. |
| [4] | 宋思捷, 朱叶芳, 党姗姗, 等. 反式激活蛋白-NEMO结合域抑制核因子-kB活化在胆红素诱导大鼠海马神经元凋 亡中的作用[J]. 南方医科大学学报, 2013, 33(2): 172-176. |
| [5] | Fernandes A, Brites D. Contribution of inflammatory processes to nerve cell toxicity by bilirubin and efficacy of potential therapeutic agents[J]. Curr Pharm Des, 2009, 15(25): 2915-2926. |
| [6] | Sofroniew M V, Vinters H V. Astrocytes: biology and pathology[J]. Acta Neuropathol, 2010, 119(1): 7-35. |
| [7] | Allaman I, Belanger M, Magistretti P J. Astrocyte-neuron metabolic relationships: for better and for worse[J].Trends Neurosci, 2011, 34(2): 76-87. |
| [8] | Hayden M S, Ghosh S. Signaling to NF-kappaB[J]. Genes Dev, 2004, 18(18): 2195-2224. |
| [9] | Falcao A S, Fernandes A, Brito M A, et al. Bilirubin-induced immunostimulant effects and toxicity vary with neural cell type and maturation state[J].Acta Neuropathol, 2006, 112(1): 95-105. |
| [10] | May M J, D’Acquisto F, Madge L A, et al. Selective inhibition of NF-kappa B activation by a peptide that blocks the interaction of NEMO with the IkappaB kinase complex[J]. Science, 2000, 289(5484): 1550-1554. |
| [11] | 党姗姗,朱叶芸,王少雯,等. ERK1/2对胆红素诱导的海马神经元损伤及NF-κB表达的影响[J]. 第三军医大学学报, 2011, 33(14): 1480-1483. |
| [12] | Fernandes A, Falcao A S, Silva R F, et al. Inflammatory signalling pathways involved in astroglial activation by unconjugated bilirubin[J]. J Neurochem, 2006, 96(6): 1667-1679. |
| [13] | Fernandes A, Barateiro A, Falcao A S, et al. Astrocyte reactivity to unconjugated bilirubin requires TNF-alpha and IL-1beta receptor signaling pathways[J]. Glia, 2011, 59(1): 14-25. |
| [14] | Falcao A S, Silva R F, Fernandes A, et al. Influence of hypoxia and ischemia preconditioning on bilirubin damage to astrocytes[J]. Brain Res, 2007, 1149: 191-199. |
| [15] | Yang D, Sun Y Y, Lin X, et al. Intranasal delivery of cell-penetrating anti-NF-κB peptides (Tat-NBD) alleviates infection-sensitized hypoxic-ischemic brain injury[J]. Exp Neurol, 2013, 247: 447-455. |
| [16] | Long Y M, Chen K, Liu X J, et al. Cell-permeable Tat-NBD peptide attenuates rat pancreatitis and acinus cell inflammation response[J]. World J Gastroenterol, 2009, 15(5): 561-569. |
| [17] | Berger I, Peleg O, Ofek-Shlomai N. Inflammation and early brain injury in term and preterm infants[J]. Isr Med Assoc J, 2012, 14(5): 318-323. |
| [18] | Song S, Hu Y, Gu X, et al. A novel newborn rat kernicterus model created by injecting a bilirubin solution into the cisterna magna[J]. PLoS One, 2014, 9(5): e96171. |
| [19] | Fernandes A, Falcao A S, Silva R F, et al. MAPKs are key players in mediating cytokine release and cell death induced by unconjugated bilirubin in cultured rat cortical astrocytes[J]. Eur J Neurosci, 2007, 25(4): 1058-1068. |
| [20] | Fan L, Wang T, Chang L, et al. Systemic inflammation induces a profound long term brain cell injury in rats[J]. Acta Neurobiol Exp (Wars), 2014, 74(3): 298-306. |



