视网膜色素变性是一类遗传性致盲性眼病[1],药物治疗无效[2],干细胞移植治疗具有良好前景。干细胞移植治疗功能整合机制研究是干细胞移植治疗视网膜变性疾病研究的重要方面。神经元通过整合形成突触功能连接,钙离子在突触功能信号传递中发挥重要作用[3]。GCaMP作为一种新型钙离子指示剂,属于基因编码钙指示剂/蛋白钙指示剂(GECI),由钙调蛋白、GFP、M13三部分组成,其结合钙离子后构象发生变化从而发出绿色荧光[4]。本研究采用GCaMP5G钙离子指示剂,是GCaMP的一种,通过荧光强度的变化反映活细胞内钙离子浓度变化。C17.2神经干细胞是小鼠小脑来源的永生化的神经干细胞,性质稳定[5],可用于干细胞移植整合研究。稳定表达GCaMP基因的C17.2-GCaMP细胞,为在体研究移植干细胞功能整合提供新的手段及思路。本研究对比C17.2-GCaMP细胞与C17.2细胞Fluo-4 AM染色钙离子成像特点,为视网膜色素变性神经干细胞移植治疗功能整合机制研究奠定前期研究基础。
1 材料与方法 1.1 试剂和仪器DMEM/F12培养基、马血清(HyClone公司),胎牛血清(FBS)、青链霉素双抗(PS)、胰蛋白酶 (Gibco公司),二甲基亚砜(DMSO,Sigma公司),Fluo-4 AM(Molecular Probes公司),去DNA试剂盒(Ambition公司),逆转录试剂盒(TaKaRa公司),Real-time PCR试剂盒(Bio-Rad公司),数字荧光显微镜(奥林巴斯公司),PCR仪(Bio-Rad公司)。
1.2 C17.2细胞培养C17.2细胞用含10%FBS、5%马血清、1%PS的DMEM/F12培养基置于37℃、5%CO2孵箱中培养。C17.2细胞生长密度达到80%,用0.05%胰蛋白酶消化传代。
1.3 C17.2-GCaMP细胞获取及培养C17.2细胞接种,24 h后换液,在培养基中加入polybrene(8 μg/mL)以及以CMV为启动子携带GCaMP5G基因的慢病毒进行转染,24 h后换液,3 d后流式筛选。筛选得到的阳性细胞,以1~2细胞/孔的密度接种于96孔板中进行C17.2-GCaMP细胞扩增。C17.2-GCaMP培养方法同C17.2细胞。
1.4 Real-time PCR检测C17.2细胞及C17.2-GCaMP细胞nestin mRNA表达用Trizol法提取2种细胞总RNA。将提取的总RNA按照去DNA试剂盒方法去除DNA。将纯化后的总RNA通过逆转录试剂盒逆转录成cDNA。逆转录条件:37 ℃ 15 min;85 ℃ 5 s;4 ℃ 30 s。cDNA通过Real-time PCR试剂盒进行定量PCR检测C17.2细胞及C17.2-GCaMP细胞nestin表达情况。每种基因设3复孔。引物序列及扩增产物长度见表 1。
| 基因名称 | 引物序列 | 产物大小(bp) |
| nestin | 上游:5′-GCAGGGTCTACAGAGTCAGATC-3′ | 106 |
| 下游:5′-CAGCAGAGTCCTGTATGTAGCCA-3′ | ||
| GAPDH | 上游:5′-TGACCTCAACTACATGGTCTACA-3′ | 85 |
| 下游:5′-CTTCCCATTCTCGGCCTTG-3′ |
配制胞外液:NaCl 140 mmol/L,KCl 3.0 mmol/L,CaCl2 2.0 mmol/L,MgCl2 1.0 mmol/L,glucose 10.0 mmol/L,HEPES 10.0 mmol/L,用NaOH调整pH于7.2~7.4之间。将C17.2-GCaMP细胞接种于载有16 mm小玻片的12孔板中,接种后24 h,用胞外液漂洗2遍,将小玻片捞出,置于胞外液灌流槽中,行数字荧光显微镜成像。拍摄条件:激发光波长:488 nm,曝光时间:45 ms,图片间隔时间(包括曝光时间):1 s。
1.6 C17.2细胞Fluo-4 AM染色钙离子成像配制胞外液同上,将C17.2细胞接种于载有16 mm 小玻片的12孔板中。用DMSO溶解Fluo-4 AM粉末配制1 mmol/L的母液,-20 ℃保存。用胞外液及Fluo-4 AM母液配制5 μmol/L的Fluo-4 AM工作液。 C17.2接种24 h后,用胞外液漂洗3遍,加入5 μmol/L Fluo-4 AM工作液覆盖过玻片,置于37 ℃孵箱孵育40 min,吸除Fluo-4 AM工作液,用胞外液漂洗3遍,置于37 ℃孵箱孵育20 min。将小玻片捞出,置于胞外液中灌流槽中,行数字荧光显微镜成像。拍摄条件:激发光波长:488 nm,曝光时间:45 ms,图片间隔时间(包括曝光时间):1 s。
1.7 图像分析将C17.2-GCaMP细胞及C17.2细胞Fluo-4 AM染色钙离子成像图片由Image J处理分析:去背景后,计算相对荧光强度:deltaF/F0=(F-F0)/F0(F0为初始荧光值,F为瞬时荧光值,deltaF为F减去F0的差值)。荧光上升、下降速率是用相对荧光强度除以上升、下降的时间得到。将得到的相对荧光强度数据导入Igor Pro软件中进行数据分析。
1.8 统计学分析数据采用SPPSS 17.0软件进行分析。钙离子成像波形数据通过聚类分析分成spike和wave两类,spike和wave钙离子波形的时长、相对荧光强度、上升速率、下降速率等数据运用独立样本t检验分析组间差异。
2 结果 2.1 C17.2-GCaMP细胞表达nestin及钙离子spike波形
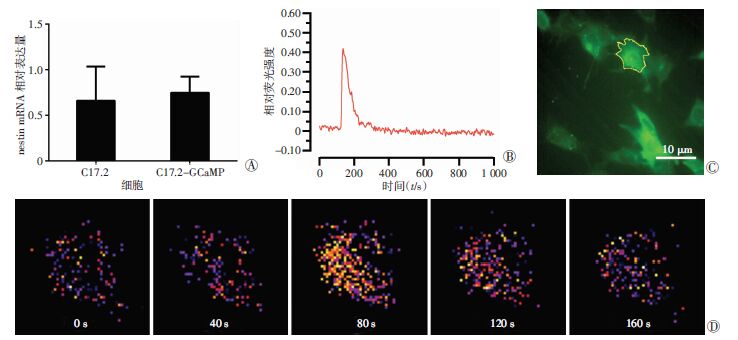
C17.2神经干细胞经过慢病毒转染流式筛选细胞扩增后获得C17.2-GCaMP细胞。C17.2-GCaMP细胞中神经干细胞标志物nestin与C17.2细胞相比较差异无统计学意义(P>0.05,图 1A)。C17.2-GCaMP细胞能够发出绿色荧光,荧光强度随胞内钙离子浓度变化而变化,呈现spike钙离子波形(图 1B~D)。
|
| A:C17.2细胞与C17.2-GCaMP细胞nestin mRNA相对表达量;B:C17.2-GCaMP细胞呈现spike波形;C:C17.2-GCaMP细胞在荧光显微镜下发出绿色荧光;D:C中标记细胞的荧光强度随着时间变化而变化 (×400) 图 1 C17.2-GCaMP细胞表达nestin及钙离子spike波形 |
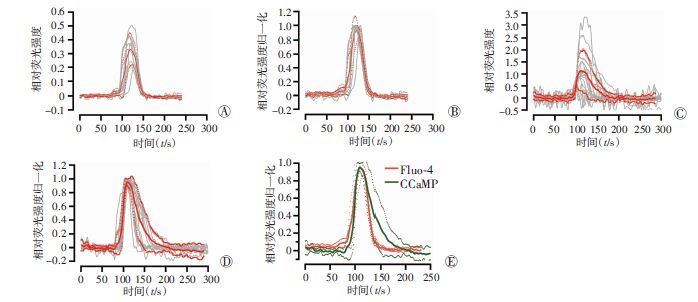
C17.2细胞 Fluo-4 AM染色与C17.2-GCaMP细胞归一化后spike波形相似(图 2A~E)。C17.2细胞Fluo-4 AM染色spike时长为(45.64±13.62)s(n= 25),C17.2-GCaMP细胞spike时长为(80.04±33.72)s (n=25),两者比较差异有统计学意义(P<0.05)。C17.2 细胞Fluo-4 AM染色相对荧光强度为(0.926±0.602),上升速率为(0.054±0.032)s-1,下降速率(0.038±0.024)s-1(n=25)。C17.2-GCaMP细胞相对荧光强度为(2.667±1.948),上升速率为(0.145±0.143)s-1,下降速率(0.059±0.058)s-1(n=25)。C17.2细胞Fluo-4 AM染色与C17.2-GCaMP细胞相比相对荧光强度差异有统计学意义(P<0.05),上升速率差异有统计学意义(P<0.05),下降速率差异无统计学意义(P>0.05)。
|
| A:C17.2 细胞Fluo-4 AM染色spike波形时长及相对荧光强度分布;B:C17.2细胞 Fluo-4 AM染色spike波形归一化;C:C17.2-GCaMP细胞spike波形时长及相对荧光强度分布;D:C17.2-GCaMP细胞spike波形归一化;E:归一化后C17.2细胞 Fluo-4 AM 染色spike波形与C17.2-GCaMP细胞spike波形比较 图 2 C17.2细胞 Fluo-4 AM染色与C17.2-GCaMP细胞钙离子spike波形比较 |
C17.2细胞经过Fluo-4 AM染色后发出绿色荧光(图 3A)。C17.2细胞经Fluo-4AM染色荧光强度及分布(反映钙离子浓度及分布)随时间变化而发生改变(图 3B、C)。C17.2-GCaMP细胞发出绿色荧光(图 3D),C17.2-GCaMP细胞荧光强度及分布(反映钙离子浓度及分布)随时间变化而发生改变(图 3E、F)。

|
| A:C17.2细胞经Fluo-4 AM染色后发出绿色荧光;B、C:C17.2细胞Fluo-4 AM染色荧光强度及分布随时间变化而变化;D:C17.2-GCaMP细胞发出绿色荧光;E、F:C17.2-GCaMP细胞荧光强度及分布随时间变化而变化;图中每个数字代表一个细胞 图 3 C17.2细胞Fluo-4 AM染色及C17.2-GCaMP细胞钙离子成像荧光交互图 |
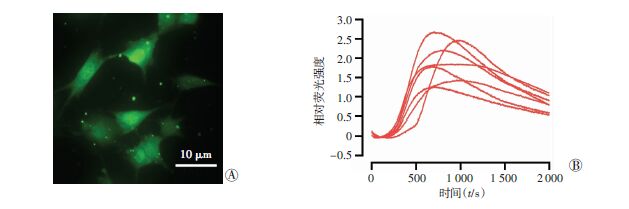
在C17.2细胞Fluo-4 AM染色中发现除spike波形外的另一种钙离子wave波形(图 4B),占细胞总数 (n=222)的44.59%。C17.2细胞Fluo-4 AM染色wave波形时长(1 458.85±396.47)s(n=27),相对荧光强度为(3.272±2.052),上升速率(0.004 8±0.002 7)s-1,下降速率(0.002 3±0.001 0)s-1(n=27),上升速率与下降速率比较有统计学差异(P<0.05)。
|
| A:C17.2细胞经Fluo-4 AM染色后发出绿色荧光;B:C17.2细胞Fluo-4 AM染色呈现wave波形的时长及相对荧光强度 图 4 C17.2细胞Fluo-4 AM染色呈现钙离子wave波形 |
在生物体内钙离子通过产生各种各样的信号,来调控众多的细胞进程[6]。在神经系统中,由于神经细胞形态的复杂性,钙离子作用复杂且广泛[7]。钙离子指示剂对观察干细胞移植整合具有重要意义。钙离子指示剂主要包括化学染料钙指示剂和基因编码钙指示剂(GECI),两种钙指示剂各有优点和局限[7]。化学染料钙指示剂具有良好的信噪比及快速的动力学[8, 9],但很难特异性标记到特定的某类神经元上,且不能进行长达数天的慢性钙离子信号记录[7]。GECI可以在神经元内长时间起作用[10, 12],结合慢性窗口记录可以进行数周至数月慢性成像[13]。GECI还可以通过细胞特定启动子[14]、打靶序列[15, 16]、Cre-loxP重组酶系统[17]记录细胞甚至亚细胞水平的钙离子信号。GECI的不足是大多数GECI胞内动力学缓慢[9],其在细胞内的长程表达可能会对细胞造成潜在影响[12]。在细胞移植研究中,GCaMP成像能够在体观察到移植细胞,且能观察到移植细胞的钙离子活动。本实验使用的GCaMP为GCaMP5G,具有良好的信噪比及动力学[18]。
nestin是一种中间丝蛋白,作为C17.2神经干细胞标志物,表达在未分化的中神经系统的细胞中[19]。当中枢神经系统的细胞分化为神经元或胶质细胞时,nestin的表达量下降[20, 21]。Real-time PCR检测结果提示nestin在C17.2细胞及C17.2-GCaMP细胞中的表达无显著差异,说明C17.2-GCaMP细胞较C17.2细胞干性无明显变化。
化学染料钙指示剂Fluo-4解离常数约为345 nmol/L,Fluo-4 AM 是Fluo-4的甲基酯形式,可穿过活细胞膜[22]。基因编码钙指示剂GCaMP5G解离常数约为460 nmol/L[18],与Fluo-4相近。归一化后平均C17.2细胞Fluo-4 AM染色spike波形与C17.2-GCaMP细胞spike波形比较,形态相似。在C17.2细胞Fluo-4 AM染色中存在钙离子spike波形和wave波形[23],在C17.2-GCaMP细胞中存在钙离子spike波形,未见典型的wave波形,仅见时长为300~600 s、相对荧光强度为0.1~1.0的不典型钙离子振荡波形。在观察的细胞中C17.2细胞Fluo-4 AM染色出现spike波形阳性细胞数占细胞总数的13.96%,wave波形阳性细胞数占细胞总数的44.59%。C17.2-GCaMP细胞spike阳性细胞占细胞总数的32.54%。C17.2-GCaMP细胞中钙离子spike波形较C17.2细胞Fluo-4 AM染色增加,且时长更长、相对荧光强度更强,但C17.2-GCaMP细胞中未见典型wave波形。钙离子wave波形可被P2Y嘌呤受体诱导,spike波形可被P2X嘌呤受体诱导[24]。C17.2-GCaMP细胞中未见典型wave波形,推测可能由于GCaMP基因在细胞内稳定表达,与胞内游离钙离子结合,致使游离钙离子相对减少,钙调蛋白和钙调磷酸酶敏感的转录因子表达发生变化[24],从而嘌呤受体表达发生变化所致。细胞的状态及周期分布等有可能影响钙离子波形。在神经发生过程中,初期钙离子spike现象增加,在神经成熟的阶段spike现象减少[25]。钙离子wave现象与神经活动、生理过程相关[26, 27],与神经干细胞增殖相关[28]。C17.2-GCaMP细胞spike现象增加,wave现象不典型,提示C17.2-GCaMP细胞相较于C17.2细胞在维持干性的情况下更易分化,能够应用于视网膜色素变性神经干细胞移植治疗功能整合的研究。
| [1] | Busskamp V, Duebel J, Balya D, et al. Genetic reactivation of cone photoreceptors restores visual responses in retinitis pigmentosa[J]. Science, 2010, 329(5990): 413-417. |
| [2] | Wong I Y, Poon M W, Pang R T, et al. Promises of stem cell therapy for retinal degenerative diseases[J].Graefes Arch Clin Exp Ophthalmol, 2011, 249(10): 1439-1448. |
| [3] | Berridge M J. Neuronal calcium signaling[J]. Neuron, 1998, 21(1): 13-26. |
| [4] | Nakai J, Ohkura M, Imoto K. A high signal-to-noise Ca2+ probe composed of a single green fluorescent protein[J]. Nat Biotechnol, 2001, 19(2): 137-141. |
| [5] | Ryder E F, Snyder E Y, Cepko C L. Establishment and characterization of multipotent neural cell lines using retrovirus vector-mediated oncogene transfer[J]. J Neurobiol, 1990, 21(2): 356-375. |
| [6] | Berridge M J, Lipp P, Bootman M D. The versatility and universality of calcium signalling[J]. Nat Rev Mol Cell Biol, 2000, 1(1): 11-21. |
| [7] | Grienberger C, Konnerth A. Imaging calcium in neurons[J]. Neuron, 2012, 73(5): 862-885. |
| [8] | Helmchen F, Borst J G, Sakmann B. Calcium dynamics associated with a single action potential in a CNS presynaptic terminal[J]. Biophys J, 1997, 72(3): 1458-1471. |
| [9] | Hendel T, Mank M, Schnell B, et al. Fluorescence changes of genetic calcium indicators and OGB-1 correlated with neural activity and calcium in vivo and in vitro[J]. J Neurosci, 2008, 28(29): 7399-7411. |
| [10] | Andermann M L, Kerlin A M, Reid R C. Chronic cellular imaging of mouse visual cortex during operant behavior and passive viewing[J]. Front Cell Neurosci, 2010, 4: 3. |
| [11] | Mank M, Griesbeck O. Genetically encoded calcium indicators[J]. Chem Rev, 2008, 108(5): 1550-1564. |
| [12] | Tian L, Hires S A, Mao T, et al. Imaging neural activity in worms, flies and mice with improved GCaMP calcium indicators[J]. Nat Methods, 2009, 6(12): 875-881. |
| [13] | Holtmaat A, Bonhoeffer T, Chow D K, et al. Long-term, high-resolution imaging in the mouse neocortex through a chronic cranial window[J]. Nat Protoc, 2009, 4(8): 1128-1144. |
| [14] | Bozza T, McGann J P, Mombaerts P, et al. In vivo imaging of neuronal activity by targeted expression of a genetically encoded probe in the mouse[J]. Neuron, 2004, 42(1): 9-21. |
| [15] | Mao T, O’Connor D H, Scheuss V, et al. Characterization and subcellular targeting of GCaMP-type genetically-encoded calcium indicators[J]. PLoS ONE, 2008, 3(3): e1796. |
| [16] | Shigetomi E, Kracun S, Sofroniew M V, et al. A genetically targeted optical sensor to monitor calcium signals in astrocyte processes[J]. Nat Neurosci, 2010, 13(6): 759-766. |
| [17] | Luo L, Callaway E M, Svoboda K. Genetic dissection of neural circuits[J]. Neuron, 2008, 57(5): 634-660. |
| [18] | Akerboom J, Chen T W , Wardill T J, et al. Optimization of a GCaMP calcium indicator for neural activity imaging[J]. J Neurosci, 2012, 32(40): 13819-13840. |
| [19] | Lendahl U, Zimmerman L B, McKay R D. CNS stem cells express a new class of intermediate filament protein[J]. Cell, 1990, 60(4): 585-595. |
| [20] | Frederiksen K, McKay R D. Proliferation and differentiation of rat neuroepithelial precursor cells in vivo[J]. J Neurosci, 1988, 8(4): 1144-1151. |
| [21] | Dahlstrand J, Lardelli M, Lendahl U. Nestin mRNA expression correlates with the central nervous system progenitor cell state in many, but not all, regions of developing central nervous system[J]. Brain Res Dev Brain Res, 1995, 84(1): 109-129. |
| [22] | Gee K R, Brown K A, Chen W N, et al. Chemical and physiological characterization of fluo-4 Ca2+-indicator dyes[J]. Cell Calcium, 2000, 27(2): 97-106. |
| [23] | Gu X, Olson E C, Spitzer N C. Spontaneous neuronal calcium spikes and waves during early differentiation[J]. J Neurosci, 1994, 14(11 Pt 1): 6325-6335. |
| [24] | Glaser T, Resende R R, Ulrich H. Implications of purinergic receptor-mediated intracellular calcium transients in neural differentiation[J]. Cell Commun Signal, 2013, 11(1): 12. |
| [25] | Carey M B, Matsumoto S G. Spontaneous calcium transients are required for neuronal differentiation of murine neural crest[J]. Dev Biol, 1999, 215(2): 298-313. |
| [26] | Spitzer N C, Lautermilch N J, Smith R D, et al. Coding of neuronal differentiation by calcium transients[J]. Bioessays, 2000, 22(9): 811-817. |
| [27] | Ulrich H, Abbracchio M P, Burnstock G. Extrinsic purinergic regulation of neural stem/progenitor cells: implications for CNS development and repair[J]. Stem Cell Rev, 2012, 8(3): 755-767. |
| [28] | Illes P, Messemer N, Rubini P. P2Y receptors in neurogenesis[J]. WIREs Membr Transp Signal, 2013, 2(1): 43-48. |



