肺癌是最常见的恶性肿瘤之一。其发病率为46.08/10万,死亡率为37/10万[1],居我国恶性肿瘤之首。研究表明,肿瘤细胞具有独特的能量代谢特征,即在有氧条件下肿瘤细胞仍高效摄取葡萄糖并产生大量乳酸进行糖酵解,该现象被称为Warburg效应[2]。己糖激酶(hexokinase,HK)是糖酵解途径的限速酶之一,在人类细胞中共有4种亚型,其中HK2与恶性肿瘤的相关性最强[3]。丙酮酸激酶(pyruvatekinase,PK) 是另一种重要的糖酵解限速酶之一,有4种同工酶,其中发现PKM2在恶性肿瘤中高表达[4]。大量研究表明糖酵解与非小细胞肺癌(non-small cell lung cancer,NSCLC)的增殖和转移密切相关[5]。
RAS基因最初在Kirsten鼠肉瘤病毒子代基因中发现,1982年在人肺癌细胞中其同系物,命名为KRAS(homo sapiensv-Ki-ras2 Kirsten rat sarcoma viral oncogenes homologue)[6]。在肺癌中,KRAS是“启动”癌变的关键的基因之一。因此,针对KRAS为分子治疗靶点的研究越来越多,但目前为止,并未发现一个有效的治疗靶点。国外研究表明,KRAS能调控细胞的糖代谢[7],从能量代谢角度设计针对KRAS的干预靶点成为一种新的方式。为研究KRAS对NSCLC能量代谢的影响,本研究检测3株NSCLC系中KRAS、HK2、PKM2的表达水平以及上清液中乳酸浓度;通过RNA 干扰技术敲低KRAS,比较敲低前后HK2、PKM2及乳酸浓度的变化;进一步研究TNF-α作用后KRAS、HK2、PKM2的表达水平和乳酸浓度的差异,为初步阐述KRAS影响非小细胞肺癌细胞糖酵解的机制提供依据。
1 材料与方法 1.1 材料H1299细胞株(武汉原生原代生物医药科技有限公司)、A549细胞株、SPC-A1细胞株(本实验室前期保存);TRIzol(康为世纪公司);逆转录试剂盒PrimeScript RT reagent Kit、荧光定量PCR反应试剂盒SYBR Premix Ex TaqTMⅡ (TaKaRa公司);引物合成(上海生工公司);HK2、PKM2、KRAS兔多克隆抗体(武汉三鹰公司),β-actin 鼠多克隆抗体(欣博盛公司);山羊抗鼠IgG抗体-HRP (中杉金桥公司),山羊抗兔IgG抗体-HRP (康为世纪公司),BCA试剂盒(碧云天公司),TNF-α(Peprotech公司),Polybrene、空病毒载体CON077、LV-KRAS-RNAi(上海吉凯基因技术有限公司)、RPMI1640(HyClone公司)、胎牛血清(Gibco公司)。
1.2 方法 1.2.1 细胞培养H1299、A549、SPC-A1细胞培养使用含10%胎牛血清、1%青/链霉素的RPMI1640培养基,置于37 ℃,5%CO2恒温孵箱中培养,细胞融合度80%~90%时传代。
1.2.2 病毒感染shRNA-KRAS序列:5′-GACTC-TGAAGATGTACCTA-3′,shRNA-control序列:5′-TTCT-CCGAACGTGTCACGT-3′,由上海吉凯基因技术有限公司合成,将对数期生长的H1299细胞胰酶消化后重悬,按2×104/孔接种于24孔板过夜培养,待细胞贴壁融合度达到30%~50%时转染病毒,根据MOI 1 ∶5,分 别加入相应量的阳性病毒以及空载病毒,感染12 h后更换培养基,分别于48、72、96 h荧光显微镜下观察H1299细胞GFP表达。细胞分3组:空白对照组(CON组)、阴性对照组(NC组)和慢病毒干扰组(KD组)。
1.2.3 流式细胞仪分选取感染病毒后的H1299细胞,胰酶消化离心后,用PBS溶液将细胞重悬为单个细胞,过滤后流式细胞仪分选,收集GFP表达阳性的H1299细胞。
1.2.4 Real-time PCR检测KRAS、HK2、PKM2在肺癌细胞中的表达取对数生长期的细胞,加入1 mL TRIzol,提取总RNA,并逆转录为cDNA,以此为模板扩增,逆转录及PCR反应均按照试剂盒说明书操作,以β-actin为内参,实验重复3次。引物序列见表 1。
| 基因 | 引物序列 | 扩增片段大小(bp) |
| KRAS | 上游:5′-CCAATTGTGAATGTTGGTGTG-3′ | 119 |
| 下游:5′-CCAATTAGAAGGTCTCAACTG-3′ | ||
| PKM2 | 上游:5′-GAG GCC TCCTCC AAG TGC T-3′ | 63 |
| 下游:5′-CCA GAC TTG GTG AGG ACG AT-3′ | ||
| HK2 | 上游:5′-CTG GAC CCG ACT CAG GAG GAC T-3′ | 130 |
| 下游:5′-CCT CGC CTT TGT TCT CCT TGA T-3′ | ||
| β-actin | 上游:5′-CAT GTA CGT TGC TAT CCA GGC-3′ | 250 |
| 下游:5′-CTC CTT AAT GTC ACG CAC GAT-3′ |
取对数生长期细胞,加预混的 RIPA裂解液(RIPA ∶PMSF=100 ∶1),冰上裂解15 min; 低温高速离心机12 000 ×g、4 ℃离心10 min,将上清移至EP管中,BCA法测定蛋白含量,加入loading buffer,在沸水中处理样品5 min,使其变性,按说明书自配12% SDS-PAGE凝胶后电泳,转膜,封闭(37 ℃,1 h),孵一抗(KRAS、HK2、β-actin均 1 ∶1 000,PKM2 1 ∶2 000),4 ℃过夜,TBST洗膜4次,每次10 min,37 ℃ 孵二抗(1 ∶5 000)1 h,TBST洗膜3次,每次5 min,ECL显影,实验重复3次。
1.2.6 乳酸浓度测定各组细胞接种至六孔板,每孔接种2×105个细胞,每个孔均设立复孔,37 ℃、5% CO2培 养。取细胞培养基上清,4 ℃ 800 r/min离心5 min,在本院检验科应用干化学方法[8]检测乳酸浓度。
1.3 统计学分析采用SPSS 13.0统计软件,两个样本均数比较应用t检验,组间比较采用单因素方差分析。
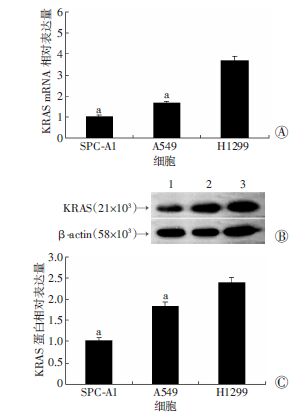
2 结果 2.1 KRAS在3种肺癌细胞中的表达水平Real-time PCR及Western blot检测结果显示,KRAS在H1299细胞中表达显著高于SPC-A1和A549细胞(P<0.05,图 1)。
|
|
a:P<0.05,与H1299细胞比较 A:Real-time PCR检测3种肺癌细胞中KRAS mRNA的表达;B:Western blot检测3种肺癌细胞中KRAS蛋白的表达 1:SPC-A1;2:A549;3:H1299;C:半定量分析KRAS蛋白表达 图 1 KRAS在肺癌细胞中的表达水平 |
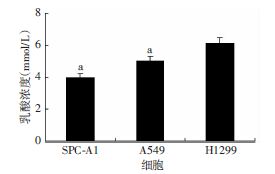
将3种肺癌细胞培养48 h后收集上清液进行乳酸浓度测定,结果显示H1299细胞中乳酸浓度最高,与SPC-A1和A549细胞相比差异有统计学意义(P<0.05,图 2)。
|
| a:P<0.05,与H1299细胞比较 图 2 肺癌细胞上清液中的乳酸水平 |
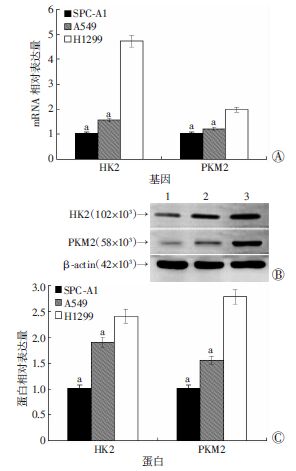
Real-time PCR及Western blot结果显示,HK2、PKM2 mRNA在H1299细胞中表达最高,与SPC-A1和A549细胞相比差异有统计学意义(P<0.05,图 3)。
|
|
a:P<0.05,与H1299细胞比较 A:Real-time PCR检测HK2、PKM2 mRNA的表达;B:Western blot检测HK2、PKM2蛋白的表达 1:SPC-A1;2:A549;3:H1299;C:半定量分析HK2、PKM2蛋白表达水平 图 3 3种肺癌细胞株中HK2、PKM2表达水平 |
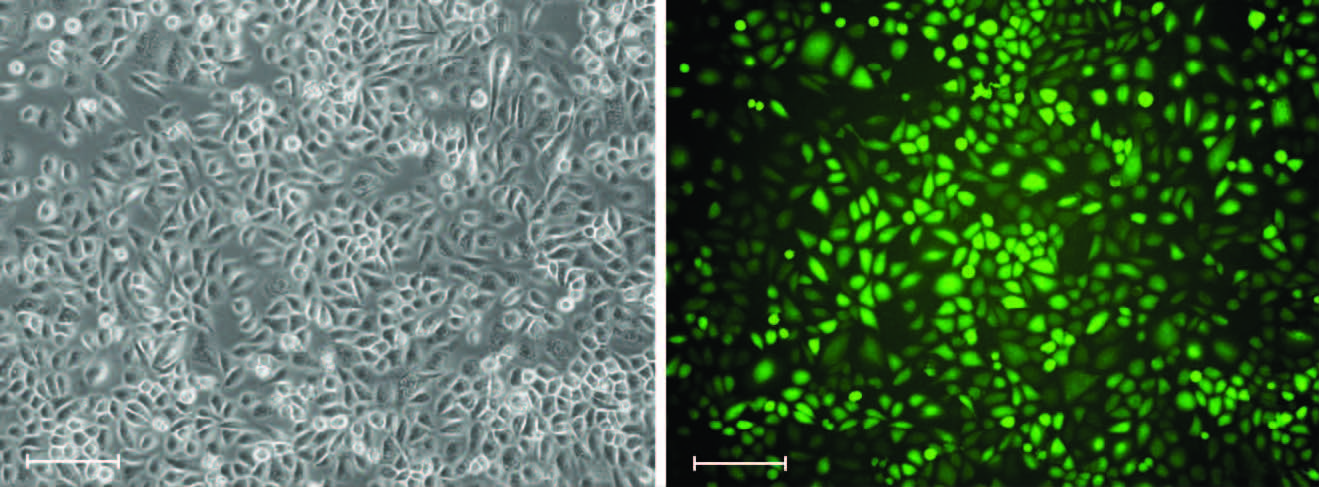
用干扰序列以及阴性对照序列同时感染H1299细胞,经流式分选提高感染效率,根据细胞的GFP表达情况来初步判断感染效率,可见H1299细胞中GFP表达阳性(图 4)。
|
| A:光镜观察;B:荧光显微镜观察 图 4 慢病毒感染H1299细胞绿色荧光蛋白的表达 |
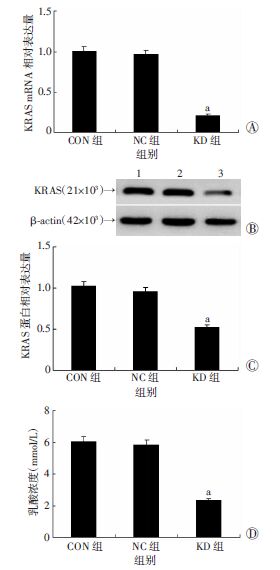
将KRAS-shRNA慢病毒感染H1299细胞后,有效抑制了KRAS mRNA的表达量。敲低KRAS后,乳酸分泌明显减少。与CON组、NC组相比差异有统计学意义(P<0.05,图 5)。
|
|
a:P<0.05,与CON组、NC组比较 A:Real-time PCR检测KRAS mRNA的表达;B:Western blot检测KRAS蛋白表达 1:CON;2:NC;3:KD;C:半定量分析KRAS蛋白表达水平;D:干化学法检测敲低前后乳酸分泌水平 图 5 KRAS敲低前后KRAS表达水平及乳酸分泌水平改变 |
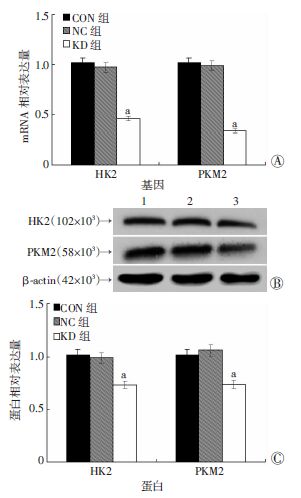
Real-time PCR、Western blot结果显示,KRAS敲低后,HK2、PKM2表达水平明显降低,且差异有统计学意义(P<0.05,图 6)。
|
|
a:P<0.05,与CON组、NC组比较 A:Real-time PCR检测HK2、PKM2 mRNA的表达;B:Western blot检测HK2、PKM2蛋白的表达 1:CON组; 2:NC组;3:KD组;C:半定量分析HK2、PKM2蛋白表达水平 图 6 KRAS敲低对HK2、PKM2表达水平的影响 |
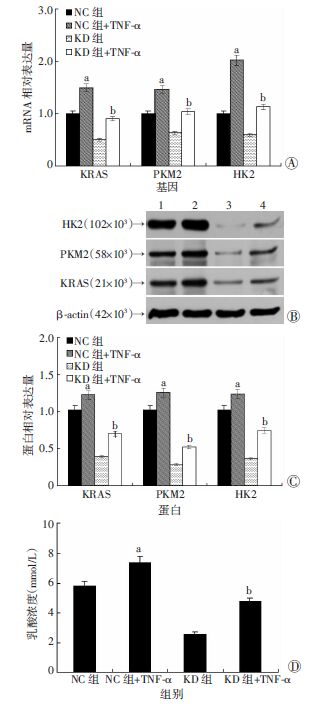
以20 ng/mL的TNF-α浓度作用于阴性对照组细胞(NC/TNF-α组)以及慢病毒干扰细胞(KD/TNF-α组)后,Real-time PCR、Western blot检测结果显示,NC组与NC/TNF-α组比较,KD组与KD/TNF-α组比较,TNF-α作用后,KRAS、HK2、PKM2表达以及乳酸分泌均较前升高,差异有统计学意义(P<0.05,图 7)。NC/TNF-α组与KD/TNF-α组比较,说明shRNA敲低KRAS可显著抑制因TNF-α升高的KRAS、HK2和PKM2的表达以及乳酸分泌水平。
|
|
a:P<0.05,与NC组比较;b:P<0.05,与KD组比较 A:Real-time PCR检测TNF-α作用后各组KRAS、HK2、PKM2 mRNA的表达;B:Western blot检测TNF-α作用后各组KRAS、HK2、PKM2蛋白的表达 1:NC组;2:NC组+TNF-α;3:KD组;4:KD组+TNF-α;C:半定量分析蛋白表达水平;D:干化学方法检测TNF-α作用于NC组、KD组细胞乳酸分泌变化 图 7 TNF-α对KRAS敲低细胞KRAS、HK2、PKM2及乳酸分泌的影响 |
20世纪20年代,Otto Warburg发现在肿瘤细胞中,即使在供氧充足的情况下葡萄糖仍向乳酸转换,这种代谢现象称之为Warburg效应。乳酸的增加为肿瘤细胞提供酸性环境,利于肿瘤细胞的生长、增殖。因此,在肿瘤细胞中研究糖代谢的调节有着重要的意义[6]。肿瘤细胞选择糖酵解作为其主要产能方式与其发生过程中癌基因密切相关[9]。在过去的十年中,大量证据表明,致癌基因参与调节糖酵解以及其他相关代谢途径,如KRAS、PI3K、mTOR等[10]。肺癌中,KRAS癌基因与肿瘤细胞的生存、增殖、转移等均有关,且与NSCLC不良预后有关,所以KRAS是肺癌能量代谢的研究热点,KRAS也成为肺癌基因治疗的靶点之一,但是特异性抑制KRAS基因的治疗却鲜有成效。有研究报道表明KRAS能通过提高葡萄糖的摄取、增加葡萄糖中间产物、重编谷氨酰胺代谢、增加自噬等方式来增加糖酵解[11, 12]。
在肿瘤的发生、发展过程中,肿瘤生长的异质性导致肿瘤病理生理结构异常,从而引起肿瘤细胞基因及相关蛋白质的表达发生改变,同时会诱导肿瘤细胞发生新生血管或增强糖酵解过程来获取能量,以此造成肿瘤细胞恶性转化、侵袭转移以及对放化疗等治疗的抵抗,给临床上肿瘤的治疗带来困扰。换个角度考虑,正是这些问题的发现,也为肿瘤的治疗带来新的切入点。我们知道,有氧糖酵解是肿瘤最明显的能量代谢特征,而己糖激酶和丙酮酸激酶是糖酵解过程中的关键酶,既然KRAS能通过一系列途径增加肿瘤细胞的糖酵解,那么KRAS能否通过影响糖酵解关键酶(HK2、PKM2)来影响糖酵解呢?如果能证明KRAS通过HK2、PKM2等直接影响肿瘤细胞的糖酵解过程,那么有可能在干预肿瘤细胞的能量代谢方面寻找到新的治疗靶点。因此,本研究在3种非小细胞肺癌细胞系中检测KRAS、HK2、PKM2表达水平以及乳酸浓度;通过RNA干扰技术敲低KRAS,再次检测糖酵解酶HK2、PKM2的变化及乳酸浓度的改变。实验结果表明有3株NSCLC细胞系中,H1299细胞中KRAS、 HK2、PKM2表达以及乳酸浓度显著高于SPC-A1和A549。通过敲低KRAS水平,再次检测HK2、PKM2的表达水平,发现2种关键酶均降低,细胞乳酸浓度也明显降低,表明HK2、PKM2的表达水平与KRAS的表达水平正相关,同时调控细胞乳酸的分泌。
TNF-α是由巨噬细胞分泌的一种具有复杂生物活性的细胞因子,能促进肿瘤细胞的增殖。最近国外研究表明TNF-α能介导RAS的表达[13, 14]。我们试图将TNF-α作为KRAS的激动剂,根据文献[15]报道,选择最适TNF-α浓度(20 ng/mL)作用于阴性对照组和慢病毒干扰组细胞,观察作用前后2种细胞中KRAS、HK2、PKM2的差别,发现作用后KRAS基因表达量升高,同时糖酵解关键酶HK2、PKM2表达也升高,作用后的细胞乳酸分泌量明显增多。表明TNF-α能促进KRAS的表达。我们通过敲低KRAS后,糖酵解关键酶HK2、PKM2的表达也随之降低,糖酵解终产物乳酸也降低;使用shRNA敲低KRAS表达水平后,可部分扭转TNF-α升高的HK2、PKM2和乳酸分泌水平,表明KRAS通过影响糖酵解的关键酶HK2、PKM2而促进NSCLC的糖酵解过程。
本研究不足之处在于,缺少体内实验,后续可进行动物实验,研究敲低KRAS基因后对裸鼠成瘤情况的影响。总的来说,KRAS参与NSCLC细胞的能量代谢过程,通过调控糖酵解过程中的关键酶HK2、PKM2而促进糖酵解过程。
| [1] | 陈万青, 郑荣寿, 张思维. 中国恶性肿瘤的动态变化[J]. 科技导报, 2014, 32(26): 65-71. |
| [2] | Warburg O. On the origin of cancer cells[J]. Science, 1956, 123(3191): 309-314. |
| [3] | Shinohara Y, Yamamoto K, Kogure K, et al. Steady state transcript levels of the type Ⅱ hexokinase and type 1 glucose transporter in human tumor cell lines[J]. Cancer Lett, 1994, 82(1): 27-32. |
| [4] | Meng M B, Wang H H, Guo W H, et al. Targeting pyruvate kinase M2 contributes to radiosensitivity of non-small cell lung cancer cells in vitro and in vivo[J]. Cancer Lett, 2015, 356(2 Pt B): 985-993. |
| [5] | 刘博宁, 罗猛, 周清华, 等. 糖酵解与肺癌相关研究进展[J]. 中国肺癌杂志, 2012, 15(4): 228-233. |
| [6] | Parada L F, Weinberg R A. Presence of a Kirsten murine sarcoma virus ras oncogene in cells transformed by 3-methylcholanthrene[J]. Mol Cell Biol, 1983, 3(12): 2298- 2301. |
| [7] | Kinnaird A, Michelakis E D. Metabolic modulation of cancer: a new frontier with great translational potential[J]. J Mol Med (Berl), 2015, 93(2): 127-142. |
| [8] | 梁丽峰, 李佩佩, 常蕊静, 等. 人小细胞肺癌细胞H446及其MDR细胞H446/DDP受顺铂冲击后乳酸代谢与活性氧产生情况[J]. 中华肺部疾病杂志: 电子版, 2013, 6(2): 134-138. |
| [9] | Levine A J, Puzio-Kuter A M. The control of the metabolic switch in cancers by oncogenes and tumor suppressor genes[J]. Science, 2010, 330(6009): 1340-1344. |
| [10] | Bryant K L, Mancias J D, Kimmelman A C, et al. KRAS: feeding pancreatic cancer proliferation[J]. Trends Biochem Sci, 2014, 39(2): 91-100. |
| [11] | Sasaki H, Shitara M, Yokota K, et al. Overexpression of GLUT1 correlates with Kras mutations in lung carcinomas[J]. Mol Med Rep, 2012, 5(3): 599-602. |
| [12] | Pylayeva-Gupta Y, Grabocka E, Bar-Sagi D. RAS oncogenes: weaving a tumorigenic web[J]. Nat Rev Cancer, 2011, 11(11): 761-774. |
| [13] | Mantovani A, Allavena P, Sica A, et al. Cancer-related inflammation[J]. Nature, 2008, 454(7203): 436-444. |
| [14] | Leibovich-Rivkin T, Liubomirski Y, Meshel T, et al. The inflammatory cytokine TNFα cooperates with Ras in elevating metastasis and turns WT-Ras to a tumor-promoting entity in MCF-7 cells[J]. BMC Cancer, 2014, 14: 158. |
| [15] | 徐采云, 李理, 袁伟锋, 等. 不同浓度肿瘤坏死因子-α对肺腺癌A549细胞的影响[J]. 山东医药, 2013, 53(21): 4-6. |



