分化抑制因子(inhibitors of differentiation,Id)属于螺旋-环-螺旋(helix-loop-helix,HLH)蛋白家族成员之一,由于其分子结构中缺乏与DNA碱性蛋白结合的特殊区域,因此Id蛋白可以抑制同一家族的碱性螺旋-环-螺旋(basic helix-loop-helix,bHLH)转录因子的活性,从而抑制细胞分化,促进细胞增殖[1]。哺乳动物细胞含4种Id亚型(Id1~Id4),其中以Id1分子研究最为透彻深入。骨形态发生蛋白(bone morphogenetic proteins,BMPs)具备丰富的生物学作用,能够调控不同类型的细胞增殖、分化和凋亡,在促进骨形成、组织损伤的修复中发挥重要作用[2, 3],是目前发现的成骨及成软骨活性最强的生物蛋白。本课题组前期实验发现,在BMP-2的诱导下,基因芯片分析显示Id1基因在椎间盘细胞中的表达丰度及含量明显增高,而目前国内尚少见有关Id基因对BMPs维持椎间盘细胞软骨特性调节作用的文献报道,因此有必要深入研究Id基因对椎间盘细胞的影响以及Id与BMPs之间的相互作用关系。本实验通过构建Id1基因的过表达(gene overexpression)和RNA干扰(RNA interference,RNAi)慢病毒载体,分别转染兔椎间盘髓核细胞确定其效应后再转染BMP-2诱导的体外细胞模型,从RNA水平研究外源性BMPs及Id基因在髓核细胞内表达后的生物学效应,进一步分析Id基因对BMPs维持椎间盘细胞软骨特性的调节作用,为今后从BMP信号转导途径入手寻找一种治疗椎间盘退变更为理想的生物学方法提供理论依据和实验基础。
1 材料与方法 1.1 主要实验仪器及试剂梯度PCR仪、紫外分光光度仪(Eppendorf MG,德国),微量DNA/RNA定量仪(GeneGuent Pro,美国),电泳仪(Bio-Rad,美国),凝胶成像仪稳压DNA电泳仪(Tianneng,美国),GDS8000凝胶扫描系统(UVP,美国),光学倒置显微镜、荧光倒置显微镜(Olympus AX70,日本)。DMEM培养基(Gibco,美国),胎牛血清、胰蛋白酶(Invitrogen,美国),青霉素/链霉素抗生素(华北制药厂,中国),PrimeSTARTM HS DNA聚合酶、RNase-free、RNase抑制剂、DL2000 DNA ladder (TaKaRa公司,日本),AMV Reverase Transcriptase(Promega公司,美国),10 mmol/L dNTP(上海生工,中国),T4 DNA ligase buffer(NEB,美国)。
1.2 慢病毒载体、包装细胞和菌株(1)慢病毒载体系统(Tronolab公司)组成:LV5(过表达)、LV3(干涉)、PG-p1-VSVG、PG-P2-REV、PG-P3-RRE,其中LV5和LV3能表达绿色荧光蛋白(GFP)。(2)293T(中科院上海细胞所):慢病毒的包装细胞。(3)重组腺病毒AdBMP2:上海汉恒生物技术有限公司提供。
1.3 LV5-ID1过表达质粒与LV3-ID1-RNAi干扰质粒的构建参考Id1在GenBank中的序列(NCBI GenBank,Gene ID: 100358975)合成引物(由威斯腾生物技术重庆有限公司完成),分别设计PCR引物扩增相应的过表达及干扰序列,酶切过表达载体LV5和干涉载体LV3,分别纯化酶切产物后进行定向连接,再将产物转化细菌感受态细胞,对长出的克隆先进行PCR鉴定和酶切鉴定,鉴定出阳性的克隆,证明目的基因已经定向连入目的载体。再将阳性的克隆进行测序并对测序结果进行序列分析比对,比对正确的即为构建成功的LV5-ID1与LV3-ID1-RNAi慢病毒载体。
1.4 基因慢病毒包装 1.4.1 细胞接种及质粒转染用胰蛋白酶消化对数生长期的293T细胞,重新接种于10 cm细胞培养皿(每个平皿接种细胞约为2×106),37 ℃、50 mL/L CO2培养箱内培养。当细胞密度达60%~70%时转染。将各质粒和磷酸钙混合液转移至含单层细胞的培养液中混匀,培养6~8 h后弃去含有转染混合物的培养液,加入PBS 15 mL,轻摇后弃去,重复该步骤3次;每瓶细胞中加入含10%胎牛血清的细胞培养液6 mL,继续培养48 h;收集转染72 h的293T细胞上清液;将收集的上清液于4 ℃,4 000×g离心10 min,收集离心后的上清液;将上清液以0.45 μm滤器过滤;于40 mL超速离心管中,4 ℃、25 000 r/min离心2 h;最后以 500 μL DMEM重悬病毒沉淀于4 ℃溶解过夜。
1.4.2 慢病毒滴度测定慢病毒转染293T细胞8 h 后更换为完全培养基,继续培养48 h后,收集富含慢病毒颗粒的细胞上清液,对其浓缩后得到高滴度的慢病毒浓缩液,感染293T细胞后采用倍比稀释法检测病毒滴度。
1.5 髓核细胞原代培养取成年健康新西兰大白兔5只,体质量4~5 kg,处死动物后立即取出L2~L3到L6~L7节段椎间盘,参考文献[4, 5]方法进行髓核细胞二维培养传代:取得标本后用PBS液洗净,无菌分离椎间盘中髓核组织,剪至大小为1 mm×1 mm×1 mm大小的组织块,Ⅱ型胶原酶37 ℃水浴消化4~5 h,200目滤网过滤除去残余的组织碎块,800 r/min离心5 min后去上清液,含20% FBS和1%青-链霉素的培养基重悬细胞后分装细胞培养瓶,于37 ℃、5% CO2的孵箱中培养,每周换液3次。原代细胞生长至70%~80%融合时,以0.25%胰蛋白酶消化、传代。
1.6 荧光定量PCR检测慢病毒转染后髓核细胞Id1 mRNA表达采用SYBR Green法[6, 7]检测慢病毒感染后髓核细胞Id1基因mRNA表达情况。收集细胞,按TRIzol试剂说明提取总RNA,按TaKaRa公司试剂盒说明逆转录cDNA。Id1上游引物5′-CTGGAGGAAGCCAAC-AAGATG-3′,下游引物5′-AGACGATTGACAACCAT-AAGTGAG-3′,片段大小149 bp。内参β-actin上游引物: 5′-TCACCATGGATGATGATATCGC-3′,下游引物: 5′-CGTGCTCGATGGGGTACTTCA-3′,片段大小225 bp。以未转染病毒的细胞作为空白对照组(正常细胞组),以空载病毒组作为阴性对照组,应用2-ΔCt法评估目的基因表达量。
1.7 Western blot检测重组慢病毒颗粒感染后髓核细胞Id1蛋白的表达使用蛋白质试剂盒提取细胞总蛋白,经过SDS-PAGE电泳分离的蛋白质样品,转移到固相载体PVDF膜上,以固相载体上的蛋白质或多肽作为抗原,与对应的抗体起免疫反应,再与酶或同位素标记的第二抗体反应。用UVP凝胶图像处理系统Labworks 4.6软件分析目的条带的灰度值。
1.8 荧光定量PCR 检测髓核细胞colⅡ、ACAN、Id1的mRNA表达用表达BMP-2的重组腺病毒载体AdBMP2感染兔髓核细胞,建立BMP-2诱导的体外细胞模型。然后利用已制备的两种慢病毒分别感染此模型,通过检测兔髓核细胞表达软骨特异机制分子的能力,以明确Id1对BMP-2维持椎间盘细胞软骨特性的调节作用。本实验设置Id1过表达慢病毒+AdBMP2组和Id1 RNAi慢病毒+AdBMP2组为实验组,空载病毒GFP组为空白对照组,AdBMP2感染组、Id1过表达慢病毒+GFP组和Id1RNAi慢病毒+GFP组为实验对照组,分别检测各组细胞colⅡ、ACAN、Id1的mRNA表达,以2(-ΔCt)法处理数据结果评估不同软骨特性因子的mRNA表达量变化规律。
1.9 统计学方法采用SPSS 17.0统计软件分析,计量资料以x±s表示,组间比较采用t检验。
2 结果 2.1 重组慢病毒滴度测定病毒转染24 h后荧光显微镜即可见荧光,转染后72 h镜下荧光明显,表明病毒成功包装。收集合成的慢病毒液,使用逐孔稀释滴度测定法,测定结果均达到1×108 TU/mL以上(图 1、2)。
 |
| A:病毒稀释10倍后感染细胞;B:病毒稀释100倍后感染细胞;C:病毒稀释1 000倍后感染细胞;D:病毒稀释10 000倍后感染细胞 图 1 病毒侵染293T细胞72 h后LV3-ID1-RNAi滴度检测 (荧光显微镜×100) |
 |
| A:病毒稀释10倍后感染细胞;B:病毒稀释100倍后感染细胞;C:病毒稀释1 000倍后感染细胞;D:病毒稀释10 000倍后感染细胞 图 2 病毒侵染293T细胞72 h后LV5-ID1滴度检测 (荧光显微镜×100) |
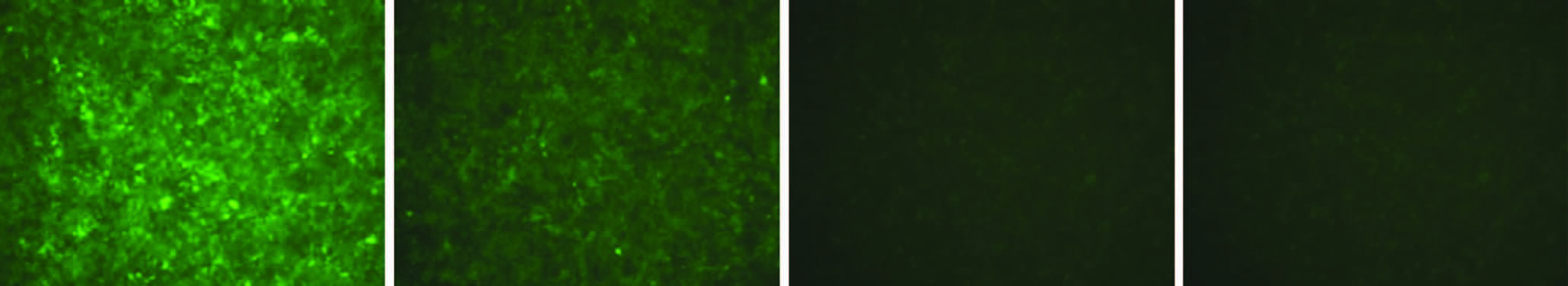
转染48 h后采用荧光显微镜观察GFP(绿色荧光)的表达,可见两种慢病毒转染效率均达到80%以上(图 3)。
 |
| A:过表达慢病毒光镜观察;B:过表达慢病毒荧光显微镜观察;C:RNAi慢病毒光镜观察;D:RNAi慢病毒荧光显微镜观察 图 3 髓核细胞感染慢病毒后细胞生长情况及荧光蛋白表达 (×100) |
正常细胞组及空载病毒组与过表达组相比,Id1 mRNA表达水平明显增高,差异有统计学意义(P<0.05);与RNAi组相比,Id1 mRNA表达水平显著降低,差异有统计学意义(P<0.05);未感染慢病毒细胞组与空载病毒感染细胞组比较差异无统计学意义(表 1)。
| (n=3,x±s) | |||
| 组别 | 内参Ct值 | Id1Ct值 | 2(-ΔCt) |
| 正常细胞组 | 20.468±0.319 | 24.998±0.184 | 0.428±0.079 |
| 空载病毒组 | 20.361±0.316 | 24.858±0.284 | 0.400±0.045 |
| 过表达组 | 19.566±0.418a | 23.457±0.377a | 0.848±0.154a |
| RNAi组 | 20.118±0.346a | 26.820±0.068a | 0.115±0.014a |
| a: P<0.01,与正常对照组和空载病毒组比较 | |||
Western blot检测结果所示(图 4),各目的条带灰度值计算以ADAM19/GAPDH表示,检测结果:未转染细胞组为0.773,GFP空载病毒组为0.756,过表达慢病毒组为0.893,RNAi慢病毒组为0.582。检测结果可见:过表达慢病毒组Id1蛋白表达水平明显高于未转染及空载病毒组,而RNAi慢病毒组Id1蛋白表达水平明显低于未转染细胞组及空载体慢病毒感染细胞组。
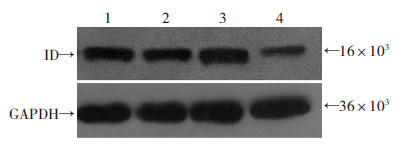 |
| 1:未转染细胞组;2:GFP空载体慢病毒感染细胞组;3:过表达慢病毒感染细胞组;4:RNAi慢病毒感染细胞组 图 4 Western blot检测各组细胞Id1蛋白的表达 |
如表 2所示,(1)BMP-2组与GFP组相比,colⅡ、ACAN、Id1的mRNA表达量明显增加。(2)Id1过表达慢病毒+GFP组与GFP组相比,colⅡ、ACAN、Id1表达量均增加;RNAi+GFP组与GFP组相比以上因子表达量减少。(3)Id1过表达慢病毒+BMP-2组与BMP-2感染组相比,Id1的表达增加能够显著促进colⅡ、ACAN、Id1表达量显著增加;Id1 RNAi慢病毒+BMP-2组与BMP-2组相比,Id1表达减少后,BMP-2诱导软骨样特性因子分泌的作用被明显抑制。上述差异均具有统计学意义(P<0.01)。
| (x±s) | ||||||
| 组别 | colⅡ | Id1 | ACAN | |||
| ΔCt | 2(-ΔCt) | ΔCt | 2(-ΔCt) | ΔCt | 2(-ΔCt) | |
| 空载病毒GFP组 | 2.304±0.128 | 0.203±0.018 | 4.713±0.217 | 0.038±0.005 | 2.792±0.218 | 0.145±0.022 |
| BMP-2感染组 | 1.376±0.138a | 0.387±0.036a | 3.775±0.486a | 0.073±0.027a | 2.032±0.218a | 0.246±0.037a |
| Id1过表达慢病毒+BMP-2组 | 0.767±0.173b | 0.590±0.072b | 2.908±0.106b | 0.133±0.010b | 1.529±0.291b | 0.351±0.066b |
| Id1 RNAi慢病毒+BMP-2组 | 2.062±0.374b | 0.244±0.060b | 4.305±0.151b | 0.051±0.005b | 2.590±0.294b | 0.168±0.034b |
| Id1过表达慢病毒+GFP组 | 1.318±0.315a | 0.407±0.083a | 3.448±0.365a | 0.092±0.024a | 1.846±0.371a | 0.284±0.074a |
| Id1RNAi慢病毒+GFP组 | 2.747±0.425a | 0.153±0.044a | 5.171±0.115a | 0.028±0.002a | 3.067±0.179a | 0.119±0.015a |
| a: P<0.01,与空载病毒GFP组比较;b: P<0.01,与BMP-2感染组比较 | ||||||
退变性椎间盘疾病是当今社会老年人群中的常见疾病,由其引起的肌肉劳损、腰背疼痛等症状严重困扰患者的正常生活。目前治疗椎间盘退变性疾病的方法主要为手术去除病变椎间盘组织,而并未涉及椎间盘退变的病理生理过程,相反带来了诸多临床问题,因此寻找一种更为理想的治疗椎间盘退变的方法依然是临床医师面临的重要课题。从细胞生理的角度看,椎间盘退变最突出的变化主要包括椎间盘内细胞数目的减少和软骨特异基因的表达产物的合成下降[8],其中Ⅱ型胶原、蛋白多糖是最主要的两种软骨细胞因子[9, 10]。因此,研究发现椎间盘退变的这一特征后,恢复椎间盘中蛋白多糖和Ⅱ型胶原蛋白的产生成为治疗椎间盘退变的重要因素,通过基因载体将外源性目的基因导入椎间盘髓核,从而促进细胞外基质合成来治疗椎间盘退变的基因疗法是近年的研究热点。
BMPs属于转化生长因子超家族的一类多功能分泌型信号分子,是一种酸性蛋白质,能够调控不同类型的细胞(包括成骨细胞、软骨细胞、神经元细胞和上皮细胞等)的增殖、分化和凋亡,并在体内通过级联信号传导发挥多种重要的生物学效应,尤其是在促进骨形成、组织损伤的修复中发挥重要作用[2],是目前发现的成骨及成软骨活性最强的生物蛋白。近年已有大量实验围绕BMPs的成骨分化作用研究椎间盘退变的修复机制,BMP-2作为通过美国食品和药物管理局(FDA)认证批准应用于腰椎手术的人类重组生长因子[11]在研究中备受青睐:Kim等[12]利用藻酸盐载体进行人体椎间盘细胞的三维培养,通过中国仓鼠卵巢细胞BMP-2cDNA基因转导制备rhBMP-2,用rhBMP-2干预椎间盘细胞后进行培养,检测发现蛋白多糖合成增加,Ⅰ、Ⅱ型胶原表达量有所增加。Haschtmann等[13]采用了完整的兔椎间盘外植体作为实验对象,在BMP-2或TGF-β3浓度为1 μg/mL的DMEM-F12培养基中进行培养,21 d后RT-PCR检测发现髓核及纤维环的蛋白多糖、胶原酶基因表达量增加,证明这两类细胞因子具有软骨特性诱导作用。此外,在研究BMPs生物学效应的过程中发现,BMPs诱导椎间盘髓核细胞后分化抑制因子(Id)的表达丰度增加[14, 15],可能促进了椎间盘髓核增殖并分泌软骨样基质如Ⅱ型胶原、蛋白多糖及上调Id基因,因此研究Id基因的时空变化规律对BMPs诱导椎间盘细胞增殖和促进细胞外基质合成具有重要意义。
Id分子含119~199个氨基酸残基,人的Id 1~4 编码基因分别定位于20q1、2p25、1p36和6p22~2l号染色体。Id分子经典的作用是促进细胞增殖,抑制分化,其中存在两条途径:①bHLH依赖性途径:Id通过分子调节细胞周期蛋白依赖性激酶(CDKs)抑制剂(CDKIs)而发挥作用。②bHLH非依赖性途径:Id分子可直接与非bHLH蛋白如pRB、Ets结构域转录因子、Pax蛋白、MIDA1等结合,减弱pRB对转录因子E2F2DP1的抑制作用,影响细胞增殖分化[16]。除了与细胞增殖潜能分化状态的维持密切相关之外,Id蛋白家族还具有更广泛的生物学作用,如调控细胞定向分化、促进胚胎形成和器官形成、诱导细胞凋亡、促进血管形成及肿瘤浸润等[17, 18]。
本实验通过成功构建过表达和沉默Id1基因的慢病毒载体LV5-ID1与LV3-ID1-RNAi,体外转染兔椎间盘髓核细胞后证实有效干预细胞内Id1基因和蛋白的表达水平,然后建立BMP-2诱导的体外细胞模型,用已制备的两种慢病毒分别感染此模型,根据检测软骨特性分子的mRNA表达以明确Id1对BMP-2维持椎 间盘细胞软骨特性的调节作用。实验结果证实:(1)在 椎间盘细胞中BMP可以显著上调分化抑制因子Id1、Ⅱ型胶原、蛋白多糖的表达,Id分子作为重要的调节细胞活性状态的信号,可能与BMP信号系统相互作用以促进椎间盘细胞的增殖及软骨样基质的分泌;(2)细胞中Id1基因表达增加后,colⅡ、ACAN、Id1表达量均增加,若同时以BMP-2诱导细胞,colⅡ、ACAN、Id1表达量均进一步显著增加,证明Id1能够促进椎间盘细胞软骨特性分子的表达,与BMP-2具有协同作用。同时,通过RNAi慢病毒阻断Id1基因的持续表达,将会抑制BMPs诱导的软骨样基质分泌及抑制细胞增殖。由此可以看出,Id基因作为BMPs诱导的成骨分化过程下游目的基因,起着平衡细胞增殖与分化的作用。但是Id基因具体以何种机制调节BMPs诱导椎间盘细胞增殖和促进细胞外基质合成以及对BMPs诱导的干细胞定向成骨的影响目前仍知之甚少。相关研究显示,BMPs信号以Smads依赖方式诱导Id基因的表达[19],Id分子信号增强可对抗bHLH转录因子的活性,从而调节BMPs转导途径。除了经典的Smads通路外,Id基因MAPKs通路在BMPs信号系统调节的干细胞分化中也有密切的联系[20]。总的来讲,Id基因如何调节BMPs诱导的干细胞成骨分化,是否是干细胞骨向分化途径上的“路标”,Id分子与Smads和MAPKs信号通路具体的作用机制等问题仍未明确得到答案,因此有必要更深入地研究Id基因对椎间盘细胞的影响及其与BMPs的相互作用机制。
本课题组进行有关Id基因对BMPs维持椎间盘细胞软骨特性调节作用的相关研究,实验结果发现Id1是BMP-2维持椎间盘细胞软骨特性作用的关键因子,并且在促进髓核细胞软骨特性因子的表达过程中发挥重要作用。但本实验并未从分子信号传导通路的角度进一步阐述其具体作用机制,因此研究结果尚存在一定局限性。本课题组拟在此研究结论的基础上进行Id基因对BMPs维持椎间盘细胞软骨表型作用的信号通路传导途径入手进行更深入的研究,旨在从分子水平明确Id对BMP维持椎间盘细胞软骨特性的具体调节机制,希望通过新的途径探索基因治疗椎间盘退变的方法,为今后从BMP信号转导途径入手,寻找一种治疗椎间盘退变更为理想的生物学方法提供理论依据和实验基础。
| [1] | Weiler S, Ademokun J A, Norton J D. ID helix-loop-helix proteins as determinants of cell survival in B-cell chronic lymphocytic leukemia cells in vitro[J]. Mol Cancer, 2015, 14: 30. |
| [2] | Moghaddam A, Elleser C, Biglari B, et al. Clinical application of BMP 7 in long bone non-unions[J]. Arch Orthop Trauma Surg, 2010, 130(1): 71-76. |
| [3] | Shah P, Keppler L, Rutkowski J. Bone morphogenic protein: an elixir for bone grafting—a review[J]. J Oral Implantol, 2012, 38(6): 767-778. |
| [4] | Gruber H E, Hoelscher G L, Ingram J A, et al. Production and expression of RANTES (CCL5) by human disc cells and modulation by IL-1-β and TNF-α in 3D culture[J]. Exp Mol Pathol, 2014, 96(2): 133-138. |
| [5] | Kim H, Lee J U, Moon S H, et al. Zonal responsiveness of the human intervertebral disc to bone morphogenetic protein-2[J]. Spine (Phila Pa 1976), 2009, 34(17): 1834-1838. |
| [6] | Abera T, Thangavelu A. Development of a two-step SYBR Green I based real time RT-PCR assay for detecting and quantifying peste des petits ruminants virus in clinical samples[J]. J Virol Methods, 2014, 209: 25-29. |
| [7] | Tajadini M, Panjehpour M, Javanmard S H. Comparison of SYBR Green and TaqMan methods in quantitative real-time polymerase chain reaction analysis of four adenosine receptor subtypes[J]. Adv Biomed Res, 2014, 3: 85. |
| [8] | Hou G, Lu H, Chen M, et al. Oxidative stress participates in age-related changes in rat lumbar intervertebral discs[J]. Arch Gerontol Geriatr, 2014, 59(3): 665-669. |
| [9] | Pattappa G, Li Z, Peroglio M, et al. Diversity of intervertebral disc cells: phenotype and function[J]. J Anat, 2012, 221(6): 480-496. |
| [10] | 周年, 黄伟, 廖军义, 等. 低氧诱导因子-1α对骨形态发生蛋白2诱导的干细胞成软骨、成骨分化的影响[J]. 第三军医大学学报, 2014, 36(12): 1243-1248. |
| [11] | Maerz T, Herkowitz H, Baker K. Molecular and genetic advances in the regeneration of the intervertebral disc[J]. Surg Neurol Int, 2013, 4(Suppl 2): S94-S105. |
| [12] | Kim D J, Moon S H, Kim H, et al. Bone morphogenetic protein-2 facilitates expression of chondrogenic, not osteonenic, phenotype of human intervertebral disc cells[J]. Spine (Phila Pa 1976), 2003, 28(24): 2679-2684. |
| [13] | Haschtmann D, Ferguson S J, Stoyanov J V. BMP-2 and TGF-β3 do not prevent spontaneous degeneration in rabbit disc explants but induce ossification of the annulus fibrosus[J]. Eur Spine J, 2012, 21(9): 1724-1733. |
| [14] | Hayashi M, Nimura K, Kashiwagi K, et al. Comparative roles of Twist-1 and Id1 in transcriptional regulation by BMP signaling[J]. J Cell Sci, 2007, 120(Pt 8): 1350-1357. |
| [15] | Kee B L, Rivera R R, Murre C. Id3 inhibits B lymphocyte progenitor growth and survival in response to TGF-beta[J]. Nat Immunol, 2001, 2(3): 242-247. |
| [16] | Peretz Y, Wu H, Patel S, et al. Inhibitor of DNA Binding 4 (ID4) is highly expressed in human melanoma tissues and may function to restrict normal differentiation of melanoma cells[J]. PLoS One, 2015, 10(2): e0116839. |
| [17] | Denay G, Creff A, Moussu S, et al. Endosperm breakdown in Arabidopsis requires heterodimers of the basic helix-loop-helix proteins ZHOUPI and INDUCER OF CBP EXPRESSION 1[J]. Development, 2014, 141(6): 1222-1227. |
| [18] | Huang J, Vogel G, Yu Z, et al. Type Ⅱ arginine methyltransferase PRMT5 regulates gene expression of inhibitors of differentiation/DNA binding Id2 and Id4 during glial cell differentiation[J]. J Biol Chem, 2011, 286(52): 44424-44432. |
| [19] | Liang Y Y, Brunicardi F C, Lin X. Smad3 mediates immediate early induction of Id1 by TGF-beta[J]. Cell Res, 2009, 19(1): 140-148. |
| [20] | Tada K, Kawahara K, Matsushita S, et al. MK615, a Prunus mume Steb. Et Zucc ( Ume’) extract, attenuates the growth of A375 melanoma cells by inhibiting the ERK1/2-Id-1 pathway[J]. Phytother Res, 2012, 26(6): 833-838. |



