2. 400016 重庆,重庆医科大学附属第一医院耳鼻喉科;
3. 400042 重庆,第三军医大学大坪医院野战外科研究所耳鼻咽喉科
2. Department of Otolaryngology,the First Affiliated Hospital of Chongqing Medical University,Chongqing,400016;
3. Department of Otolaryngology,Institute of Surgery Research,Daping Hospital,Third Military Medical University,Chongqing,400042,China;
鼻咽癌(nasopharyngeal carcinoma,NPC)是我国南方常见的恶性肿瘤之一,由于其发生部位隐蔽、生长快、恶性程度高、易早期转移等特点,常难以早期诊断,放疗是早期鼻咽癌最为有效的治疗方法;对于中晚期及远处转移的患者放疗联合辅助化疗已成为常用的治疗手段,然而整体治疗效果欠佳。因此,研究开发针对鼻咽癌的分子靶向治疗极为必要,因而有必要探寻喉鼻咽癌诊治的新靶点。
叉头框M1(forkhead box M1,FoxM1)是Fox转录因子家族的一员,参与细胞的增殖、凋亡以及人体多种器官的发育形成[1]。目前多项研究显示:FoxM1在肿瘤的发生发展中扮演着重要的角色[2]。硫链丝菌肽(thiostrepton,TST)是一种提取于链霉菌的天然的噻唑类抗生素,具有广谱的抗革兰阴性、阳性细菌的作用,在兽医中常用来治疗乳腺炎[3]。2008年首次作为FoxM1 的抑制剂及蛋白酶体的抑制剂用于乳腺癌的研究而受到大家关注[4]。近几年,发现TST在体内外具有显著的抗肿瘤作用,通过靶向作用于 FoxM1 蛋白及蛋白酶体而诱导卵巢癌、肺癌等多种肿瘤细胞发生凋亡[3, 5, 6],作为一种抗肿瘤的新药受到广泛研究。
本课题组前期研究发现:FoxM1在鼻咽癌组织较正常鼻咽部组织中呈现高表达状态[7];经TST作用人喉癌hep-2细胞后,FoxM1蛋白表达降低,促进细胞凋亡增加[8]。本实验旨在通过建立鼻咽癌CNE-2细胞的裸鼠皮下肿瘤模型,在体内观察TST对鼻咽癌的抑制作用并探讨其作用机制,为鼻咽癌分子靶向治疗提供实验基础。
1 材料与方法 1.1 材料 1.1.1 实验动物4周龄的雄性BALB/c裸鼠20只,体 质量为18~22 g,SPF 级,由中国医学科学院实验动物研究所繁育场提供[实验动物生产许可证号: SCHK(新) 2010-0005]。实验前在实验室常规饲养1周。
1.1.2 主要试剂TST购于购于德国 Merck 公司,用培养液配制成相应浓度溶液,过滤除菌,4 ℃ 保存。二甲基亚砜(DMSO)、苯甲基磺酰氟(PMSF)、RIPA裂解液、胰蛋白酶、EDTA 及 BCA 蛋白浓度测定试剂盒均购自上海碧云天生物技术有限公司。胎牛血清、青霉素、链霉素以及RIPA1640培养基均购自美国 HyClone 公司。倒置显微镜为日本 Olympus 公司产品。培养箱为美国 Thermo 公司产品。山羊抗兔二抗购于北京中杉公司,FOXM1抗体,Cyclin D1、Skp2、P27抗体、GAPDH多克隆抗体购于Santa Crus公司,Western blot 相关试剂套装购于北京碧云天生物技术公司,FITC-Annexin V凋亡检测试剂盒购于北京宝赛生物科技有限公司,ECL发光试剂盒购买于美国Milipore公司。
1.1.3 细胞株人鼻咽癌细胞株CNE-2购于上海中科院细胞所。
1.2方法 1.2.1 细胞培养CNE-2细胞储存于液氮中,取出复苏后,接种在含10%热灭活小牛血清的RPMI1640培养液(含青霉素、霉素各 100 U/mL)中,放置37 ℃,5%CO2饱和湿度孵箱内培养,细胞呈单层贴壁生长,待细胞生长至70%~80%时传代,用0.25%胰酶消化,按1瓶传3瓶的比例传代,2~3 d传1次。取长势良好的对数生长期细胞用于实验。
1.2.2 CNE-2细胞裸鼠移植瘤模型的建立参考文献报道的方法,用RPMI1640培养基培养人鼻咽癌CNE-2细胞,胰酶消化,PBS洗涤2次,1 200 g/min 离心3 min,收集肿瘤细胞,PBS液调整细胞密度至1×107/mL。裸鼠右肩背部皮下接种0.2 mL/只,约含 2×106 个CNE-2细胞的悬液。
1.2.3 分组及给药7~10 d后形成肿瘤,瘤体生长直径约0.1 cm,将成瘤裸鼠20只放于一起,10只裸鼠作为对照组,剩余的10只作为实验组,各组裸鼠均采用耳钉法标号;对照组每周腹腔注射0.2 mL DMSO溶液,实验组每周腹腔注射DMSO溶解的浓度为200 μg/kg TST溶液0.2 mL。
1.2.4 CNE-2细胞裸鼠移植瘤生长情况的测定自腹腔注射TST之日起,隔日观察裸鼠移植瘤的生长情况及裸鼠的身体状况,包括移植瘤部位有无红肿、破溃,裸鼠的活动及精神状况等。每次给药前均用游标卡尺分别测量每只裸鼠背部肿瘤的长径(L)和宽径(W)1次,计算肿瘤体积(V) [V=(L×W2)/2],并绘制肿瘤生长曲线。连续给药6周后,以颈椎脱臼法处死裸鼠,剥离肿瘤组织,称重,计算抑瘤率。抑瘤率(%)=(对照组平均瘤质量-TST药物组平均瘤质量)/对照组平均瘤质量×100%。
1.2.5 移植瘤中癌细胞周期变化情况的检测取新鲜肿瘤组织0.5~1.0 g经过剪碎,研磨,PBS液冲洗成单细胞入小烧杯内,再将细胞悬液用200目的尼龙网滤过,随后用75%乙醇4 ℃固定过夜,PBS清洗1次,加入RNaseA(50 μg/mL) 37 ℃温育30 min 后,离心后弃上清液,加10 μL PI(50 μg/mL)置于4 ℃避光孵育20 min。 放入流式细胞仪检测细胞凋亡和周期分布,检测细胞凋亡未行75%乙醇4 ℃固定过夜处理。
1.2.6 移植瘤组织中FoxM1蛋白及细胞周期相关蛋白P27、Cyclin D1及Skp2的检测新鲜瘤体经过匀浆机匀浆研磨后离心,弃去上清液,加入适量蛋白裂解液在4 ℃冰浴中裂解30 min后,其中每5 min吹打1次,裂解充分后置入低温离心机4 ℃,12 000×g离心15 min;收集细胞总蛋白;采用BCA 法测蛋白浓度,调整各组蛋白浓度一致后取蛋白,经SDS-PAGE凝胶电泳分离,切胶,转至PVDF 膜上,将膜以1% BSA室温封闭1 h,一抗(体积比1 ∶500稀释)室温孵育2 h,用抗兔FoxM1、P27、Cyclin D1、Skp2抗体(稀释600倍)
及GAPDH (稀释5 000倍) 4 ℃孵育过夜,TBST洗膜 3遍,每次5 min,HRP 标记山羊抗兔 IgG(稀释1 000倍) 室温孵育2 h,TBST洗涤3次,每次10 min;二抗(体积比1 ∶5 000稀释)室温孵育1 h,TBST洗涤2次,ECL显影在凝胶成像仪上成像。
采用SPSS 17.0 软件,各组数据以x±s表示,多个样本均数的两两比较采用方差分析。
2 结果 2.1 TST对裸鼠鼻咽癌移植瘤的生长抑制作用根据每周所测肿瘤体积绘制肿瘤生长曲线,共观察6周,与对照组相比,TST组对人鼻咽癌 CNE-2细胞裸鼠移植瘤生长具有明显的抑制作用,差别有统计 学意义(P < 0.05),见图 1。TST组瘤体质量为(0.582± 0.172)g,对照组瘤体质量为(1.118±0.159)g,TST组抑瘤率为47.94%,差别有统计学意义(F=31.4,P < 0.01)。
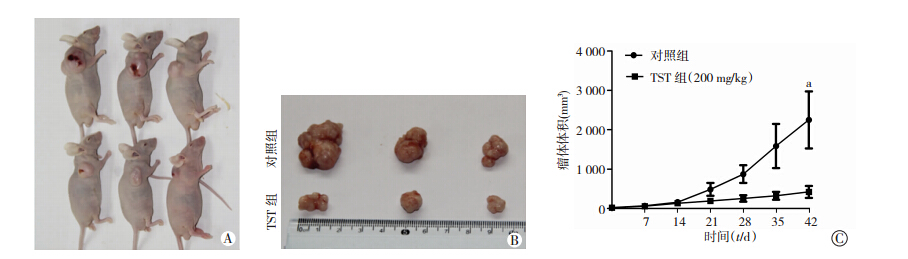 |
| A:成瘤裸鼠大体观察;B:裸鼠移植瘤大体观察;C:裸鼠移植瘤生长曲线分析;a: P < 0.05,与TST组比较 图 1 TST对人鼻咽癌 CNE-2细胞裸鼠移植瘤的影响 |
FCM 结果表明,对于瘤体中细胞的凋亡率,对照组为(6.12±0.95)%,TST组为(16.99±1.75)%,两组相比较差别有统计学意义(F=179.1,P < 0.01,图 2A、B)。对于肿瘤组织细胞G1期的细胞比例,对照组为(47.23±5.68)%,TST组为(66.44±3.65)%,两组相比较差异有统计学意义(F=48.6,P < 0.01,图 2C、D)。
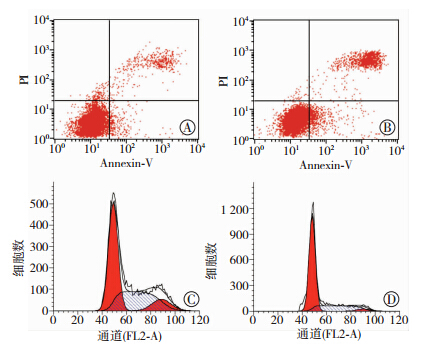 |
| A:对照组凋亡;B:药物组凋亡;C:对照组细胞周期;D:药物组细胞周期 图 2 流式细胞术检测TST对裸鼠移植瘤组织中细胞凋亡和周期的影响 |
Western blot 结果(图 3)显示:TST组与对照组相比,FoxM1蛋白Cyclin D1蛋白及Skp2蛋白表达下降,P27蛋白表达增加。
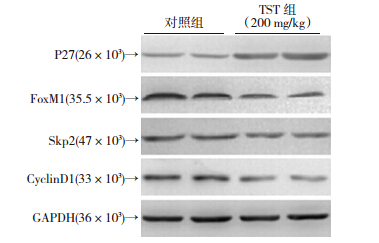 |
| 图 3 Western blot检测TST对裸鼠移植瘤组织蛋白表达的影响 |
研究发现,FoxM1在肿瘤发生、发展的早期即被上调,表达增加[6, 9]。FoxM1参与肿瘤的发生、发展主要是其参与了细胞周期的进展,从而影响了细胞的增殖,导致细胞凋亡的抑制[10, 11, 12]。细胞周期循环是细胞分裂增殖的基础,细胞周期变化受到种多因素的调控。FoxM1 在细胞静止期时表达较低,而在细胞增殖期高表达,并参与调节与细胞周期相关基因的表达,调控细胞有丝分裂。在细胞胶质瘤的研究中发现:在调节G1/S期的转变及DNA的复制中,FoxM1可以诱导因子CyclinA2、JNK1.ATF2、Skp2、Cks1以及Cdc25A磷酸酶的表达,从而调控细胞周期进程[13]。FoxM1在G1/S期、G2/S期转换及M期进展中发挥关键的调控作用。FoxM1 诱导Cdc25A在G1/S期检验点的表达、并且调控Skp2和Cks1的转录,Skp2和Cks1是Skp1/cullin/F-box蛋白复合物的亚单位,该复合物能够促进周期抑制蛋白p21 Cip1和p27 Kip 的泛素化降解,从而调节细胞周期[14]。在胃癌的研究中沉默FoxM1基因,能通过与p27Kip1基因相互作用加速肿瘤细胞衰老,遏制细胞增殖加速细胞凋亡发生[15]。本实验通过对裸鼠移植瘤瘤体组织提取蛋白进行Western blot检测,发现:TST药物组FoxM1蛋白表达降低,凋亡相关蛋白Cyclin D1,Skp2表达降低,P27蛋白表达增加。这表明TST能抑制FoxM1的表达,同时能影响细胞周期凋亡相关蛋白的表达变化;这也进一步证实了FoxM1在细胞周期调节中的重要作用。
目前,临床常用的化疗药物在治疗肿瘤时毒副作用很大,患者常常难以耐受。因此,有必要寻找开发新的毒副作用小的药物来用于肿瘤的治疗。TST是从青链霉菌中分离得到,被证实可以抑制多种癌细胞的增殖,但其作用的分子机制尚不明确[3]。在研究乳腺癌时报导,Thiostrepton 除了能通过靶向抑制FoxM1蛋白表达抑制乳腺癌细胞的增殖外[4],还发现它能增强对顺铂耐药的乳腺癌细胞重新产生对顺铂的敏感性[16];同时Thiostrepton与蛋白酶抑制剂 Bortezomib联合作用于三阴乳腺癌细胞后能产生显著的协同效应[17]。在B细胞淋巴瘤的研究中,发现Thiostrepton 通过靶向作用FoxM1后诱导B细胞淋巴瘤的凋亡发生并能同时抑制其转移[18]。在其它肿瘤中的研究发现:Thiostrepton 对恶性黑色素瘤细胞有显著的抗肿瘤活性,而对良性的黑色素细胞产生的抑制作用不明显[19]。在间皮瘤中,Thiostrepton通过靶向作用Peroxiredoxin 3诱导肿瘤细胞发生凋亡[20]。
本实验建立了鼻咽癌裸鼠皮下移植瘤模型,通过分为对照组和TST药物作用组,比较两组移植瘤生长过程中体积变化及最终瘤体质量,绘制肿瘤生长曲线,算出抑瘤率,发现TST药物作用组肿瘤生长受到抑制,最终瘤体平均质量小于对照组,差别有统计学意义。肿瘤生长6周后将裸鼠处死,剥离瘤体部分制成单细胞悬液,进行流式细胞学检测细胞凋亡及细胞周期,结果表明,TST药物组细胞处于G1期的比例明显高于对照组,表明TST作用于肿瘤后,细胞分裂受到抑制,更多的将细胞阻滞于G1期;同时FCM检测凋亡发现,TST药物组瘤体中细胞的凋亡率高于对照组,TST作用瘤体后肿瘤中细胞凋亡增加,这二者共同导致TST药物组瘤体生长减缓,质量减轻。
综上所述,TST能使移植瘤组织中 FoxM1的表达明显降低,且能抑制人鼻咽癌CNE-2细胞裸鼠移植瘤的生长,因此FoxM1有可能成为鼻咽癌治疗的新靶点,其抑制剂TST具有较大的临床应用前景。
| [1] | Laoukili J, Stahl M, Medema R H. FoxM1: at the crossroads of ageing and cancer[J]. Biochim Biophys Acta, 2007, 1775(1): 92-102. |
| [2] | Wang Z, Ahmad A, Li Y, et al. Forkhead box M1 transcription factor: a novel target for cancer therapy[J]. Cancer Treat Rev, 2010, 36(2): 151-156. |
| [3] | Bhat U G, Halasi M, Gartel A L. Thiazole antibiotics target FoxM1 and induce apoptosis in human cancer cells[J]. PLoS One, 2009, 4(5): e5592. |
| [4] | Kwok J M, Myatt S S, Marson C M, et al. Thiostrepton selectively targets breast cancer cells through inhibition of forkhead box M1 expression[J]. Mol Cancer Ther, 2008, 7(7): 2022-2032. |
| [5] | Chan D W, Hui W W, Cai P C, et al. Targeting GRB7/ERK/FOXM1 signaling pathway impairs aggressiveness of ovarian cancer cells[J]. PLoS One, 2012, 7(12): e52578. |
| [6] | Wang Y, Wen L, Zhao S H, et al. FoxM1 expression is significantly associated with cisplatin-based chemotherapy resistance and poor prognosis in advanced non-small cell lung cancer patients[J]. Lung Cancer, 2013, 79(2): 173-179. |
| [7] | 江黎珠, 王棚, 陈鸿雁. FoxM1和COX-2在鼻咽癌组织中的表达及临床意义[J]. 第二军医大学学报, 2013, 34(6): 645-649. |
| [8] | 林力, 邓碧, 寿铸, 等. 硫链丝菌肽对人喉癌 Hep-2 细胞生长及 FoxM1 表达的影响[J].第三军医大学学报, 2012, 34(10): 2086-2089. |
| [9] | Halasi M, Gatrel A L. Targeting FOXM1 in cancer[J]. Biochem Pharmacol, 2013, 85(5): 644-652. |
| [10] | Penzo M, Massa P E, Olivotto E, et al. Sustained NF-kappaB activation produces a short-term cell proliferation block in conjunction with repressing effectors of cell cycle progression controlled by E2F or FoxM1[J]. J Cell Physiol, 2009, 218(1): 215-227. |
| [11] | Tan Y, Raychaudhuri P, Costa R H. Chk2 mediates stabilization of the FoxM1 transcription factor to stimulate expression of DNA repair genes[J]. Mol Cell Biol, 2007, 27(3): 1007-1016. |
| [12] | Li S K, Smith D K, Leung W Y, et al. FoxM1c counteracts oxidative stress-induced senescence and stimulates Bmi-1 expression[J]. J Biol Chem, 2008, 283(24): 16545-16553. |
| [13] | Zhang Y, Zhang N, Dai B, et al. FoxM1B transcriptionally regulates vascular endothelial growth factor expression and promotes the angiogesis and growth of glioma cells [J]. Cancer Res, 2008, 68(21): 8733-8742. |
| [14] | Wang I C, Chen Y J, Hughes D, et al. Forkhead box M1 regulates the transcriptional network of genes essential for mitotic progression and genes encoding the SCF (Skp2-Cks1) ubiquitin ligase[J]. Mol Cell Biol, 2005, 25(24): 10875-10894. |
| [15] | Zeng J, Wang L, Li Q, et al. FoxM1 is up-regulated in gastric cancer and its inhibition leads to cellular senescence, partially dependent on p27 kip1[J]. J Pathol, 2009, 218(4): 419-427. |
| [16] | Kwok J M, Peck B, Monteiro L J, et al. FOXM1 confers acquired cisplatin resistance in breast cancer cells[J].Mol Cancer Res,2010,8(1): 24-34. |
| [17] | Wang M, Gartel A L. Combination with bortezomib enhances the antitumor effects of nanoparticle-encapsulated thiostrepton[J].Cancer Biol Ther,2012, 13(3): 184-189. |
| [18] | Uddin S, Hussain A R, Ahmed M, et al. Overexpression of FoxM1 offers a promising therapeutic target in diffuse large B-cell lymphoma[J]. Haematologica, 2012, 97(7): 1092-1100. |
| [19] | Qiao S, Lamore S D, Cabello C M, et al. Thiostrepton is an inducer of oxidative and proteotoxic stress that impairs viability of human melanoma cells but not primary melanocytes[J]. Biochem Pharmacol, 2012, 83(9): 1229-1240. |
| [20] | Newick K, Cunniff B, Preston K, et al. Peroxiredoxin 3 is a redox-dependent target of thiostrepton in malignant mesothelioma cells[J]. PLoS One, 2012, 7(6): e39404. |



