尿苷二磷酸葡萄糖醛酸基转移酶1A家族(UDP-glucuronosyltransferase 1 family As,UGT1As)为体内催化底物葡糖醛酸化的一类Ⅱ相代谢酶,编码基因位 于人类常染色体2q37上,包含2~5个共用外显子和13个 独立外显子,外显子1~13分别与共用外显子2~5组成 UGT1A1、UGT1A2 等13个独立编码基因[1],翻译合成8种UGT1As蛋白酶。前期我们对本院门诊以血清非结合胆红素升高为主要表现的患者进行 UGT1A1 基因筛查。发现1例CN-Ⅱ 综合征患者仅携带 c.1091C>T纯合突变,突变点位于 UGT1A1 基因外显子4上,导致UGT1A1酶的第364位的脯氨酸被亮氨 酸(P364L)替代。由于该突变点位于共用外显子4上,除UGT1A1酶外对其他UGT1As酶家族均有影响,体内外许多物质经UGT1As酶代谢,P364L突变对物质代谢影响广泛。UGT1A1酶是目前为止发现的人体内唯一能催化非结合胆红素代谢的酶,因此P364L突变对UGT1A1催化非结合胆红素影响尤其明显。故本实验构建UGT1A1-P364L突变酶,研究其对非结合胆红素代谢的影响。
1 材料与方法 1.1 仪器超声破碎仪(Misonix Sonicators Q700)、高效液相色谱仪(LC-2010AHT)、高速冷冻离心机(Legend Micro 21R)、纯净水净化系统(Milli-Q3)、全波长酶标仪 (Multiskan Spectrun)、精密电子天平(BSA224S-CW)、核酸浓度测定仪(Nanodrop 2000 Spectrophotometer)、恒温振荡器(THZ-C-1)、凝胶成像仪(ChemiDoc XRS)。
1.2 材料尿苷二磷酸葡萄糖醛酸(uridine diphosphateglucuronic acid,UDPGA)、非结合胆红素、胆红素HPLC标准品、氯化镁(源叶生物);抗坏血酸、pH 7.4的100 mol/L 的Tris-HCl缓冲液(Solarbio);丙甲菌素、二甲基亚砜、甲醇(Sigma);高糖细胞培养基、胰酶(HyClone);胎牛血清(四季青);Lipofectamine 2000(Invitrogen);OPTI-MEM(Gibco);人UGT1A1抗体(Ab170858,Abcam);GAPDH抗体(碧云天);蛋白酶抑制剂混合物、SDS-PAGE凝胶制备试剂盒(康为世纪);HEK293细胞(百恩维生物);小量质粒抽提试剂盒(Plasmid Mini Kit Ⅰ,Omega)。
1.3 方法 1.3.1 构建含有目的基因的表达质粒野生型和突变型质粒均购自GeneCopoeia公司(产品ID S0207)。选用哺乳动物质粒pEZ-M03作为载体,于质粒开放阅读框中插入人类UGT1A1表达序列(NM_000463.2),总长1 602 bp。野生型质粒与突变型质粒的区别在于外显子4上第1 091个碱基由C突变为T。
1.3.2 质粒转化感受态细胞提取质粒测序50 μg质粒加入100 μL感受态细胞中,置于冰上30 min,42 ℃ 水浴热激90 s,冰上冷却2 min后加入42 ℃预热的LB 900 μL,于37 ℃摇床150 r/min培养1 h。感受态细胞均匀涂抹到含氨苄西林的LB平板上,37 ℃培养。挑取菌落用LB培养基培养,Plasmid Mini Kit Ⅰ提取质粒。送华大基因公司测序。
1.3.3 质粒转染HEK293细胞提取蛋白HEK293细胞接种于6孔板上,当细胞融合度达80%时,换用OPTI-MEM无血清培养基,将质粒与Lipofectamine 2000按4 μg ∶6 μL的比例加入培养基中,5 h后换为无双抗的含10%胎牛血清高糖培养基。继续培养48 h 后,刮取细胞。超声仪破碎细胞,12 000×g离心5 min,留取上清。
1.3.4 蛋白质免疫印迹表达有野生型与突变型蛋白的细胞均浆分别取30 μg,加入SDS-PAGE胶中,电泳分离,转膜后按UGT1A1抗体(Ab170858,abcam)1 ∶1 000稀释后孵育,以山羊抗兔辣根过氧化物酶IgG(1 ∶500)作为二抗孵育。Western Bright ECL(Advansta)显色,凝胶成像仪观察结果。
1.3.5 非结合胆红素葡糖醛酸化的催化条件缓冲液pH 7.4的100 mmol/L Tris-HCl,总反应体系200 μL,包括HEK293细胞均浆100 μg,MgCl2 4 mmol/L,UDPGA 5 mmol/L,丙甲菌素50 μg/mg 蛋白,二甲基亚砜(DMSO)溶解的非结合胆红素(DMSO占总体积的1%),37 ℃反应。最后加入200 μL含2%(质量体积比)抗坏血酸的冰甲醇终止反应。18 000×g离心后将上清注入高效液相色谱仪分析。
1.3.6 高效液相色谱条件流动相由pH 4.85的0.1 mol/L的醋酸铵和27.5%乙腈组成,两者比例72.5 ∶27.5(体积比),流速:1.0 mL/min,17 min后将乙腈比例增加到43.3%,2 min后再次增加到79%,将 此比例保持7 min后降到初始比例。检测波长为453 nm。
1.4 统计学分析采用Stata软件进行Chow检验,比较野生型与突变型两组非结合胆红素浓度随时间变化的差异。
2 结果 2.1 质粒测序结果测序由华大基因公司进行,使用pEZ-M03质粒测 序通用引物(正向引物5′-GCGGTAGGCGTGTACGGT-3′,反向引物5′-CCGGACACGCTGAACTTGT-3′)测序。对比野生型质粒和突变型质粒测序结果,所测野生型质粒序列段的第634位碱基为鸟嘌呤(G),而突变质粒为腺嘌呤(A),其余碱基完全一致。正反向拼接质粒测序结果,在NCBI网站上与人类 UGT1A1 基因比对(NM_000463.2),发现在野生型质粒中插入的长1 062 bp 的开放阅读框与人类 UGT1A1 基因外显子序列完全一致。人类 UGT1A1 序列的第1 091个外显子位置对应质粒正向测序结果的第634个碱基位置,在此位置人类 UGT1A1 序列反义链的第1 091为G,而突变型的第634个碱基为A,对应突变质粒及 UGT1A1 的正义链即为突变型外显子4上第1 091个碱基由C突变为T(图 1)。
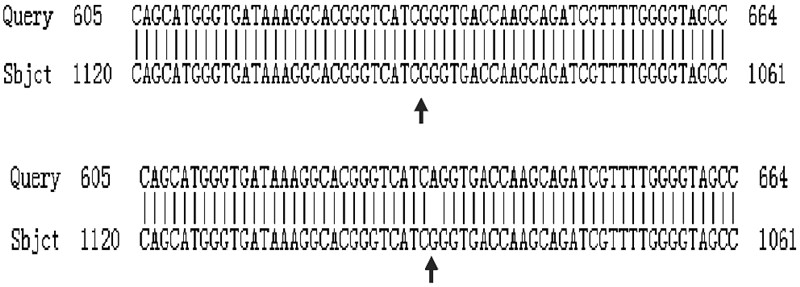 |
| A:野生型质粒插入碱基与人类 UGT1A1 基因(NM_000463.2)对比结果; B:突变型质粒插入碱基与人类 UGT1A1 基因(NM_000463.2)对比结果 Query:质粒测序结果;Sbjct:人类 UGT1A1 基因序列;箭头示定点突变位点 图 1 插入人类 UGT1A1 基因开放阅读框的野生型质粒以及突变型质粒测序结果 |
Western blot检测发现UGT1A1野生型和P364L突变型质粒转染的HEK293细胞中均有UGT1A1酶的表达,表达的蛋白相对分子质量在55×103左右 (图 2)。
 |
| 1:UGT1A1野生型;2:P364L图 2 Western blot检测野生型和突变型质粒转染HEK293 细胞48 h后蛋白的表达 |
配制非结合胆红素浓度0.312 55、0.625 5、1.255、2.55、5 μg/mL,分别取30 μL加入色谱仪,按色谱条件进行分析。以非结合胆红素峰面积(X)作为横轴,非结合胆红素浓度(Y,μg/mL)作为纵轴,进行线性回归分析,非结合胆红素在0.312 5~5 μg/mL浓度范围内线性关系良好。回归方程为:y=0.057 1x+0.101 1,r2=0.994 6。
2.4 非结合胆红素催化反应结果设计2个对照组:一组为反应体系中含非结合胆红素而无UDPGA的对照,HPLC分析结果仅可见非结合胆红素洗脱峰(图 3A);另一组为有UDPGA而无非结合胆红素的对照,HPLC分析结果无任何洗脱峰(图 3B)。图 3C为在酶的催化下非结合胆红素与UDPGA 反应后的色谱图,如箭头示在7~8 min时观察到结合胆红素洗脱峰。
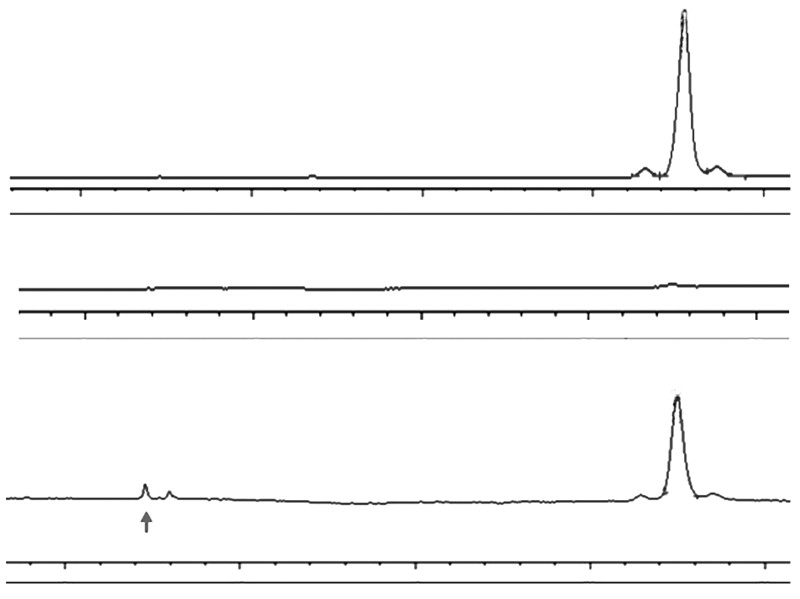 |
| A:含非结合胆红素无UDPGA对照;B:有UDPGA无非结合胆红素对照; C:酶催化下非结合胆红素与UDPGA反应后结果 图 3 HPLC色谱分析非结合胆红素催化反应变化 |
100 μg含UGT1A1野生型、突变型蛋白的HEK293 细胞匀浆分别催化非结合胆红素反应,野生型与突变型反应体系中非结合胆红素的浓度均随时间增加而呈下降趋势,但野生型催化体系中非结合胆红素浓度较突变型体系下降明显(表 1)。Chow检验比较野生型与突变型两组非结合胆红素浓度随时间变化的差异,似然比LR=36.05,两组线性回归模型具有显著差异(P<0.05),说明突变酶UGT1A1-P364L催化非结合胆红素能力较野生型明显降低。计算单位时间内在单位酶量催化下被转化的非结合胆红素的量,即酶活性。取反应30 min时非结合胆红素浓度计算,野生型为 271.03 pmol/(min·mg),P364L突变型为38.42 pmol/(min·mg),因此反应30 min时P364L突变酶活性仅为野生型的14.2%。
| 时间(min) | 野生型>浓度(μg/mL) | 突变型浓度(μg/mL) |
| 0 | 5.847 | 2.000 |
| 10 | 5.092 | 1.986 |
| 30 | 3.470 | 1.663 |
UGT1As 基因存在普遍的多态性,大量研究证实一些多态性与疾病的发生、药物代谢的异常相关,甚至会增加患癌的风险[1]。 UGT1A1 作为 UGT1As 中的一员,同样具有基因多态性,这种多态性形成了先天性高胆红素血症如Gilbert综合征、CN-Ⅰ综合征和CN-Ⅱ综合征的发病机制。2004年Takeuchi[2]对遗传性高胆红素血症的患者进行 UGT1A1 基因筛查,首次发现了P364L突变,该患者表现为Gilbert综合征,为杂合突变。Mimura等[3]研究了日本人中P364L的等位基因频率为0.0053,而本课题组在前期研究发现其等位基因频率为0.033[4],可见P364L突变在人群中并不罕见,且P364L突变位于UGT1As的共用外显子4上,不仅影响UGT1A1酶催化的非结合胆红素、雌二醇的代谢,也影响到由UGT1As酶家族催化的其他物质,尤其是临床一些常用药物的代谢如丙咪嗪、速尿、瑞替加滨、拉莫三嗪等[5, 6, 7],因此进行P364L突变酶的功能研究具有重要的临床意义。
本研究前期临床筛查发现1例携带P364L纯合突变患者,临床表型为CN-Ⅱ综合征,是目前为止发现的首例因P364L突变致CN-Ⅱ综合征的病例,理论上讲CN-Ⅱ综合征患者体内酶活性应在野生型的30%以下[8]。本研究发现P364L突变酶催化胆红素的活性仅为野生型的14.2%,低于Takeuchi[2]的研究结果(P364L催化非结合胆红素活性较野生型下降35.6%),本研究结果更符合CN-Ⅱ综合征患者中UGT1A1酶活性的下降特点,也与患者的临床表型相适应。Takeuchi等[2]的研究中选择非人源性的COS7细胞作为转染细胞,而本研究中选择人源性的HEK293细胞,这种转染细胞的选择差异可能导致酶活性的检测结果不同,但本研究选择的HEK293细胞更为合理,更接近体内UGT1A1蛋白的表达。
在研究方法上,本实验较以往酶活性的研究不同。由于非结合胆红素与结合胆红素化学性质均不稳定,结合胆红素见光更易分解,整个实验过程需在避光的条件下进行。这种不稳定性使市面上无可售的结合胆红素标准品,实验不能直接对生成的结合胆红素进行定量,催化非结合胆红素生成结合胆红素的实验存在一定难度,国内尚无人研究UGT1A1及其变异体对非结合胆红素的催化作用。非结合胆红素与结合胆红素在同一波长453 nm处有相同的消光系数[9],比较本实验的无UDPGA对照组和实验组可确定在453 nm波长处7~8 min时实验组观察到的新出现的洗脱峰为结合胆红素。本实验中我们用非结合胆红素的减少量来计算反应速度,虽与常用的产物增加计算方法不同,但在一个反应中底物的消耗与产物的增加呈正相关,故这种方法仍具有可行性。不足之处在于测量底物消耗不如测量产物增加灵敏,因为产物在整个反应中为新生物质,生成量的变化更容易被观察到,而底物在整个环境中大量存在,若减少量较小时不容易被观察到。故为进一步提高实验的准确性,需克服结合胆红素不稳定的困难,尽量合成稳定的结合胆红素标准品或找到代替物。
既往研究发现P364L突变酶对雌二醇、对乙酰氨基酚的催化活性下降[3],而本研究也发现P364L突变酶对非结合胆红素的催化活性明显下降。推测UGT1A1的第364个氨基酸脯氨酸在构成蛋白空间结 构及功能发挥上起着重要作用。Xing等[10]对UGT1A6 空间结构研究发现羧基端的P363L(相当于UGT1A1的P364L)突变,破坏了Miley等[11]推测的葡萄糖醛酸基转移酶共有的重要的配体结合区域的空间构 象,削弱UGT1A6的尿苷二碱酸葡萄糖醛酸基结合位点对底物的亲和力。 UGT1A1 基因的2~5个外显子为UGT1As家族共用,即UGT1A1蛋白的第289~533个氨基酸为UGT1As酶家族共有,UGT1As 酶羧基端在空间构象上 相似,因此理论上讲UGT1A6-P363L与UGT1A1-P364L 突变酶催化活性的下降有着相似的机制。酶Km值是反应酶对底物亲和力的直接指标,为进一步证明P364L突变对UGT1A1酶在蛋白空间结构及催化功能上的重要性,下一步还应继续研究UGT1A1-P364L突变酶与野生型UGT1A1酶的Km值差异。
总的来说,P364L是UGT1A1酶上的重要突变点,携带P364L突变的患者UGT1A1酶的催化活性降低,导致一些内源性和外源性有毒物质在体内蓄积,加大了药物的副作用和人体的患癌几率。P364L突变对人体健康危害较大,既往对于P364L的研究较少,故除研究突变酶UGT1A1-P364L催化非结合胆红素的活性外,对其他重要底物的葡糖醛酸化的影响具有进一步研究的价值。
| [1] | Tukey R H, Strassburg C P. Human UDP-glucuronosyltransferases: metabolism, expression, and disease[J]. Annu Rev Pharmacol Toxicol, 2000, 40: 581-616. |
| [2] | Takeuchi K, Kobayashi Y, Tamaki S, et al. Genetic polymorphisms of bilirubin uridine diphosphate-glucuronosyltransferase gene in Japanese patients with Crigler-Najjar syndrome or Gilbert’s syndrome as well as in healthy Japanese subjects[J]. J Gastroenterol Hepatol, 2004, 19(9): 1023-1028. |
| [3] | Mimura Y, Maruo Y, Ohta Y, et al. Effect of common exon variant (p.P364L) on drug glucuronidation by the human UDP-glucuronosyltransferase 1 family[J]. Basic Clin Pharmacol Toxicol, 2011, 109(6): 486-493. |
| [4] | 李露锋, 邓国宏, 谭文婷, 等. 8个Gilbert综合征家系UGT1A1变异谱调查及分析[J]. 第三军医大学学报, 2014, 36(23): 2408-2412. |
| [5] | Lee S J, Park J B, Kim D, et al. In vitro selective inhibition of human UDP-glucuronosyltransferase (UGT) 1A4 by finasteride, and prediction of in vivo drug drug interactions[J]. Toxicol Lett, 2015, 232(2): 458-465. |
| [6] | Korprasertthaworn P, Rowland A, Lewis B C, et al. Effects of amino acid substitutions at positions 33 and 37 on UDP-glucuronosyltransferase 1A9 (UGT1A9) activity and substrate selectivity[J]. Biochem Pharmacol, 2012, 84(11): 1511-1521. |
| [7] | Reimers A, Sjursen W, Helde G, et al. Frequencies of UGT1A4*2 (P24T) and *3 (L48V) and their effects on serum concentrations of lamotrigine[J]. Eur J Drug Metab Pharmacokinet, 2014, [Epub ahead of print]. |
| [8] | Bosma P J, Goldhoorn B, Oude-Elferink R P, et al. A mutation in bilirubin uridine 5′-diphosphate-glucuronosyltransferase isoform 1 causing Crigler-Najjar syndrome type II[J]. Gastroenterology, 1993, 105(1): 216-220. |
| [9] | Bhutani V K, Gourley G R, Adler S, et al. Noninvasive measurement of total serum bilirubin in a multiracial predischarge newborn population to assess the risk of severe hyperbilirubinemia[J]. Pediatrics, 2000, 106(2): E17. |
| [10] | Xing Y, Yang L, Wang L, et al. Systematic screening for polymorphisms within the UGT1A6 gene in three Chinese populations and function prediction through structural modeling[J]. Pharmacogenomics, 2009, 10(5): 741-752. |
| [11] | Miley M J, Zielinska A K, Keenan J E, et al. Crystal structure of the cofactor-binding domain of the human phase II drug-metabolism enzyme UDP-glucuronosyltransferase 2B7[J]. J Mol Biol, 2007, 369(2): 498-511. |



