2 400010 重庆,重庆医科大学附属第二医院:感染科;
3 401331 重庆,重庆医科大学附属大学城医院神经内科
2 Department of Infectious Diseases, the Second Affiliated Hospital of Chongqing Medical University, Chongqing, 400010;
3 Department of Neurology, the University City Hospital of Chongqing Medical University, Chongqing, 401331, China
皮质发育障碍是引起癫痫的一个重要原因,它主要发生在儿童阶段[1, 2]。皮质发育障碍性癫痫的显著特点是药物治疗效果欠佳,其中15%~53%的儿童即为药物难治性癫痫。因此,探索儿童皮质发育障碍性癫痫的分子及病理机制,可以帮助更好地诊断及治疗该病。
近几年,比较蛋白组学的发展给许多疾病在蛋白质水平开展研究带来了希望[3, 4]。2004年,iTRAQ技术被美国应用生物系统公司推出,它具有高通量、高灵敏的特点,可同时对相同实验下的8个样品进行质谱鉴定。本研究运用iTRAQ与2D-LC-MS/MS相结合的方法,鉴定儿童皮质发育障碍性癫痫中差异表达的蛋白。结合生物信息学分析、实时定量PCR和Western blot法验证,筛选出与儿童皮质发育障碍性癫痫相关的重要蛋白质,从而为儿童皮质发育障碍性癫痫的诊断及治疗开辟新思路,提供新线索。
1 材料与方法 1.1 试剂与标本实验试剂:蛋白浓度测量试剂盒购自Bradford公司;胰蛋白酶购自Proega公司;低温离心机购自Beckman公司;iTRAQ试剂盒以及ProteinPilot软件购自ABI公司;TRIzol试剂购自Invitrogen公司;PCR试剂盒购自TaKaRa公司;PCR相关引物购自Origene公司;Western blot相关抗体购自Abcam公司。
组织来源:儿童脑组织标本均由重庆医科大学附属第二医院提供,标本的采集得到了该院伦理委员会的批准和患者家属的同意。其中23例儿童皮质发育障碍性癫痫脑组织为手术后标本(11名女性,12名男性),年龄(6.96±3.70)岁。23例儿童正常脑组织(对照组)为儿童脑外伤后因颅内手术所切除的正常标本(8名女性,15名男性),既往无癫痫及神经系统疾病史,年龄(7.22±3.10)岁。2组均为汉族,在性别构成及年龄方面差异无统计学意义(P>0.05)。取其中8例儿童皮质发育障碍性癫痫脑组织及8例儿童正常脑组织参与iTRAQ试剂标记,剩余脑组织样本参与实时定量PCR及Western blot实验。
1.2 蛋白样品的制备及iTRAQ试剂标记样本8例儿童皮质发育障碍性癫痫脑组织蛋白及8例儿童正常脑组织蛋白分别用iTRAQ裂解液提取,然后蛋白质分别混合后分成2组,进行iTRAQ特异性标记。首先,在200 μg蛋白质样品中加入2 μL还原剂,离心后在37 ℃放置1 h。第二步,加入1 μL半胱氨酸阻断剂,室温放置10 min,最后加入4 μg胰蛋白酶到样品中,37 ℃过夜。用异丙醇溶解的iTRAQ试剂分别加入到对应的蛋白质中,室温放置2~3 h[5]。最终,儿童皮质发育障碍性癫痫脑组织被成功标记为118和121,儿童正常脑组织被成功标记为117和119。
1.3 肽段分离第一维强阳离子柱(SCX)分离:把冻干标记后的样品溶解到80 μL A液(含25%ACN和10 mmol/L KH2PO4,pH=2.6)然后上样,B液含25% ACN、10 mmol/L KH2 PO4和350 mmol/L KCl,pH=2.6。设定214 nm/280 nm为紫外检测波长,200 μL/min为其 流速,梯度为60 min。其程序设定为:5~40 min,5% ~ 25%B;40~45 min,25%~80%B;45~50 min,80%B;50~51 min,80%~0 B;51~60 min,停止。根据时间和峰型一共收入20个梯度,在真空离心浓缩后,然后用50 μL RPLC A液(5%ACN,0.1%甲酸)溶解,进行第二维分析。
第二维反相液质联用RPLC-MS:A液含5%ACN和0.1%甲酸,B液含95%ACN和0.1%甲酸,流速为300 nL/min,设定RPLC柱线性梯度洗脱程序为:0~5 min,上样;5~90 min,5%~35% B;90~95 min,35%~80% B;95~100 min,80% B;100~105 min,80%~5% B;120 min,停止[6]。
质谱扫描的范围从400~1 800 u,MS/MS扫描范围从100~2 000 u,IDA采集模式是一个图谱选择4个最强的母离子进行串级扫描。
1.4 数据检索运用ProteinPilot软件实现蛋白质检索,数据库选用国际蛋白质指数(IPI)人类数据库v3.87,其他搜索与以前iTRAQ实验研究所用的数据库相同[7]。
1.5 质谱及生物信息学分析根据同位素报告基团的相对含量进行数据分析,118 ∶117和121 ∶119 中的P<0.05表示有统计学意义。为使其技术变化范围<30%,我们设定118 ∶117和121 ∶119>1.3或者<0.77用来划分蛋白质表达的上升或者下降[8, 9, 10]。生物信息学分析是通 过PANTHER网站(http://pantherdb.org/)对所获得差异表达蛋白进行分子功能分析,通过STRING网站(http://string-db.org/)检索差异蛋白的相互作用。
1.6 实时定量PCR验证mRNA表达水平每60毫克脑组织中加入1 mL TRIzol试剂提取RNA。 取2 μg RNA 通过A3500逆转录仪器(购自Promega公司)使其反转录为cDNA。按照SYBR Premix Ex TaqTMⅡ试剂盒说明书,以cDNA为基础通过ABI 7500 Real-Time PCR仪对目的引物进行PCR扩增。引物的名称分别是蛋白质功能相互作用网状图发现的转铁蛋白(transferrin,TF)、载脂蛋白A1(apolipoprotein A1,APOA1)、α2-巨球蛋白(alpha-2-macroglobulin,A2M)、三磷酸腺苷酶(ATPase,ATP6V1A)、波形蛋白(vimentin,VIM),以GADPH为内参。运用2-△△Ct方法分析基因表达的相对定量,实验重复至少3次。
1.7 Western blot验证蛋白质表达水平运用蛋白质裂解液提取脑组织中蛋白质,BCA方法测得蛋白质浓度。分别于对应孔中加入40 μg蛋白进行10%SDS-PAGE电泳分离,运用半干转方法把分离的蛋白质转至PVDF膜上。4%明胶室温封闭1 h后,加入TF抗体 (1 ∶10 000稀释)、APOA1抗体(1 ∶500 稀释)、A2M 抗体(1 ∶2 000稀释)、ATP6V1A 抗体(1 ∶10 000稀释)、VIM抗体(1 ∶500稀释)于4 ℃过夜,TBST洗3次后,加入辣根过氧化物酶标记的鼠二抗(1 ∶5 000)室温放置1 h,ECL发光显影。Quantity One软件分析目的条带的灰度值。实验至少重复3次。
1.8 统计学分析采用SPSS 10.0统计软件,计量数据用x±s表示,2组数据之间的比较行独立样本t检验。
2 结果 2.1 iTRAQ核素标记分组及质谱分析儿童皮质发育障碍性癫痫脑组织标记为118,儿童正常脑组织117,为减少误差,重复标记了儿童皮质发育障碍性癫痫脑组织为121,儿童正常脑组织为119。118 ∶117,121 ∶119代表某一种蛋白在儿童皮质发育障碍性癫痫脑组织与儿童正常脑组织中的比值。所测得蛋白质中,118 ∶117和121 ∶119大于1.3的共有64种(P<0.05),这64种差异蛋白在儿童皮质发育障碍性癫痫中的表达是上调(表 1)。另外,118 ∶117和121 ∶119小于0.77的共有89种蛋白质(P<0.05),这89种差异蛋白在儿童皮质发育障碍性癫痫中的表达是下调(表 2)。
| 编号 | 蛋白质 | 118∶117 | P值 | 121∶119 | P值 | 编号 | 蛋白质 | 118∶117 | P值 | 121∶119 | P值 |
| 1 | BCAN | 1.432 | 0.010 | 1.306 | 0.022 | 33 | ARHGEF2 | 2.070 | 0.003 | 1.977 | 0.009 |
| 2 | CNP | 1.393 | 0.002 | 1.318 | 0.003 | 34 | FSCN1 | 2.270 | <0.01 | 1.977 | 0.001 |
| 3 | NCAN | 1.675 | <0.01 | 1.330 | 0.015 | 35 | IDH1 | 2.070 | 0.039 | 2.051 | 0.033 |
| 4 | CAT | 1.644 | 0.007 | 1.380 | 0.049 | 36 | HSPA2 | 2.070 | 0.004 | 2.070 | 0.007 |
| 5 | NEFH | 1.614 | <0.01 | 1.445 | 0.006 | 37 | MYO1D | 2.291 | 0.013 | 2.070 | 0.042 |
| 6 | VCP | 2.965 | <0.01 | 1.459 | 0.012 | 38 | AHNAK2 | 2.089 | 0.004 | 2.089 | 0.003 |
| 7 | GDA | 1.472 | 0.009 | 1.472 | 0.012 | 39 | SRCTIN1 | 2.128 | <0.01 | 2.089 | 0.002 |
| 8 | RUFY3 | 1.445 | 0.009 | 1.486 | 0.002 | 40 | ENPP6 | 2.312 | 0.001 | 2.109 | 0.001 |
| 9 | PADI2 | 1.459 | 0.044 | 1.486 | 0.021 | 41 | PPP1R14A | 2.606 | 0.025 | 2.148 | 0.038 |
| 10 | SLC8A2 | 1.514 | 0.007 | 1.486 | 0.008 | 42 | PGM2L1 | 1.803 | 0.003 | 2.188 | <0.01 |
| 11 | GPD2 | 1.600 | 0.009 | 1.486 | 0.014 | 43 | TF | 2.270 | <0.01 | 2.249 | <0.01 |
| 12 | CACNA2D1 | 1.675 | <0.01 | 1.486 | 0.002 | 44 | KIAA1598 | 2.312 | 0.003 | 2.249 | 0.003 |
| 13 | AKAP12 | 1.600 | 0.006 | 1.500 | 0.015 | 45 | CPNE6 | 2.399 | <0.01 | 2.270 | 0.001 |
| 14 | BAIAP2 | 1.614 | 0.021 | 1.528 | 0.030 | 46 | CRMP1 | 2.630 | <0.01 | 2.489 | <0.01 |
| 15 | CLASP2 | 1.754 | 0.026 | 1.585 | 0.030 | 47 | GPD1 | 2.805 | 0.018 | 2.489 | 0.031 |
| 16 | BIN1 | 1.803 | <0.01 | 1.585 | 0.002 | 48 | FGB | 2.630 | <0.01 | 2.559 | <0.01 |
| 17 | OLA1 | 2.109 | 0.002 | 1.614 | 0.025 | 49 | ANLN | 2.754 | 0.006 | 2.582 | 0.007 |
| 18 | CA2 | 1.871 | 0.013 | 1.629 | 0.048 | 50 | ERMN | 2.729 | 0.001 | 2.704 | 0.002 |
| 19 | RTN4 | 1.871 | <0.01 | 1.629 | <0.01 | 51 | MAP1LC3A | 3.221 | 0.032 | 2.729 | 0.033 |
| 20 | CORO1A | 1.820 | 0.002 | 1.660 | 0.001 | 52 | MARCKSL1 | 2.704 | 0.009 | 2.831 | 0.013 |
| 21 | SLC4A1 | 1.629 | 0.001 | 1.690 | 0.001 | 53 | FABP3 | 2.992 | 0.007 | 2.831 | 0.010 |
| 22 | CARHSP1 | 1.706 | 0.047 | 1.690 | 0.042 | 54 | SIRT2 | 3.221 | <0.01 | 2.992 | <0.01 |
| 23 | DPYSL4 | 1.837 | 0.002 | 1.706 | 0.004 | 55 | MAG | 3.467 | <0.01 | 3.251 | <0.01 |
| 24 | DCLK1 | 1.854 | <0.01 | 1.706 | <0.01 | 56 | BCAS1 | 3.767 | <0.01 | 3.311 | 0.001 |
| 25 | PPP2R1A | 1.500 | 0.040 | 1.770 | 0.009 | 57 | TNC | 3.342 | <0.01 | 3.404 | <0.01 |
| 26 | MYO18A | 1.820 | 0.019 | 1.786 | 0.018 | 58 | HSPH1 | 3.436 | <0.01 | 3.532 | <0.01 |
| 27 | PURB | 1.941 | 0.025 | 1.803 | 0.042 | 59 | TAGLN2 | 2.965 | 0.040 | 3.597 | 0.032 |
| 28 | WDR1 | 1.786 | 0.001 | 1.837 | <0.01 | 60 | NDRG1 | 3.631 | 0.003 | 3.597 | 0.003 |
| 29 | DPYSL3 | 1.941 | 0.046 | 1.871 | 0.047 | 61 | ACAN | 3.311 | 0.015 | 3.698 | 0.008 |
| 30 | SERPINA1 | 2.148 | <0.01 | 1.888 | <0.01 | 62 | RBM39 | 4.966 | 0.004 | 4.246 | 0.004 |
| 31 | MAP4 | 2.070 | 0.015 | 1.905 | 0.018 | 63 | DPYSL5 | 5.152 | <0.01 | 4.966 | <0.01 |
| 32 | APOA1 | 2.089 | <0.01 | 1.905 | <0.01 | 64 | A2M | 6.607 | 0.002 | 6.546 | 0.003 |
| 编号 | 蛋白质 | 118∶117 | P值 | 121∶119 | P值 | 编号 | 蛋白质 | 118∶117 | P值 | 121∶119 | P值 |
| 1 | PRDX6 | 0.078 | <0.01 | 0.082 | <0.01 | 46 | SLC4A4 | 0.631 | 0.018 | 0.525 | 0.019 |
| 2 | PSAT1 | 0.067 | <0.01 | 0.086 | <0.01 | 47 | KCNAB2 | 0.373 | 0.004 | 0.530 | 0.009 |
| 3 | NES | 0.077 | 0.005 | 0.099 | 0.002 | 48 | ACTIN1 | 0.530 | <0.01 | 0.530 | <0.01 |
| 4 | AARS | 0.437 | 0.004 | 0.209 | <0.01 | 49 | CTSD | 0.575 | 0.013 | 0.530 | <0.01 |
| 5 | PHGDH | 0.261 | <0.01 | 0.217 | <0.01 | 50 | TOMM70A | 0.597 | 0.029 | 0.530 | 0.011 |
| 6 | VAT1 | 0.360 | 0.032 | 0.238 | 0.028 | 51 | LMNB2 | 0.625 | 0.017 | 0.530 | 0.009 |
| 7 | ESYT1 | 0.384 | 0.042 | 0.265 | 0.026 | 52 | PURA | 0.718 | 0.017 | 0.535 | 0.001 |
| 8 | GJA1 | 0.283 | <0.01 | 0.268 | 0.001 | 53 | OGDHL | 0.614 | 0.009 | 0.540 | 0.009 |
| 9 | IGHA1 | 0.233 | 0.001 | 0.273 | 0.036 | 54 | NDUFS2 | 0.530 | 0.009 | 0.545 | 0.005 |
| 10 | IGSF1 | 0.366 | 0.013 | 0.296 | 0.017 | 55 | NDUFV1 | 0.565 | 0.048 | 0.545 | 0.044 |
| 11 | PHYHD1 | 0.511 | 0.026 | 0.302 | 0.012 | 56 | ALDH2 | 0.643 | 0.001 | 0.545 | 0.001 |
| 12 | PCSK1N | 0.313 | 0.002 | 0.328 | 0.015 | 57 | AQP4 | 0.673 | 0.006 | 0.545 | 0.016 |
| 13 | CSTB | 0.492 | 0.036 | 0.328 | 0.011 | 58 | GLUD1 | 0.679 | <0.01 | 0.545 | <0.01 |
| 14 | SLC3A2 | 0.488 | 0.029 | 0.347 | 0.011 | 59 | ADH5 | 0.515 | 0.004 | 0.550 | 0.007 |
| 15 | ASAH1 | 0.433 | 0.017 | 0.353 | 0.007 | 60 | LGALS1 | 0.586 | 0.017 | 0.550 | 0.007 |
| 16 | PTGES2 | 0.429 | 0.036 | 0.356 | 0.021 | 61 | MAOB | 0.619 | 0.003 | 0.555 | 0.004 |
| 17 | HP | 0.429 | 0.001 | 0.356 | 0.014 | 62 | PSAP | 0.457 | 0.010 | 0.565 | 0.048 |
| 18 | PPT1 | 0.394 | 0.003 | 0.377 | 0.005 | 63 | ITPR1 | 0.470 | 0.022 | 0.570 | 0.038 |
| 19 | HRSP12 | 0.406 | 0.016 | 0.387 | 0.038 | 64 | ABAT | 0.597 | 0.002 | 0.570 | 0.007 |
| 20 | FLNA | 0.350 | <0.01 | 0.391 | <0.01 | 65 | AK1 | 0.679 | 0.006 | 0.575 | 0.001 |
| 21 | GSTM2 | 0.497 | 0.002 | 0.391 | 0.003 | 66 | SOD2 | 0.766 | 0.033 | 0.586 | 0.005 |
| 22 | TPPP | 0.685 | 0.018 | 0.394 | 0.009 | 67 | ATP2A2 | 0.631 | 0.002 | 0.592 | <0.01 |
| 23 | TAGLN | 0.302 | 0.003 | 0.409 | 0.005 | 68 | ACO2 | 0.711 | 0.001 | 0.608 | 0.003 |
| 24 | SRI | 0.328 | 0.002 | 0.409 | 0.016 | 69 | SYN1 | 0.614 | 0.009 | 0.625 | 0.015 |
| 25 | PTGDS | 0.497 | 0.019 | 0.413 | 0.010 | 70 | SYT1 | 0.738 | 0.023 | 0.625 | 0.002 |
| 26 | GLUL | 0.649 | <0.01 | 0.417 | 0.013 | 71 | NDUFS1 | 0.608 | <0.01 | 0.637 | 0.002 |
| 27 | ANXA5 | 0.373 | 0.007 | 0.421 | <0.01 | 72 | HEPACAM | 0.619 | 0.045 | 0.637 | 0.038 |
| 28 | GPI | 0.705 | 0.034 | 0.433 | 0.006 | 73 | SLC25A12 | 0.698 | 0.026 | 0.649 | 0.025 |
| 29 | SLC12A5 | 0.479 | <0.01 | 0.441 | 0.001 | 74 | NPEPPS | 0.673 | 0.021 | 0.655 | 0.031 |
| 30 | CRYL1 | 0.483 | 0.010 | 0.441 | 0.008 | 75 | ATP6V1B2 | 0.711 | <0.01 | 0.661 | 0.001 |
| 31 | GBAS | 0.550 | 0.047 | 0.441 | 0.046 | 76 | PC | 0.679 | 0.009 | 0.667 | 0.007 |
| 32 | ANXA2 | 0.413 | 0.004 | 0.453 | 0.010 | 77 | CLU | 0.752 | 0.011 | 0.667 | 0.002 |
| 33 | AHNAK | 0.565 | <0.01 | 0.483 | <0.01 | 78 | ALDH4A1 | 0.759 | 0.027 | 0.667 | 0.006 |
| 34 | COX4I1 | 0.511 | 0.004 | 0.488 | 0.005 | 79 | NDUFA9 | 0.649 | 0.003 | 0.673 | 0.007 |
| 35 | AKR1A1 | 0.555 | 0.003 | 0.492 | 0.001 | 80 | ATP6V1A | 0.766 | <0.01 | 0.673 | <0.01 |
| 36 | STX1B | 0.631 | 0.001 | 0.492 | 0.005 | 81 | VDAC3 | 0.698 | 0.037 | 0.685 | 0.036 |
| 37 | NDUFS3 | 0.540 | 0.010 | 0.497 | 0.004 | 82 | OGDH | 0.745 | 0.032 | 0.685 | 0.010 |
| 38 | VCL | 0.457 | 0.019 | 0.501 | 0.022 | 83 | PACSIN1 | 0.745 | 0.006 | 0.698 | 0.011 |
| 39 | COTL1 | 0.466 | 0.018 | 0.501 | 0.016 | 84 | ALDH6A1 | 0.745 | <0.01 | 0.705 | 0.006 |
| 40 | ESD | 0.479 | 0.033 | 0.501 | 0.029 | 85 | DLG4 | 0.731 | 0.024 | 0.711 | 0.024 |
| 41 | ACO1 | 0.711 | 0.009 | 0.506 | 0.014 | 86 | VIM | 0.738 | <0.01 | 0.718 | <0.01 |
| 42 | FBXO2 | 0.501 | 0.001 | 0.511 | 0.001 | 87 | PEBP1 | 0.679 | 0.020 | 0.731 | 0.006 |
| 43 | PYGB | 0.685 | 0.001 | 0.515 | <0.01 | 88 | PSD3 | 0.679 | 0.026 | 0.738 | 0.014 |
| 44 | SYNPO | 0.461 | 0.006 | 0.520 | 0.001 | 89 | DNM3 | 0.711 | 0.012 | 0.738 | 0.020 |
| 45 | ALDH9A1 | 0.488 | 0.001 | 0.520 | 0.002 |
将所获得的153种差异性表达蛋白进行GO分析,按照分子功能可分为9类,其中酶催化活性、结合及结构分子活性分别占38.00%、26.30%、14.00%(图 1)。在STRING网站中,对这153种差异蛋白的相互作用网络进行检索,发现TF、APOA1、A2M、ATP6V1A、VIM处于相互作用网络的交叉点(图 2),提示这5种候选蛋白可能在儿童皮质发育障碍性癫痫的发生、发展中起到重要作用。
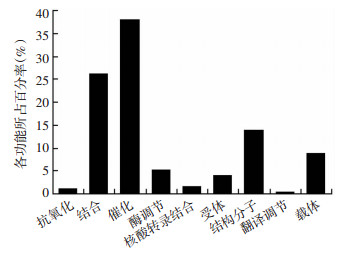 |
| 图 1 差异蛋白的分子功能分类 |
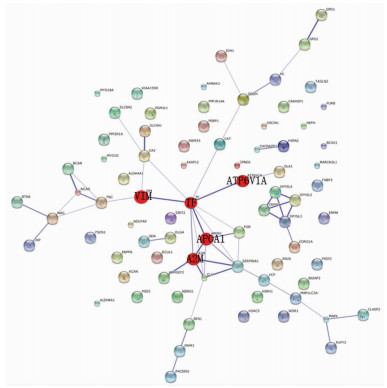 |
| 图 2 差异蛋白相互作用网状图 |
实时定量PCR结果显示,在儿童皮质发育障碍癫痫脑组织中,TF、APOA1和A2M的mRNA水平表达均高于儿童正常脑组织(P<0.05);而ATP6V1A和VIM的mRNA水平表达低于儿童正常脑组织(P<0.05),和iTRAQ质谱鉴定结果趋势一致(图 3)。
 |
| a:P<0.05,与正常脑组织比较 图 3 实时定量PCR检测儿童皮质发育障碍性癫痫及儿童正常脑组织中5种差异蛋白mRNA表达 |
在儿童皮质发育障碍性癫痫脑组织中,TF、APOA1和A2M蛋白的表达均明显高于儿童正常脑组织,而ATP6V1A和VIM蛋白的表达明显均低于儿童正常脑组织(P<0.05),与iTRAQ质谱鉴定结果一致(图 4)。
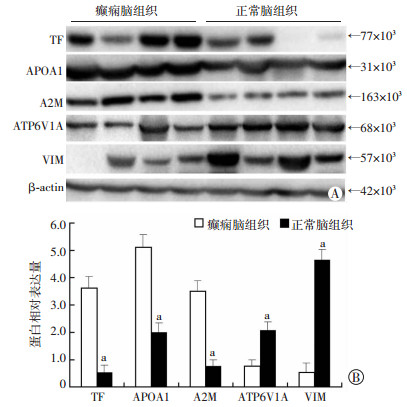 |
| A: Western blot检测;B:半定量分析 a:P<0.05,与正常脑组织比较 图 4 Western blot检测5种差异蛋白在儿童皮质发育障碍性癫痫及儿童正常脑组织中的表达 |
定量蛋白组学是把一个基因组表达的全部蛋白质或一个复杂混合体系中所有的蛋白质进行精确的定量和鉴定。目前iTRAQ标记与2D-LC-MS/MS相结合的 方法是定量蛋白质组学运用的热点。iTRAQ具有灵敏感高,反应速度快,标记完全,重复性高等优点[11]。本研究运用iTRAQ标记与2D-LC-MS/MS相结合的方法鉴定出儿童皮质发育障碍性癫痫153种差异表达蛋白。
GO分子功能分析显示差异蛋白主要参与催化活性。STRING检索发现TF、APOA1、A2M、ATP6V1A、VIM处于差异蛋白相互作用网络的交汇点,提示这5种候选蛋白可能在疾病的发生、发展中起到重要作用。实时定量PCR和Western blot进一步验证,发现候选蛋白在儿童皮质发育障碍性癫痫中的表达趋势和质谱鉴定的结果一致,提示结果的可靠性。
转铁蛋白(TF)的主要作用是运载体内的铁。根据文献[12]报道,脑内的转铁蛋白TF和脑内的铁分布不一致,提示转铁蛋白除了运输铁以外,还有其他的功能,比如:作为自分泌信号,参与神经元的分化以及突触的形成。本研究发现,在儿童皮质发育障碍性癫痫脑组织中,TF表达水平高于儿童正常脑组织,提示TF在儿童大脑皮质发育障碍性癫痫发生、发展过程中起着一定的作用,具有深入研究价值。
载脂蛋白A1(APOA1)是运输脂质的蛋白质,脂 质是神经元髓鞘的重要组成部分。APOA1的异常升高可导致脂质异常,从而影响髓鞘的正常发育导致癫痫的产生[13]。本研究结果表明上调的APOA1与儿童皮质发育障碍性癫痫存在联系,其机制有待进一步研究。
α2-巨球蛋白(A2M)是一种可通过特有“捕获机制”来抑制蛋白酶活性的蛋白酶抑制剂[14]。文献报道A2M可通过调节A-beta的降低从而与阿尔茨海默病有关联[15],但A2M与儿童皮质发育障碍性癫痫的研究较为罕见。
三磷酸腺苷酶(ATP6V1A)是一类催化腺苷三磷酸水解生成腺苷二磷酸与无机磷酸的酶。通过本实验研究发现,ATP6V1A在儿童皮质发育障碍性癫痫中的表达下调,这可能是由于下调的ATP6V1A降低了神经元细胞膜上对K+、Mg2+的通透性,同时或者增加对Ca2+的通透性,从而降低神经元的兴奋阈值,最终产生癫痫样放电[16]。
波形蛋白(VIM)是中间丝其中的一种蛋白质。中间丝是真核生物细胞的重要结构特征,参与细胞骨架的构成,影响着神经元的长度以及神经元的转移[17],VIM表达下调可导致细胞骨架异常,通过影响神经元的转移从而导致皮质发育障碍,最终产生癫痫。目前已有报道VIM与癫痫发生有联系[18],但与儿童皮质发育障碍性癫痫的关系尚不清楚。
综上所述,通过iTRAQ与2D-LC-MS/MS相结合的技术,能有效地筛选出儿童皮质发育障碍性癫痫异常表达的蛋白,从而为儿童皮质发育障碍性癫痫发生机制的研究提供新线索,为寻找该病的生物学标志物和潜在治疗靶点提供新思路。
| [1] | Crino P B, Chou K. Epilepsy and Cortical Dysplasias[J]. Curr Treat Options Neurol, 2000, 2(6): 543-552. |
| [2] | Lee S K, Kim D W. Focal cortical dysplasia and epilepsy surgery[J]. J Epilepsy Res, 2013, 3(2): 43-47. |
| [3] | Zhang H, Li H, Yang Y, et al. Differential regulation of host genes including hepatic fatty acid synthase in HBV-transgenic mice[J]. J Proteome Res, 2013, 12(6): 2967-2979. |
| [4] | Gouw J W, Tops B B, Krijgsveld J. Metabolic labeling of model organisms using heavy nitrogen (15N)[J]. Methods Mol Biol, 2011, 753: 29-42. |
| [5] | Zhang X, Li W, Hou Y, et al. Comparative membrane proteomic analysis between lung adenocarcinoma and normal tissue by iTRAQ labeling mass spectrometry[J]. Am J Transl Res, 2014, 6(3): 267-280. |
| [6] | 张维维, 何晓, 吕小平, 等. 基于iTRAQ结合质谱筛选HBV肝纤维化的差异表达蛋白[J]. 世界华人消化杂志, 2012, 20(29): 2789-2794. |
| [7] | Lim S, Choong L Y, Kuan C P, et al. Regulation of macrophage inhibitory factor (MIF) by epidermal growth factor receptor (EGFR) in the MCF10AT model of breast cancer progression[J]. J Proteome Res, 2009, 8(8): 4062-4076. |
| [8] | Pierce A, Unwin R D, Evans C A, et al. Eight-channel iTRAQ enables comparison of the activity of six leukemogenic tyrosine kinases[J]. Mol Cell Proteomics, 2008, 7(5): 853-863. |
| [9] | Gan C S, Chong P K, Pham T K, et al. Technical, experimental, and biological variations in isobaric tags for relative and absolute quantitation (iTRAQ)[J]. J Proteome Res, 2007, 6(2): 821-827. |
| [10] | Chen Y, Choong L Y, Lin Q, et al. Differential expression of novel tyrosine kinase substrates during breast cancer development[J]. Mol Cell Proteomics, 2007, 6(12): 2072-2087. |
| [11] | 孙传玉, 夏国伟, 徐可, 等. iTRAQ技术在前列腺癌蛋白质组学研究中的应用[J]. 中华男科学杂志, 2010, 16(8): 741-744. |
| [12] | 杜宇, 冯佑民, 钱忠明. 脑内的铁、转铁蛋白及转铁蛋白受体[J]. 生理科学进展, 1999, 30(4): 337-340. |
| [13] | Ueda Y, Kitamoto A, Willmore L J, et al. Hippocampal gene expression profiling in a rat model of posttraumatic epilepsy reveals temporal upregulation of lipid metabolism-related genes[J]. Neurochem Res, 2013, 38(7): 1399-1406. |
| [14] | 潘爱秀. α2-巨球蛋白研究进展[J]. 鲁东大学学报: 自然科学版, 2014, 30(2): 133-137. |
| [15] | Michalowska-Wender G, Wawrzynek A, Rossa G, et al. On the lack of a clear-cut association between alpha-2-macroglobulin deletion and the risk of Alzheimer disease in Poland[J]. Folia Neuropathol, 2014, 52(4): 417-420. |
| [16] | 宋立群, 肖洪彬, 赵丹阳, 等. 安痫宁冲剂对小鼠癫痫模型脑组织中MDA、SOD、ATP酶的影响[J]. 中国实验方剂学杂志, 2002, 8(3): 44-46. |
| [17] | Polleux F, Giger R J, Ginty D D, et al. Patterning of cortical efferent projections by semaphorin-neuropilin interactions[J]. Science, 1998, 282(5395): 1904-1906. |
| [18] | Grajkowska W, Matyja E, Daszkiewicz P, et al. Angiocentric glioma: a rare intractable epilepsy-related tumour in children[J]. Folia Neuropathol, 2014, 52(3): 253-259. |



