2650032 昆明,成都军区昆明总院附属骨科医院,全军创伤骨科研究所;
3650032 昆明,昆明医科大学昆明总院临床分院
2Institute of Orthopaedic Trauma,Affiliated Orthopaedics Hospital of Kunming General Hospital of Chengdu Military Command,Kunming,Yun Nan Province,650032;
3Kunming General Hospital Clinical Branch,Kunming Medical University,Kunming,Yun Nan Province,650032,China
人们对太空的探索不断深入,如建立空间实验室和空间站,宇航员出舱活动越来越频繁,出舱活动的时间也越来越长,但对于太空环境所引起的骨代谢问题还处于研究之中[1]。目前,已有较多研究证明微重力可以引起严重的骨丢失[2, 3]。微重力环境会导致宇航员出现持续的骨丧失和负钙平衡现象,称为失重性骨丧失。失重性骨丧失是人类长期太空停留和探索其他星球的主要障碍之一,主要表现为骨量丢失、骨骼脱矿、骨密度降低、骨生物力学性能下降[4, 5]。研究还证明作为太空环境因素之一的辐射也能引起骨丢失[6, 7, 8]。有学者在小鼠中证明了不同类型的2 Gy太空福照射线,包括质子、光子和重离子都会对骨小梁起到负面作用[9]。但是,关注微重力和辐照的协同作用对骨影响的研究很少。本研究拟观察X辐照条件下是否引起大鼠骨丢失,并通过尾吊模拟微重力条件,分析辐照和微重力对于大鼠骨代谢是否存在交互作用。
1 材料与方法 1.1 主要试剂及配制EDTA Na2(美国Amresco公司),Runx2、Rankl(香 港Abeam 公司),DEPC(美国Sigma-Aldrich公司),TRIzol(美国Ambion公司),氯仿、无水乙醇、异丙醇、异戊醇(Merck公司),逆转录试剂盒、实时定量PCR试 剂盒以及Nfatcl、Rankl、Runx2、Gapdh引物 (美国Invitrogen公司),大鼠抗酒石酸酸性酸酶ELISA试剂盒、大鼠碱性磷酸酶ELISA试剂盒(上海原叶生物科技有限公司),1 000 bp DNA Marker(大连TaKaRa公司)。
1.2 动物分组及辐照和尾吊处理选用2月龄的性成熟SPF级雄性Wistar大鼠40只,体质量(200.0±14.8)g,由第三军医大学西南医院实验动物中心提供[许可证号:SYXK(渝)2012-0015]。分为正常对照组、X射线辐照组(X-ray组)、尾吊模型组(HLS组)及尾吊结合X射线辐照组(HLS+X-ray组),每组10只。正常对照组,4周后处死;X-ray组:一次性接受4 Gy的X射线照射,剂量率为0.87 Gy/min,4周后处死;HLS组:进行尾吊处理,持续4周后处死。HLS+X-ray组:在一次性接受了4 Gy 的X射线照射后,进行尾吊处理,采用Morey-Holton提出的尾吊方法[10],持续4周后处死。
1.3 骨小梁参数分析大鼠处死后,将左边腔骨剥离下来,固定于10%中性福尔马林的固定液中,除尽周围的肌肉和其他组织,使用ZKKS-MCT-SHARP-Ⅳ仪器对样品进行扫描,扫描条件:电压为90 kV,电流为80 μA,360°旋转扫描,扫描时间为30 min/样,微焦斑X光源为20 μm之后基于三维医学影像处理与分析开发包(MITK)进行图像处理。对于腔骨选取距离生长板0.029 mm×0.03 mm×0.07 mm的骨组织区域为兴趣区域进行三维重建和数据测量。测量的骨参数包括骨密度(bone mineral density,BMD),骨小梁的参数包括骨小梁的数目(trabecular number,Tb.N)、骨小梁的分离程度 (trabecular seperation,Tb.Sp)、骨小梁的厚度(trabecular thickness,Tb.Th)、骨体积分数(bone volume/trabecular volume,BV/TV)以及结构模型指数(structural model index,SMI)。
1.4 HE染色大鼠处死后,将其左边股骨单独剥离下来,剔除上面残余的肌肉,然后浸泡于EDTA脱钙液(乙二胺四乙酸5.5 g,4%中性甲酸溶液100 mL),每5天换1次液,持续28 d,以大头针的针尖可以刺入骨干、无沙粒感为宜,再进行组织切片。在骨组织固定、脱钙后,进行熬蜡、脱水、透明和包埋过程,将股骨以骨干为中轴线纵向切成4 μm厚的连续切片,HE染色,封片后,光镜下观察骨小梁的结构。
1.5 酶联免疫反应(ELISA)大鼠处死前麻醉,从其股动脉中收集血液样本,3 000×g离心10 min分离出血清,分装至1.5 mL的离心管中,进行酶联免疫反应,分别对碱性磷酸酶(ALP)、酒石酸酸性磷酸酶(TRAP)、骨钙素(OCN)进行定量分析。
1.6 实时定量PCR本实验测试了成骨细胞形成的控制因子以及破骨细胞的活性,包括NF-κB配体的激活因子(Rankl)。破骨细胞的形成,成熟以及破骨细胞的活性是Rankl/Rank受体来激活的,同时这个受体信号通路可以被很多因子所调控[11, 12]。Runx2是一种成骨细胞特异性表达的基因。Nfatcl则是一种可以调控破骨细胞成熟以及分化的蛋白因子,一旦Nfatcl被激活,它会转录进核内并且作为一个破骨细胞特异性的转录因子。
大鼠处死之后,单独剥离其右边股骨,浸泡于生理盐水中10 s,再迅速置于液氮中冷存,24 h之内采用TRIzol法提取组织总RNA,然后RNA(1 μg)通过Invitrogen 公司的M-MLV第1链合成系统进行反转录实验,1 μg的cDNA用于PCR反应。实时定量PCR选用Invitrogen公司的Platinum SYBR Green qPCR SuperMix-UDG系统,体系设定为50 μL体系:1.3 μL的cDNA,0.2 μL的上下游引物,25 μL的SYBR Green混合液以及23.3 μL的无菌蒸馏水。PCR循环体系:50 ℃,2 min激活UDG的系统之后,95 ℃预变性5 min,95 ℃变性20 s,61.5 ℃退火30 s,72 ℃延伸30 s,总计进行45个循环,之后的溶液曲线读取从65~95 ℃,每隔0.5 ℃读取1次数据,每次数据读取时间为6 s。GAPDH为内参。引物的序列见表 1。
| 基因 | 上游引物 | 下游引物 | 引物长度(bp) |
| Gapdh | 5′-CCTGCACCACCAACTGCTTAGC-3′ | 5′-GCCAGTGAGCTTCCCGTTCAGC-3′ | 143 |
| Runx2 | 5′-CTTCGTCAGCGTCCTATCAGTTC-3′ | 5′-TTCCATCAGCGTCAACACCAT-3′ | 245 |
| Rankl | 5′-TGGGCCAAGATCTCTAACATGA-3′ | 5′-TGGGATTTTGATGCTGGTTTT-3′ | 180 |
| Nfatcl | 5′-ACCAGCATTTCACGTACCTTCCT-3′ | 5′-GAGGCGCGGTGAGTTGTT-3′ | 145 |
采用SPSS 20.0统计软件,计量资料用x±s表示,各个模型组之间的比较选用单因素方差分析,对于尾吊和辐照的交互作用运用单因素方差分析中的析因分析。
2 结果 2.1 骨小梁参数检测和正常对照相比,HLS组出现了明显的骨小梁结构的恶化情况(图 1)。仅对于左边的腔骨而言,当和正常对照组相比,HLS组骨密度、骨小梁数目,以及骨体积分数分别减少了56.6%、54.7%、65.7%,而骨小梁的分离程度和结构模型指数分别增加了279.6%、170.2%,在一系列的骨小梁指标中只有骨小梁的厚度保持不变。X-ray组和正常对照组相比,骨密度、骨小梁的数目、骨体积分数,以及骨小梁的厚度分别下调了30.7%、25.6%、36.2%、34.2%,同时结构模型指数发生了显著的上调(105.3%),而骨小梁的分离程度则没有出现和正常对照组的差异。HLS+X-ray组的骨小梁结构与正常对照组的比较和HLS组及X-ray组相比差异是最大的,HLS+X-ray组的骨小梁结构遭到了最严重的破坏:骨密度、骨小梁的数目、骨体积分数和骨小梁的厚度分别减少64.8%、84.1%、77.6%、30.1%,骨小梁的分离程度和结构模型指数却发生了明显的增加(576.1%、223.7%)。析因分析尾吊与X射线的交互作用显示,骨密度、骨小梁的分离程度、骨体积分数,以及结构模型指数这几个骨参数指标存在显著的交互作用。
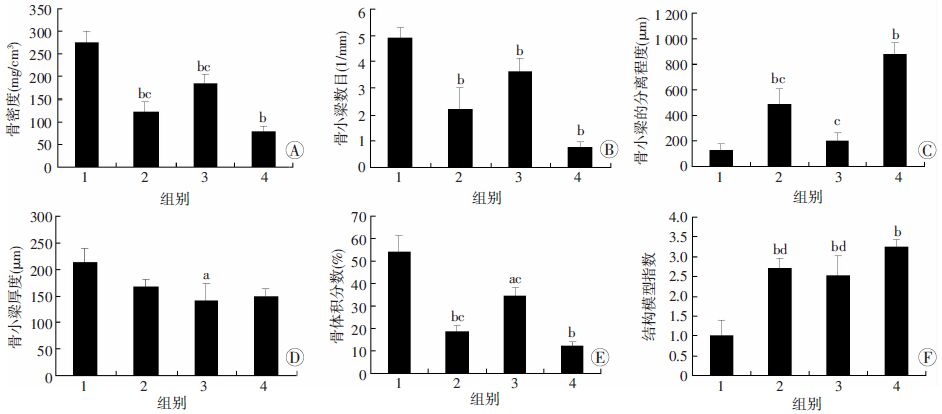
|
| 1:正常对照组;2:HLS组;3:X-ray组;4:X-ray+HLS组;A:骨密度;B:骨小梁的数目;C:骨小梁的分离程度;D:骨小梁的厚度;E:骨体积分数;F:结构模型指数;a:P<0.05,b:P<0.01,与正常对照组比较; c: P<0.01,d: P<0.05,与X-ray+HLS组比较 图 1 各组大鼠的骨参数检测结果比较 |
对骨小梁进行HE染色,发现HLS组、X-ray组、HLS+X-ray组与正常对照组相比,骨小梁结构均有不同程度的减少,以HLS+X-ray组最为严重(图 2)。
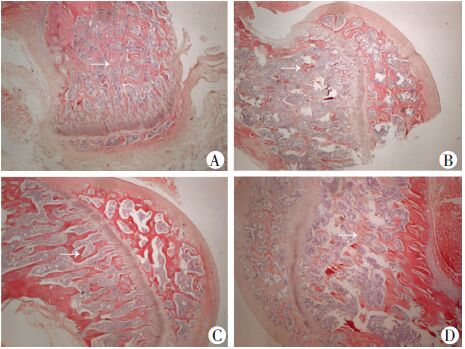
|
| A:正常对照组;B:HLS组;C:X-ray组;D:HLS+X-rays组;黑色箭头示骨小梁的结构 图 2 各组大鼠骨小梁的病理变化 (HE ×40) |
和正常对照组的ALP活性比较,HLS组、X-ray 组、HLS+X-rays组分别下降了26.6%、21.9%、36.9%; 和正常对照组OCN的表达水平比较,HLS组、X-ray组和 HLS+X-ray组分别下降了23.9%、16.5%、19.3%。 酒石酸酸性磷酸酶(TRAP)的表达水平在和正常对照相比,HLS组、X-ray组以及 HLS+X-ray组分别增加了23.2%、23.7%、30.6%(图 3)。
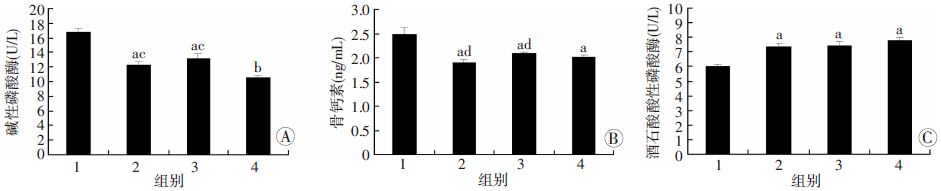
|
| 1:正常对照组;2:HLS组;3:X-ray组;4:X-ray+HLS组;A:ALP;B:OCN;C:TRAP a:P<0.05,b:P<0.01,与正常对照组比较;c: P<0.01,d: P<0.05,与X-ray+HLS组比较 图 3 ELISA检测血液中ALP、OCN以及TRAP的表达 |
如图 4所示,Runx2的表达在HLS组和X-rays组没有改变,但在HLS+X-rays组发生了显著的下调(下调64.9%)。Rankl的表达则更加的复杂,和正常对照组相比,HLS组、X-ray组、HLS+X-ray组的表达量分别增加了161.4%、46.7%、20.1%。和正常对照组相比,HLS组、X-ray组、HLS+X-ray组Nfatcl的表达量分别增加了147.9%、112.4%、156.9%。与正常对照组相比,X射线和尾吊双因素明显增加了Nfatcl和Rankl的表达量,同时某种程度上进一步减弱了Runx2的表达。
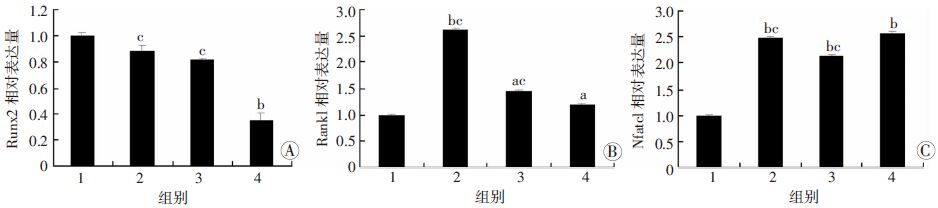
|
| 1:正常对照组;2:HLS组;3:X-ray组;4:X-ray+HLS组;A:Runx2的相对表达;B:Rankl的相对表达;C: Nfatcl的相对表达 a:P<0.05,b:P<0.01,与正常对照组比较;c: P<0.05,与X-ray+HLS组比较 图 4 不同处理组骨调节基因Runx2、Rankl和Nfatcl的表达 |
本研究探讨了尾吊、4 Gy的X射线辐照及4 Gy的X射线辐照后伴随4周的尾吊等不同条件下骨丢失的情况,发现各模型组的骨丢失皆出现了严重的增加,骨小梁的参数也发生了显著的改变。鉴于X射线和尾吊的交互作用非常明显,HLS+X-ray模型组的骨参数变化幅度最大,并且其骨丢失情况最为严重。
本实验中,与正常对照组相比,各模型组除了骨密度发生了显著减少之外,结构模型指数表现出了明显的统一增长趋势,而其他骨小梁三维参数在各模型组中都不同,但通过HE染色可以看出HLS组、X-ray组、HLS+X-ray组都出现了骨小梁数量减少、变细、断裂、连接中断、孔隙不断增大的特征,说明了各个模型组都存在骨丢失现象,以HLS+X-ray组最为明显,该组的各项参数和正常组相比,差距最为显著。通过对HLS+ X-ray组进行单因素方差的析因分析,发现存在着尾吊和辐射之间的交互作用,它对骨的影响程度可能要比单独的某个因素都要强的多,可能是由于成骨细胞表达减少导致骨形成的抑制,也有可能是由于破骨细胞过量表达引起的骨吸附增加。我们推测,在单独尾吊或辐射的基础上,破骨细胞的表达己经开始增加,第2个因素的添加不仅仅是简单的叠加效应,可能还会加速破骨细胞的表达。
本实验还发现作为成骨细胞的标记性物质碱性憐酸酶和骨钙素的表达量在各模型组中均有下降,说明骨形成的过程在各模型组中被减弱了,而破骨细胞的标记物酒石酸酸性磷酸酶在各个模型组出现了不同程度的上升,说明骨吸附的过程得到了增强。研究证实,骨丢失的主要原因是骨吸附的增加而非骨形成的减少[13, 14, 15, 16, 17, 18]。
进一步研究发现,与成骨细胞息息相关的基因Runx2的表达只是HLS+X-ray组中出现了下降,而和破骨细胞表达相关的基因Rankl和Nfatcl则在各模型组中发生了显著的上升。据此不难得出骨形成的减缓并不会影响成骨细胞表达的减少,成骨细胞可以向软骨细胞方向转化,因此模型组出现骨丢失的原因可能在于大量的成骨细胞向软骨细胞进行了分化。
综上所述,尾吊和X射线辐射模拟的空间环境下可以加速骨的丢失,特别是当两者共同作用的时候,由于交互作用的存在,破坏程度会更加严重。但尾吊和X射线辐射加速骨丢失的机制还没有研究透彻,所以在尾吊和X射线辐射条件下,成骨细胞/破骨细胞的分化机制还需要进一步研究。
| [1] | Blaber E A, Dvorochklin N, Lee C, et al. Microgravity induces pelvic bone loss through osteoclastic activity, osteocytic osteolysis, and osteoblastic cell cycle inhibition by CDKN1a/p21[J]. PLoS One, 2013, 8(4): e61372. |
| [2] | Nagaraja M P, Risin D. The current state of bone loss research: data from spceflight and microgravity simulators[J]. J Cell Biochem, 2013, 114(5): 1001-1008. |
| [3] | Hu L F, Qian A R, Wang S M, et al. Inhibitory effect of simulated microgravity on differentiating preosteoblasts[J]. Adv Space Res, 2013, 51(1): 107-114. |
| [4] | Stein T P. Weight, muscle and bone loss during space flight: another perspective[J]. Eur J Appl Physiol, 2013, 113(9): 2171-2181. |
| [5] | Arfat Y, Xiao W Z, Iftihar S, et al. Physiological effects of microgravity on bone cells[J]. Calcif Tissue Int, 2014, 94(6): 569-579. |
| [6] | Wang H, Ji B, Liu X S, et al. Analysis of microstructural and mechanical alterations of trabecular bone in a simulated three-dimensional remodeling process[J]. J Biomech, 2012, 45(14): 2417-2425. |
| [7] | Rana T, Schultz M A, Freeman M L, et al. Loss of Nrf2 accelerates ionizing radiation-induced bone loss by upregulating RANKL[J]. Free Radic Biol Med, 2012, 53(12): 2298-2307. |
| [8] | LeBlanc A, Schneider V, Shackelford L, et al. Bone mineral and lean tissue loss after long duration space flight[J]. J Musculoskelet Neuronal Interact, 2000, 1(2): 157-160. |
| [9] | Azzam E I, de-Toledo S M, Little J B. Direct evidence for the participation of gap junction-mediated intercellular communication in the transmission of damage signals from alpha-particle irradiated to nonirradiated cells[J]. Proc Natl Acad Sci U S A, 2001, 98(2): 473-478. |
| [10] | Morey-Holton E R, Globus R K. Hindlimb unloading rodent model: technical aspects [J]. J Appl Physiol (1985), 2002, 92(4): 1367-1377. |
| [11] | To T T, Witten P E, Renn J, et al. Rankl-induced osteoclastogenesis leads to loss of mineralization in a medaka osteoporosis model [J]. Development, 2012, 139(1): 141-150. |
| [12] | O’Brien C A, Nakashima T, Takayanagi H. Osteocyte control of osteoclastogenesis [J]. Bone, 2013, 54(2): 258-263. |
| [13] | Caetano-Lopes J, Canhao H, Fonseca J E. Osteoblasts and bone formation [J]. Acta Reumatol Port, 2007, 32(2): 103-110. |
| [14] | Gallagher J C, Sai AJ. Molecular biology of bone remodeling: implications for new therapeutic targets for osteoporosis [J]. Maturitas, 2010, 65(4): 301-307. |
| [15] | Bandstra E R, Pecaut M J, Anderson E R, et al. Long-term dose response of trabecular bone in mice to proton radiation [J]. Radiat Res, 2008, 169(6): 607-614. |
| [16] | Hamilton S A, Pecaut M J, Gridley D S, et al. A murine model for bone loss from therapeutic and space-relevant sources of radiation[J]. J Appl Physiol (1985), 2006, 101(3): 789-793. |
| [17] | Kondo H, Yumoto K, Alwood J S, et al. Oxidative stress and gamma radiation-induced cancellous bone loss with musculoskeletal disuse[J]. J Appl Physiol (1985), 2010, 108(1): 152-161. |
| [18] | Smith S M, Wastney M E, O’Brien K O, et al. Bone markers, calcium metabolism, and calcium kinetics during extended-duration space flight on the Mir space station [J]. J Bone Miner Res, 2005, 20(2): 208-218. |



