热射病(heat stroke,HS)是一种最为严重的中暑类型,主要表现为体温调节障碍、高热、中枢神经损伤症状,病死率高。因此,对热射病的救治及预防一直是高温医学和急救医学研究的重点[1]。机体长期接受非损伤性热刺激可出现一系列适应性反应,形成热习服(heat acclimatization,HA)、热耐受性和稳定性增强,对后续的损伤性热应激具有保护作用,可有效预防热射病的发生[2],本课题组前期研究证实HA对小鼠HS脑损伤具有保护作用[3],但其保护作用机理仍不完全清楚。为此,本研究主要观察了HA对HS小鼠脑损伤的干预作用以及对中枢神经细胞自噬及凋亡的影响,以期探讨HA对HS导致中枢神经损伤的保护作用及其可能机制。
1 材料与方法 1.1 实验动物与主要试剂 1.1.1 实验动物及分组48只8~9周龄健康雄性C57小鼠(由第三军医大学实验动物中心提供),体质量21.3~23.5 g,采用随机数字表法将动物分为正常对照组(CON组)、热习服组(HA组)、热射病组(HS组)、HA+HS组,各12只,其中每组中分别取4只小鼠用于脑组织含水量测定、4只小鼠灌注后行脑组织冰冻切片用于形态学观察(包括HE染色、FJB和免疫组织化学染色)、4只小鼠提取脑组织蛋白进行Western blot检测。CON组正常饲养,HA组与HS组按1.2.1所述方法处理,HA+HS组为达到HA后再给予HS组处理条件处理。饲养及实验过程中遵守实验动物管理与保护准则。
1.1.2 主要试剂FJB染料购于美国Millipor公司(货号AG310),Caspase-3兔抗鼠和LC3兔抗鼠抗体均购于美国CST公司(货号分别为9664和12741),TUNEL染色POD凋亡试剂盒购于美国Roche公司(货号为11684817910),驴抗兔ALEXA FLURO 594标志的IgG购于美国Invitrogen公司(货号R37119),其余常规试剂均购于碧云天公司。
1.2 方法 1.2.1 HA和HS动物模型的建立根据文献[3, 4, 5]报道的HA和HS模型构建条件,HA组小鼠置于温度(34.5±0.4)℃热习服室连续30 d,自由食水,照明7:00~19:00;研究已证实该条件下小鼠可达到稳定的热习服状态,表现为基础代谢率和心率下降,热耐受能力增强。HS组小鼠置于特定环境智能型模拟实验舱(天津合普,HOPE-MED 8150E型)(43±0.5)℃加热120 min,肛温>42.5 ℃认为达到HS,结束应激。
1.2.2 脑组织含水量测定按照实验分组条件处理后,即刻处死小鼠,快速取出全脑,剥离脑膜,拭去血液,至于105 ℃烤至恒量(两次称量差≤0.2 mg),按照Elliott公式计算脑组织的含水量:脑组织含水量=(湿质量-干质量)÷湿质量×100%。
1.2.3 脑组织FJB染色标志变性神经元经相应组别处理后的小鼠经4%多聚甲醛灌注固定,进行连续冰冻切片,厚度25 μm,置于4%多聚甲醛固定液中4 ℃保持备用。取脑组织进行冰冻切片于1%NaOH-80%乙醇混合液浸泡、蒸馏水洗涤、0.06%高锰酸钾溶液浸泡15 min,洗涤后新鲜配制的0.000 4%FJB工作液中避光染色30 min、洗涤、脱水、透明、抗荧光淬灭剂封片,荧光显微镜下(激发光波长为450~490 nm) 观察大脑皮层额顶叶运动区(本组研究中的组织染色观察区域均为额顶叶运动区、冠状切、前囟门±1 mm处,该区域为温度感觉的响应区域)并采集图像。
1.2.4 免疫荧光标志LC3检测自噬体分别采用免疫荧光标志LC3检测自噬体和Western blot检测LC3表达量。免疫荧光标志主要步骤为:冰冻切片经固定、血清封闭后于4 ℃孵育一抗LC3 (1 ∶100)过夜,室温复温30 min,PBS洗涤5 min×3次,37 ℃孵育驴抗兔ALEXA FLURO 594标志的IgG(1 ∶200)30 min,PBS洗涤后DAPI复染细胞核,抗荧光淬灭封片,激光共聚焦观察并采集图像。
1.2.5 Western blot检测自噬相关蛋白LC3和凋亡相关蛋白Caspase-3表达处死小鼠后,快速取脑组织额顶叶皮层,提取蛋白并测定蛋白浓度,每孔加样40 μg 进行SDS-PAGE凝胶电泳,湿转法将蛋白转移至NC膜,5%脱脂奶粉封闭1 h,TBST洗涤后分别孵育一抗LC3(1 ∶1 000)和Caspase-3和内参β-actin(1 ∶1 000)4 ℃过夜,TBST洗涤,驴抗兔二抗标志IgG(1 ∶1 000)37 ℃孵育1 h,洗涤,ECL化学发光法显影,Bio-Rad成像并采集图像,读取灰度值,目的条带灰度值分别与内参条带灰度值进行比较。
1.2.6 TUNEL染色法标志凋亡神经细胞按照操作说明书,冰冻切片经固定后,浸入3%H2O2甲醇溶液中封闭10 min,PBS洗涤,浸入新鲜配制的0.1% Triton X-100-0.1%柠檬酸钠溶液中通透2 min,加TUNEL反应液于37 ℃避光反应1 h,converter-POD转换液于37 ℃反应30 min,底物DAB室温反应显色10 min,洗涤后苏木精复染,脱水、光学显微镜观察并采集图像。
1.3 统计学分析采用SPSS 13.0统计软件,计量资料以x±s表示,采用student t检验进行组间比较。
2 结果 2.1 脑组织含水量测定结果显示,HS组含水量最高,其次为HA+HS组,HA组与CON组差异无统计学意义(P>0.05,图 1)。

|
| a:P<0.05,与CON组比较;b:P<0.05,与HS组比较 图 1 各组小鼠脑组织含水量 |
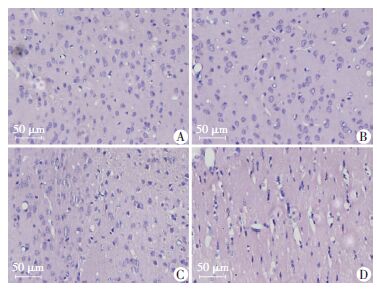
CON组脑组织结构正常,胞质与胞核结构清晰,HA组小鼠脑组织细胞核呈现出轻微的固缩,HS组细胞肿胀,胞质疏松,染色质边集,核明显固缩、破裂、溶解,细胞空泡化明显,HA+HS组细胞核固缩和空泡化程度明显轻于HS组,提示HA预处理减轻了HS导致的脑组织病理改变(图 2)。
|
| A:CON组;B:HA组;C:HA+HS组;D:HS组 图 2 HE染色观察各组小鼠大脑皮层病理改变 |
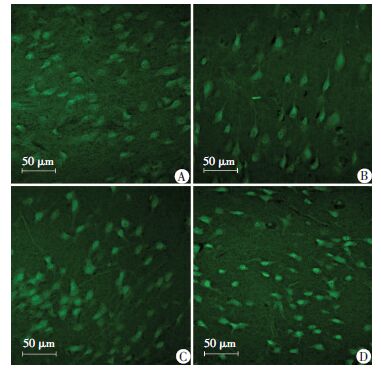
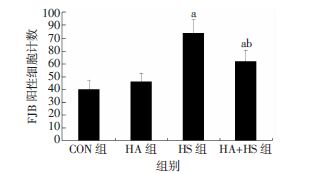
各组小鼠脑组织切片FJB染色结果见图 3,发绿色荧光的为FJB阳性细胞,CON组和HA组有少量的阳性细胞,HA+HS组和HS组阳性细胞明显增多,其中HS组阳性细胞最多。每组4只小鼠,每只小鼠随机选取5个视野,对FJB阳性细胞进行计数分析,HS组及HA+HS组阳性细胞数均显著高于CON组,与HS组比较,HA+HS组阳性细胞明显减少,差异具有统计学意义(P<0.05,图 4)。
|
| A:CON组;B:HA组;C:HA+HS组;D:HS组 图 3 FJB染色观察各组小鼠大脑皮层神经元变性 |
|
| a:P<0.05,与CON组比较;b:P<0.05,与HS组比较 图 4 各组小鼠大脑皮层神经FJB染色阳性细胞计数 |
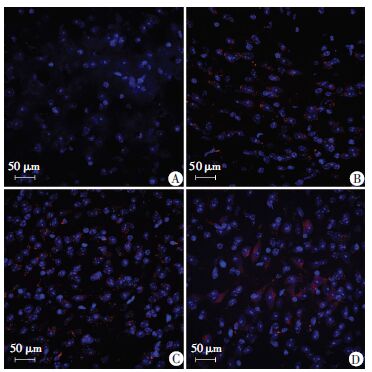
蓝色为DAPI标志的细胞核,红色荧光的为LC3阳性细胞,CON组观察到少量的散在分布的阳性细胞,HA和HS处理均诱导神经元自噬增强,其中HS组阳性细胞最多,荧光强度最高(图 5);Western blot结果显示,LC3-Ⅱ趋势与荧光结果一致(图 6)。
|
| A:CON组;B:HA组;C:HA+HS组;D:HS组 图 5 LC3荧光染色观察各组小鼠大脑皮层细胞自噬 |

|
| A:Western blot检测结果;B:半定量分析结果 a:P<0.05,b:P<0.01,与CON组比较;c:P<0.05,与HS组比较 图 6 Western blot检测LC3蛋白在各组小鼠大脑皮层中的表达 |
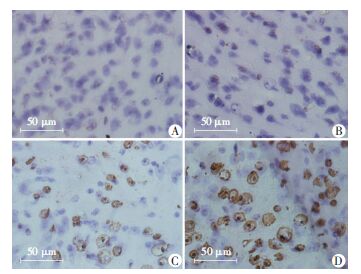
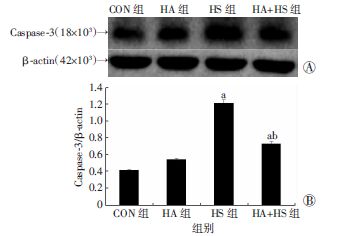
棕色为阳性细胞。CON组未观察到TUNEL阳性细胞,HA组有散在的阳性细胞,HA+HS组和HS组阳性细胞明显增多,HS组阳性细胞最多(图 7)。Western blot结果显示,Caspase-3趋势与TUNEL结果一致(图 8)。
|
| A:CON组;B:HA组;C:HA+HS组;D:HS组 图 7 TUNEL染色观察各组小鼠大脑皮层细胞凋亡 (×800) |
|
| A:Western blot检测结果;B:半定量分析结果 a:P<0.05,与CON组比较;b:P<0.05,与HS组比较 图 8 Western blot检测Caspase-3蛋白在各组小鼠大脑皮层中的表达 |
HS是一种最为严重的中暑类型,不仅在发病过程中会出现谵妄、昏迷等精神神经症状,而且部分患者治愈后仍出现神经损伤后遗症。因此,大多数学者认为中枢神经损伤可能是其高致死率的主要原因之一[6]。本研究发现HS小鼠脑含水量显著增加,提示HS导致了明显脑水肿,HE染色结果观察到明显脑组织病理学变化,表明热射病可明确导致中枢神经损伤。HA是机体增强耐热能力的有效手段,诸多实验研究证实HA对后续损伤性热刺激具有很好的保护作用,对其他损伤因素也有保护作用,如动物发生缺血、缺氧、再灌注等损伤时,其心肌细胞损伤程度显著低于未经HA的动物,也有研究指出HA预处理后,实验动物发生创伤性脑损伤时,损伤程度显著减轻,且临床恢复更快[7, 8]。本研究中,HA预处理后的小鼠暴露于损伤性热刺激后,与HS组小鼠相比,损伤效应明显减轻,表现为脑水肿明显减轻,组织病理损伤减轻,变性神经元和凋亡细胞减少,结果说明HA对HS导致的中枢神经损伤具有明显的保护作用。
自噬是一种高度保守的细胞学行为,可降解细胞内受损的细胞器和各种长寿蛋白,维持细胞能量平衡,对维持细胞在应激条件下的内环境稳态和细胞存活具有重要作用,是机体应对多种应激的适应性反应[9]。但自噬的作用仍存在争议,诸多研究显示,一定程度的自噬对细胞存活起保护作用[10],也有研究指出自噬也是细胞死亡的一种方式,过度自噬可能加重组织损伤[11]。Wen等[12]研究发现大鼠脑缺血缺氧后,神经元自噬明显增强,抑制自噬后,脑损伤减轻,提示缺血缺氧诱导的自噬与脑损伤密切相关。Wang等[13]和Puyal等[14]类似 研究也指出缺血缺氧诱导的自噬加重了脑功能障碍。很多研究也发现HS可导致脑供血不足,使脑神经元发生缺氧,认为HS导致的中枢神经损伤与缺血性脑损伤极其相似。本研究发现,HA和HS处理均诱导神经元自噬明显增强,自噬标志蛋白 LC3-Ⅱ表达显著增多,但与直接HS处理组相比,HA预处理后自噬程度下降,相应的脑组织病理损伤及神经元变性均减轻。结果提示HA预处理使神经元自噬程度减轻,从而发挥保护作用。
凋亡是脑缺血缺氧早期脑损伤的病理生理机制之一,且研究证实凋亡性细胞死亡是脑继发损伤的途径之一,抑制凋亡可减轻脑损伤[15]。HS导致脑神经元发生缺血、缺氧,细胞内环境稳态被破坏,发生酸中毒,启动相关凋亡因子,加速神经元死亡。Caspase-3在介导凋亡过程中发挥关键作用[16]。本研究发现,HS小鼠脑组织TUNEL阳性细胞显著
增加,且Caspase-3表达明显增多。HA预处理后,神经元凋亡减少,脑损伤减轻,提示HA可能通过干预神经元的凋亡过程发生保护作用。
在正常生理条件下,机体细胞有一定的自噬和凋亡水平,以维持细胞的自我更新和细胞内环境稳态。在受到损伤因素时,自噬和凋亡水平会适度增强,应对损伤应激反应。但当损伤刺激过强或损伤过重时,自噬被过度激活,可导致细胞发生自噬性死亡,对机体其损害作用。自噬和凋亡的双向作用已在诸多研究,包括脑外伤、脑缺血缺氧损伤等研究中已有证实[17, 18]。本研究发现,HA可诱导自噬增强,但并未加重神经元的凋亡,而HA预处理后再接受HS刺激,自噬和凋亡程度均下降。究其原因,可能与HA增强了机体的生理功能有关,应对后续的损伤性应激,神经元的兴奋性保持在合理的稳态范围,而HS刺激为损伤性刺激,使细胞在短时间内产生大量的变性蛋白、细胞器碎片等聚集物,且无法及时有效的清除,过多的自噬体在神经元中蓄积,产生细胞毒性作用,从而加速了神经元的变性和凋亡[19]。而HA是一种较为温和的刺激,自噬循环过程流畅,起保护作用。
本研究未对所观察到的自噬和凋亡现象进行药物干预及其分子调控机制的探讨,下一步将进一步研究这种现象的具体调控机制,为HA用于防治HS的具体实践奠定坚实的实验基础。
| [1] | Horowitz M, Eli-Berchoer L, Wapinski I, et al. Stress-related genomic responses during the course of heat acclimation and its association with ischemic-reperfusion cross-tolerance[J]. J Appl Physiol (1985), 2004, 97(4): 1496-1507. |
| [2] | Chen Z C, Wu W S, Lin M T, et al. Protective effect of transgenic expression of porcine heat shock protein 70 on hypothalamic ischemic and oxidative damage in a mouse model of heatstroke[J]. BMC Neurosci, 2009, 10: 111. |
| [3] | 易均凤, 何根林, 赵清, 等. 热习服对小鼠热射病脑损伤的保护作用[J]. 中国热带医学, 2014, 14(11): 1321-1324. |
| [4] | Horowitz M. Heat acclimation and cross-tolerance against novel stressors: genomic-physiological linkage[J]. Prog Brain Res, 2007, 162: 373-392. |
| [5] | Liu T T, Hu C H, Tsai C D, et al. Heat stroke induces autophagy as a protection mechanism against neurodegeneration in the brain[J]. Shock, 2010, 34(6): 643-648. |
| [6] | 荣鹏, 孟建中, 陈宇. 热射病的发病机制及防治策略的研究新进展[J]. 生物医学工程研究, 2010, 29(4): 287-292. |
| [7] | 于大堂, 李茗芳, 倪兵, 等. 大鼠脊髓损伤后自噬相关蛋白LC3和BNIP3的表达[J]. 第三军医大学学报, 2013, 35(9): 841-845. |
| [8] | Sugimoto N, Shido O, Matsuzaki K, et al. Long-term heat exposure prevents hypoxia-induced apoptosis in mouse fibroblast cells[J]. Cell Biochem Biophys, 2014, 70(1): 301-307. |
| [9] | Umschwief G, Shein N A, Alexandrovich A G, et al. Heat acclimation provides sustained improvement in functional recovery and attenuates apoptosis after traumatic brain injury[J]. J Cereb Blood Flow Metab, 2010, 30(3): 616-627. |
| [10] | 肖堂利, 孙蕾, 管旭, 等. 雷帕霉素对糖尿病肾病小鼠足细胞自噬的改善作用[J]. 第三军医大学学报, 2013, 35(23): 2530-2535. |
| [11] | Higgins G C, Devenish R J, Beart P M, et al. Transitory phases of autophagic death and programmed necrosis during superoxide-induced neuronal cell death[J]. Free Radic Biol Med, 2012, 53(10): 1960-1967. |
| [12] | Wen Y D, Sheng R, Zhang L S, et al. Neuronal injury in rat model of permanent focal cerebral ischemia is associated with activation of autophagic and lysosomal pathways[J]. Autophagy, 2008, 4(6): 762- 769. |
| [13] | Wang J Y, Xia Q, Chu K T, et al. Severe global cerebral ischemia-induced programmed necrosis of hippocampal CA1 neurons in rat is prevented by 3-methvladenine: a widely used inhibitor of autophagy[J]. J Neuropathol Exp Neurol, 2011, 70(4): 314-322. |
| [14] | Puyal J, Vaslin A, Mottier V, et al. Postischemic treatment of neonatal cerebral ischemia should target autophagy[J]. Ann Neurol, 2009, 66(3): 378-389. |
| [15] | Abas F, Alkan T, Goren B, et al. Neuroprotective effects of postconditioning on lipid peroxidation mid apeptosis after focal cerebral ischemia/reperfusion injury in rats[J].Turk Neurosurg, 2010, 20(1): 1-8. |
| [16] | Cernak I, Noble-Haeusslein L J. Traumatic brain injury: an overview of pathobiology with emphasis on military populations[J]. J Cereb Blood Flow Metab, 2010, 30(2): 255-266. |
| [17] | Nixon R A. Autophagy in neurodegenerative disease: friend, foe or turncoat?[J]. Trends Neurosci, 2006, 29(9): 528-535. |
| [18] | Hsu S F, Chao C M, Huang W T, et al. Attenuating heat-induced cellular autophagy, apoptosis and damage in H9c2 cardiomyocytes by pre-inducing HSP70 with heat shock preconditioning[J]. Int J Hyperthermia, 2013, 29(3): 239-247. |
| [19] | 方永奇, 刘林. 神经细胞自噬的研究进展[J]. 中华中医药学刊, 2011, 29(3): 453-455. |



