2. 212001江苏 镇江,江苏大学医学院;
3. 239000 安徽 滁州,滁州市人民医院神经外科;
4. 224200 江苏 东台,东台市人民医院神经外科;
5. 212001 江苏 镇江,江苏大学附属医院神经外科
2. School of Medicine, Jiangsu University, Zhenjiang, Jiangsu Province, 212001
3. Department of Neurosurgery, Chuzhou People’s Hospital, Chuzhou, Anhui Province, 239000
4. Department of Neurosurgery, Dongtai People’s Hospital, Dongtai, Jiangsu Province, 224200
5. Department of Neurosurgery, the Affiliated Hospital of Jiangsu University, Zhenjiang, Jiangsu Province, 212001, China
胶质瘤是中枢系统最常见的原发肿瘤,呈浸润性生长,其中恶性胶质瘤具有术后容易复发,预后差等特点,至今仍缺少十分有效的治疗方法[1]。替莫唑胺(TMZ)是目前首选化疗药物,虽然能改善胶质瘤患者的生存时间及生活质量,但其疗效仍不能令人满意[2]。近年来研究发现三环类抗抑郁药氯丙咪嗪可以抑制肿瘤细胞耗氧量,增加Caspase-3活性,降低线粒体膜电位,增加细胞凋亡[3, 4]。我们在体外研究中发现氯丙咪嗪能够明显抑制胶质瘤U251细胞增殖,促进凋亡,这一过程可以被18×103转位分子蛋白(translocator protein,TSPO)配体PK11195阻断,提示氯丙咪嗪作用靶点是TSPO,可能是TSPO的配体,具有活化TSPO,启动线粒体凋亡途径的作用[5]。氯丙咪嗪为临床常用药,副作用小,能够透过血脑屏障,在脑组织内的浓度高,半衰期长,是比较理想的抗胶质瘤候选药物,具有良好的应用前景。然而,氯丙咪嗪作用机制仍未十分明确,且实验多为体外研究结果,缺乏体内研究证据。本研究通过建立人U87胶质瘤肿瘤模型,以氯丙咪嗪为处理因素,旨在帮助确定氯丙咪嗪在体内复杂环境下对胶质瘤的作用,以期为胶质瘤治疗寻找到新的方向。
1 材料与方法 1.1 主要试剂DMEM高糖培养基、氯丙咪嗪、TMZ购于美国Gibco公司;TSPO抗体购于美国Abnova公司;Cytochrome C抗体、Caspase-3抗体购于美国Santa Cruz公司;羊抗鼠IgG(二抗)购于Miltenyi公司;抗鼠 ABC试剂盒购于DAKO公司;DAB 显色试剂盒购于北京中杉生物技术有限公司。
1.2 实验细胞和动物人脑胶质瘤U87细胞株,由中国科学院上海细胞生物学研究所提供。BALB/c(nu/nu)裸小鼠40只,雌雄各半,周龄4~5周,体质量15~22 g,购自扬州大学比较医学中心,饲养于江苏大学实验动物中心无特定病原体(SPF)条件下。
1.3 裸鼠皮下移植瘤模型的建立胶质瘤细胞U87细胞悬液0.2 mL(5×106个细胞,台盼蓝染色法确定细胞存活率90%以上),注射于BALB/c裸小鼠右侧腋窝皮下。每隔3 d用游标卡尺测量肿瘤的最大长径(a)和与其垂直的最大短径(b),按公式V=ab2/2计算肿瘤体积,待肿瘤生长达到200 mm3 后,肿瘤模型建立成功。
1.4 分组及给药根据药典中氯丙咪嗪人用剂量,推算出裸小鼠使用剂量,设立3个剂量组,分别为20、40、60 mg/kg。将30只肿瘤模型裸鼠分成5组,每组各6只,雌雄各半,分别为肿瘤模型组、TMZ组、氯丙咪嗪组(3个剂量组)。给药如下:①氯丙咪嗪组:溶解于0.9%生理盐水中,腹腔注射,剂量分别为20、40、60 mg/(kg·d),连续给药14 d。②TMZ组:溶解于0.9%生理盐水中,腹腔注射,剂量为50 mg/(kg·d),连续给药5 d。③肿瘤模型组:等量生理盐水,腹腔注射,1次/d,连续14 d。
1.5 观察药物对肿瘤生长的影响从给药之日起,隔3 d测量1次肿瘤体积和荷瘤鼠体质量,记录荷瘤鼠死亡情况,以肿瘤模型组的裸小鼠全部死亡为实验终点,颈椎脱臼法处死其余各组剩余裸鼠,实验过程中死亡裸鼠暂时完整保存于-80 ℃低温冰箱,待实验终止时与其他处死的裸鼠同时分离肿瘤组织后放入-80 ℃低温冰箱保存备用。
1.6 免疫组织化学染色肿瘤组织制成石蜡切片,脱蜡水化,漂洗,抗原修复,3%H2O2灭活内源性过氧化物酶,滴加一抗,分别为小鼠抗人TSPO、Cytochrome C、Caspase-3抗体,阴性对照滴加PBS缓冲液,滴加含DAB二抗,苏木精复染,脱水,透明,干燥,封片。
结果判断:TSPO以显微镜细胞膜出现棕黄色染色为阳性。Cytochrome C以细胞质出现棕黄色染色为阳性。Caspase-3以细胞质内出现棕黄色染色为阳性。低倍和高倍镜下观察,随机选择10个高倍(×400)视野,计算出平均阳性细胞数和平均细胞总数。阳性细胞率=平均阳性细胞数/平均细胞总数。
1.7 Western blot蛋白裂解液提取肿瘤组织总蛋白,12%SDS-PAGE胶电泳分离。电泳完毕后,转移至PVDF膜上,5%脱脂奶粉的TBST室温封闭,加入小鼠抗人TSPO抗体(1 ∶500 稀释)、Cytochrome C抗体(1 ∶500稀释)、Caspase-3抗体(1 ∶500稀释),4 ℃孵育。TBST洗膜后二抗室温下杂交,ECL法显影发光。以β-actin为内参(1 ∶1 000稀释),采用凝胶成像分析系统进行蛋白条带光密度的半定量测定。
1.8 统计学处理实验数据用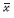 ±s表示,统计软件使用SPSS 20.0,各组数据经方差齐性检验,符合方差齐性。组间比较采用单因素方差分析,两组数据比较,采用独立样本t检验。检验水准α=0.05。
±s表示,统计软件使用SPSS 20.0,各组数据经方差齐性检验,符合方差齐性。组间比较采用单因素方差分析,两组数据比较,采用独立样本t检验。检验水准α=0.05。
肿瘤模型组荷瘤鼠死亡后,比较各处理组与肿瘤模型组荷瘤鼠生存率,氯丙咪嗪各剂量组与肿瘤模型组比较,不能明显增加荷瘤鼠生存率,其中TMZ组仍有4只存活,CIMP 40组和CIMP 20组各有1只存活,而CIMP 60组无存活荷瘤鼠。
2.2 荷瘤鼠移植瘤的生长情况及瘤体积的变化趋势人胶质瘤母细胞U87细胞(5×106/mL)接种BALB/c裸鼠34只,移植瘤成功率90%,成瘤时间(6±3)d,当肿瘤体积达到200 mm3时,将荷瘤鼠分成5组,开始给药,随着肿瘤逐渐增大及化疗药物使用,各组荷瘤鼠摄食均出现减少,活动逐渐迟缓,精神状态变差,体质量减轻。后期出现肿瘤恶病质表现。待肿瘤模型组荷瘤鼠死亡后,颈椎脱臼法处死其他各组荷瘤鼠,解剖荷瘤鼠,肉眼见肿瘤生长于皮下,包膜完整,无明显远处转移浸润,切面灰白色,中心有干酪样坏死,未见出血(图 1A)。给药初期各组荷瘤鼠移植瘤体积都逐渐增大,但氯丙咪嗪组与对照组相比较增长较缓慢。用药结束后,肿瘤体积有明显增长趋势,且肿瘤模型组移植瘤增长趋势较明显,而TMZ组移植瘤增长较肿瘤模型组缓慢(图 1B)。
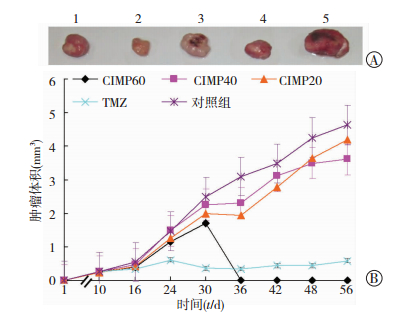 |
| A:5组荷瘤鼠皮下移植瘤大体观;B:各组荷瘤鼠肿瘤体积随时间的变化 图 1 移植瘤皮下生长情况及瘤体积的变化趋势 |
用药结束后第14天氯丙咪嗪各剂量组(除CIMP 60组)肿瘤体积的增长与肿瘤模型组相比无统计学差异(P>0.05),氯丙咪嗪各剂量组(除CIMP 60组)肿瘤体积增长均大于TMZ组(P < 0.05),氯丙咪嗪各剂量组之间比较无统计学差异(P>0.05,表 1)。
 ±s ±s |
||
| 组别 | 荷瘤鼠体质量(g) | 肿瘤体积(cm3) |
| a:P<0.05,与TMZ组比较 | ||
| 肿瘤模型组 | 22.33±0.89 | 1.47±0.20 |
| TMZ组 | 18.85±1.06 | 0.61±0.08 |
| CIMP 60组 | - | - |
| CIMP 40组 | 21.38±0.67 | 1.48±0.17a |
| CIMP 20组 | 21.51±1.60 | 1.26±0.25 a |
免疫组化染色结果显示,各组肿瘤细胞都有TSPO表达,其中CIMP 60组阳性细胞率高于肿瘤模型组,各氯丙咪嗪剂量组之间无明显差异(图 2)。
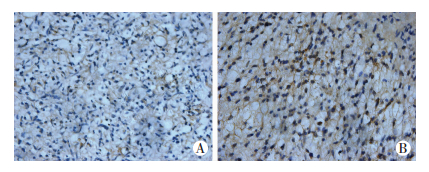 |
| A:肿瘤模型组;B:CIMP 60组 图 2 免疫组化检测肿瘤模型组和CIMP 60组中TSPO蛋白的表达 (SABC×200) |
Western blot检测结果显示,CIMP 60组TSPO的表达较肿瘤模型组增多(P<0.05),各剂量组之间无统计学差异(P>0.05,图 3)。
 |
| A: Western blot检测结果;B:半定量分析结果 1:CIMP 60组,2:CIMP 40组,3:CIMP 20组,4:对照组,5:TMZ组;a:P < 0.05,与对照组比较 图 3 Western blot检测各组TSPO蛋白的表达变化 |
免疫组化染色结果显示,Cytochrome C在各组均有阳性细胞表达,CIMP 60组阳性细胞率较肿瘤模型组增加(图 4)。
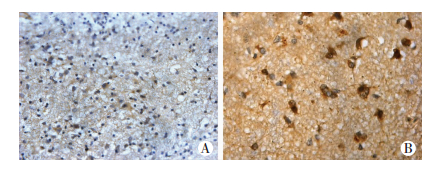 |
| A:肿瘤模型组;B:CIMP 60组 图 4 免疫组化染色检测肿瘤模型组和CIMP 60组中Cytochrome C蛋白的表达 (SABC×200) |
Western blot检测结果显示,Cytochrome C在CIMP 60组的表达较肿瘤模型组明显增高(P < 0.05),但各剂量组之间无统计学差异(P>0.05,图 5)。
 |
| A:Western blot 检测结果;B:半定量分析结果 1:CIMP 60组,2:CIMP 40组,3:CIMP 20组,4:对照组,5:TMZ组;a:P < 0.05,与肿瘤模型组比较 图 5 Western blot 检测各组Cytochrome C蛋白的表达变化 |
免疫组化染色结果显示,Caspase-3在各组均有表达,CIMP 60组阳性细胞率与肿瘤模型组比较无明显差异(图 6)。
 |
| A:肿瘤模型组;B:CIMP 60组 图 6 免疫组化染色检测对照组和60 mg/kg氯丙咪嗪组中Cytochrome C的表达 (SABC×200) |
Western blot检测结果显示,Caspase-3蛋白在氯丙咪嗪各剂量组与肿瘤模型组间表达量无统计学差异(P>0.05),氯丙咪嗪各剂量组间也无统计学差异(P>0.05,图 7)。
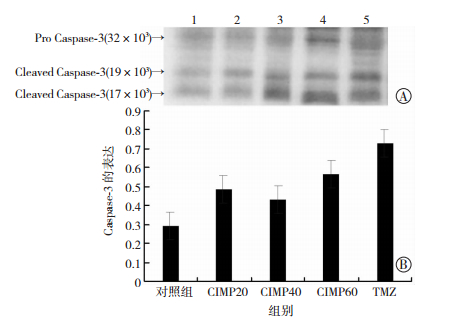 |
| A:Western blot 检测结果;B:半定量分析结果 1:对照组,2:CIMP 20组,3:CIMP 40组,4:CIMP 60组,5:TMZ组 图 7 Western blot 检测各组Caspase-3蛋白的表达变化 |
氯丙咪嗪是一种高亲脂性三环类抗抑郁药,能够直接通过血脑屏障进入任何一个脑区,且半衰期较长,能在脑内维持较高的血药浓度,在近几十年的临床应用中尚未发现有特殊的不良反应[6]。虽然氯丙咪嗪不是一个常规抗肿瘤药物,但相关研究已经证实氯丙咪嗪有抑制肿瘤细胞生长的作用[7, 8]。Beaney等[9]在将氯丙咪嗪用于27例恶性胶质瘤患者长达4.5年的临床治疗中发现有21例患者取得了良好的局部反应,说明氯丙咪嗪在特定的剂量和合适的时间下使用能对胶质瘤患者有潜在的保护作用。本研究通过建立U87胶质瘤皮下肿瘤模型,研究氯丙咪嗪在体内对胶质瘤细胞增殖影响及可能存在的机制,结果显示,氯丙咪嗪组的肿瘤体积相比肿瘤模型组虽然无明显统计学差异,但其抑制肿瘤生长趋势明显。这可能与样本量设立不足有关,且无法排除饮食、性别、个体差异,裸鼠耐受性等多种因素对结果的影响。而在进一步实验研究中需增加样本量,减少外界非处理因素等影响,使实验结果更真实、可靠。另外,本研究发现荷瘤鼠氯丙咪嗪组相比肿瘤模型组其对肿瘤生长有抑制趋势,而且高剂量组(60 mg/kg)作用更明显。本研究认为氯丙咪嗪持续高剂量使用虽然有增加荷瘤鼠死亡率可能,但其对肿瘤抑制趋势较低剂量组明显。虽然氯丙咪嗪低剂量组较肿瘤模型组也有抑制肿瘤生长趋势,但不明显增加荷瘤鼠死亡率(P>0.05),而停止处理后肿瘤生长明显加快,研究结果提示选择合适的剂量,长期使用氯丙咪嗪可能具有抑制肿瘤生长,延长荷瘤鼠生存时间的作用。
在体内实验研究中,我们发现氯丙咪嗪可能通过与线粒体膜上的TSPO结合,增强其活性,并启动线粒体凋亡途径,促进Cytochrome C的生成和释放,激活Caspase-3,诱导了肿瘤细胞凋亡。而在其他氯丙咪嗪相关研究中,Daley等[10]也发现相比对照组而言,使用氯丙咪嗪处理后的恶性胶质瘤细胞中Caspase-3表达明显增加,肿瘤细胞生长抑制明显。类似研究也发现将氯丙咪嗪作用于小鼠胶质瘤C6细胞后线粒体膜电位下降,Caspase-3含量增加,肿瘤细胞凋亡现象明显[11]。上述研究表明氯丙咪嗪的抗肿瘤作用与线粒体凋亡途径有密切关系。同样在本研究结果发现 60 mg/kg 氯丙咪嗪组胶质瘤细胞中TSPO、Cytochrome C 表达较肿瘤模型组差异明显,而TSPO、Cytochrome C、Caspase-3的表达也随药物浓度呈增长趋势,并与体外研究的结果相符,提示氯丙咪嗪可能通过增强TSPO的活性,启动肿瘤细胞线粒体凋亡途径,促进Cytochrome C释放,激活细胞凋亡联级反应,促使肿瘤细胞凋亡,达到抑制肿瘤生长作用。
虽然本研究结果提示氯丙咪嗪对胶质瘤生长没有明显的抑制作用,但有延长荷瘤鼠生存时间的趋势,而在进一步实验发现氯丙咪嗪可作为TSPO的激动性配体,能通过与作用靶点TSPO结合后使其表达增加,从而使肿瘤细胞内凋亡相关蛋白表达增加、ROS释放增加、ATP生成减少,促使线粒体膜电位下降、线粒体通透性增加,导致线粒体功能受损,最终有诱导肿瘤细胞凋亡可能,但其作用效果并不明显。本研究不仅分析了氯丙咪嗪对胶质瘤细胞可能作用机制,而且探讨了氯丙咪嗪可能作用靶点TSPO在其抗肿瘤作用中发挥的功能,尝试为胶质瘤治疗找到新的方法。目前关于氯丙咪嗪抗肿瘤作用的研究仍方兴未艾,而在应用于抗肿瘤临床药物前仍需要大量的基础与临床研究验证,但氯丙咪嗪为更廉价及低毒性的胶质瘤临床治疗提供了新方向,且具有很好的应用前景,为众多胶质瘤患者带来了新的希望。
| [1] | Konglund A, Helseth R, Lund-Johansen M, et al. Surgery for high-grade gliomas in the aging[J]. Acta Neurol Scand, 2013, 128(3): 185-193. |
| [2] | Fisher T, Galanti G, Lavie G, et al. Mechanisms operative in the antitumor activity of temozolomide in glioblastoma multiforme[J]. Cancer J, 2007, 13(5): 335-344. |
| [3] | Parker K A, Glaysher S, Hurren J, et al. The effect of tricyclic antidepressants on cutaneous melanoma cell lines and primary cell cultures[J]. Anticancer Drugs, 2012, 23(1): 65-69. |
| [4] | Levkovitz Y, Gil-Ad I, Zeldich E, et al. Differential induction of apoptosis by antidepressants in glioma and neuroblastoma cell lines: evidence for p-c-Jun, cytochrome c, and caspase-3 involvement[J]. J Mol Neurosci, 2005, 27(1): 29-42. |
| [5] | 许慧中, 向定朝, 杨伟现, 等. 氯丙咪嗪对人脑胶质瘤U251细胞增殖的影响[J]. 江苏医药, 2012, 38(4): 380-382, 封2. |
| [6] | Hendset M, Haslemo T, Rudberg I, et al. The complexity of active metabolites in therapeutic drug monitoring of psychotropic drugs[J]. Pharmacopsychiatry, 2006, 39 (4): 121-127. |
| [7] | Pilkington G J, Parker K, Murray S A. Approaches to mitochondrially mediated cancer therapy[J]. Semin Cancer Biol, 2008, 18(3): 226-235. |
| [8] | Jeon S H, Kim S H, Kim Y, et al. The tricyclic antidepressant imipramine induces autophagic cell death in U-87MG glioma cells[J]. Biochem Biophys Res Commun, 2011, 413(2): 311-317. |
| [9] | Beaney R P, Gullan R W, Pilkington G J. Therapeutic potential of antidepressants in malignant glioma: clinical experience with clomipramine[J]. J Clin Oncol (Meet Abstr), 2005, 23(16S): 1535. |
| [10] | Daley E, Wilkie D, Loesch A, et al. Chlorimipramine: a novel anticancer agent with a mitochondrial target[J]. Biochem Biophys Res Commun, 2005, 328(2): 623-632. |
| [11] | Bilir A, Erguven M, Oktem G, et al. Potentiation of cytotoxicity by combination of imatinib and chlorimipramine in glioma[J]. Int J Oncol, 2008, 32(4): 829-839. |



