创伤性脑损伤(traumatic brain injury,TBI)是神经外科最常见的疾病之一,其发生率和急性期病死率极高,给家庭和社会都造成了严重的危害。然而目前为止,却没有发现一种有效的治疗早期脑损伤的药物。apoE蛋白作为机体的重要载脂蛋白,其在神经系统的作用备受关注[1]。前期研究表明:APOEε4亚型是颅脑创伤急性期(<7 d)病情加重的风险基因[2],而apoE拟肽作为一种新型神经保护药物,在急性颅脑创伤模型中有明显的治疗效果[3]。然而,由于人类具有3种不同的APOE等位基因(APOEε2、APOEε3、APOEε4),其apoE拟肽的治疗作用与APOE基因多态性的关系仍然存在争议[4, 5, 6]。因此,本研究着重探讨APOE基因亚型对TBI后COG1410早期神经保护作用的影响。 1 材料与方法 1.1 实验动物与分组
健康APOE转基因鼠(ε4)、健康APOE转基因鼠(ε3)及APOE敲除[APOE(-/-)]鼠 (重庆医科大学实验动物中心提供)各70只,鼠龄8~12周,体质量18~ 24 g;各型小鼠分为TBI+COG1410组、TBI+生理盐水组、假手术组。TBI+ COG 1410组和TBI+生理盐水组又按照伤后天数分为伤后1、3、7 d 三个亚组,每组10只。实验操作均通过泸州医学院实验动物伦理委员会批准。 1.2 主要试剂及仪器
兔抗小鼠APP多克隆抗体(Invitrogen,366900);山羊封闭血清(博士德);即用型及免疫组织化学UltraSensitiveTM S-P试剂盒(迈新);YLS-4C型转棒式疲劳仪(济南益延科技发展有限公司);TBI-0310型气动脑损伤撞击器(美国PSI公司);COG1410(美国Cognosci公司合成和提供,其纯度≥95%,分子结构是由apoE 受体结合区138~149氨基酸序列构成,其中140和145位点由氨基异丁酸取代)。 1.3 脑创伤模型制备和COG1410的干预
脑创伤模型制备参照Brody等[7]描述过的TBI模型制备的实验方法。小鼠经3.5%的水合氯醛腹腔麻醉后,备皮消毒,于无菌条件进行模型制备,行正中矢状切口,去除骨膜并暴露右侧颅骨,以冠状缝右侧3 mm与人字缝前端2.7 mm的交点为中心,用电钻钻开一直径4 mm圆形骨窗(注意不应损伤矢状窦和硬脑膜)。然后固定于立体定位仪上,使骨窗与 水平面平行,按照此参数实施撞击(速度:3 m/s,深度:1.5 mm,直径:3 mm,接触时间:100 ms),导致右侧的皮质感觉运动区及深部的海马区的缺损。假手术组不予撞击,其余步骤与创伤组相同。 彻底止血后,将取出的颅骨骨片贴附于暴露骨窗,缝合头皮并再次消毒,复苏后待其可活动后放回。COG1410在使用前于无菌条件下由0.9%的生理盐水溶解制备,且每只老鼠按照1 mg/kg的比例溶于100 μL 生理盐水进行尾静脉注射[3]。而对于TBI+COG1410组和TBI+盐水组(同体积)来说,首次注射时间必须在创伤后30 min内注射完毕,且注射时间不能超过5 min,随后每24小时注射1次(对于伤后3 d组和7 d组)。 1.4 神经功能学的测定
转棒疲劳仪专门用来检测小鼠的运动功能(n=
10,取自伤后7 d组),在当天的模型制备之前,小鼠先在转棒仪上进行2次1 min的训练(转速为16 r/min),然后额外进行3次测试(每次测试间隔15 min),记录掉落时间,将3次的平均值作为小鼠运动功能的基本参数。在创伤后1、2、3、4、5、7 d,小鼠均进行3次测试,记录3次的平均值(小鼠不能站稳则记录为0 s)。
1.5 脑组织含水量的测定
我们采用干湿质量法进行脑水肿的测量(n=5),小鼠于伤后1、3、7 d经水合氯醛深度麻醉后,用0.1 mol/L 的PBS(pH=7.4)经心脏灌注30 mL,分别称量伤侧及健侧半脑(均去除嗅球和小脑);然后100 ℃ 烘烤24 h,称干质量,计算含水量百分比,脑组织含水量=(湿质量-干质量)/湿质量×100%[8]。我们将伤侧脑组织含水量与健侧脑组织含水量的差值作为创伤后脑水肿的增殖(可消除个体差异)。 1.6 免疫组化测定淀粉样前体蛋白(amyloid precursor protein,APP)的表达
APP作为轴突损伤的一个重要病理标志,已得到了广泛的认可。我们参照Jiang等[3]的实验方法,于伤后1、3、7 d收集标本(n=5),小鼠深度麻醉后先经心脏灌注4 ℃的0.1 mol/L的PBS(pH=7.4)30 mL,然后再灌注4 ℃的4%的多聚甲醛50 mL。随后于冰上取脑放入4 ℃的4%的多聚甲醛中过夜,第2天加入20%蔗糖溶液脱水,沉底后加入30%的蔗糖溶液继续脱水。待其沉底后用冰冻切片机切成厚约50 μm的薄片,并放入冰冻缓存液中保存。我们采用S-P法进行免疫组化检测,在每次加入新试剂之前均用0.1 mol/L 的TBS(pH=7.4)进行漂洗,每次5 min,共3次。首先将组织漂洗后转移至0.3%的双氧水溶液(0.1 mol/L的TBS配制,室温10 min)以消除内源性过氧化物酶,再滴加的3%的正常山羊血清(0.25%的TBS-X溶液配制,室温30 min)以封闭非特异性抗原,不用漂洗,滴加1 ∶500的一抗溶液(用0.25%的TBS-X 配制,同时加入1%的正常山羊血清)4 ℃ 过夜。第2天 37 ℃ 复温1 h后滴加二抗溶液(室温10 min),然后S-P复合物(室温10 min),接着DAB溶液显色及贴片,待其风干后进行最后的封片。阳性表达为受损轴突末端的黄棕色颗粒(轴突球),每只小鼠选取3张切片,每张切片选取互不重复的2个视野(×400),采用Image-Pro Plus6.0软件对图像进行半定量分析,测量每个视野的积分光密度值(IOD)和阳性面积(area),计算平均积分光密度(IOD/area)。 1.7 统计学方法
采用SPSS 17.0统计软件,计量资料以 x±s表示,数据分析分别采用独立样本t检验。 2 结果 2.1 APOE基因多态性的影响
为了证实内源性基因多态性对脑外伤的影响,我们分别将ε3、ε4、APOE(-/-)鼠的脑创伤+盐水组的转棒时间和脑含水量进行比较。结果显示,在转棒实验中,ε3鼠比ε4鼠的转棒时间久,且在伤后前3 d差异具有统计学意义(P<0.05,图 1);在脑水肿方面,虽然ε3鼠与ε4鼠的脑含水量差异没有统计学意义 (P>0.05,图 2),但ε3鼠具体数值仍低于ε4鼠。ε4鼠和APOE(-/-)鼠比较,在各方面参数的差异都不具有统计学意义(P>0.05,图 1、2)。而ε3鼠和APOE(-/-) 鼠比较,在伤后前4 d的转棒时间以及伤后1、 3 d 的脑含水量差异都具有统计学意义(P<0.05,图 1、 2)。说明在急性颅脑创伤后,APOE ε4基因仍然作为一种高危基因,与不良预后存在一定的关系。
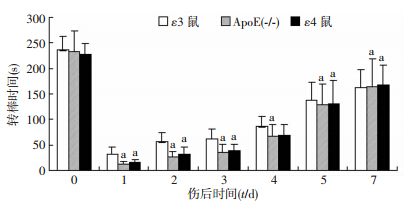 |
| a:P<0.05,与ε3鼠比较图 1 不同基因型小鼠在伤后7 d的平衡运动功能情况 |
 |
| a: P<0.05,与ε3鼠比较图 2 不同基因型小鼠在伤后7 d的脑组织含水量情况 |
为了证实COG1410在早期脑外伤后神经功能学的治疗作用,我们通过转棒式疲劳仪对创伤后小鼠的运动功能进行检测(n=10)。结果显示:在ε3鼠中,盐水组与COG1410组在伤后前3 d的转棒时间差异 不具有统计学意义(P>0.05,图 3A),而在伤后4~7 d 的转棒时间差异具有统计学意义(P<0.05,图 3A);
而在APOE(-/-)鼠和ε4鼠中,盐水组与COG1410组在伤后1~7 d的转棒时间差异均具有统计学意义(P<0.05,图 3B、3C)。说明在3种小鼠中COG1410都具有促进其运动神经功能恢复的作用,且在ε4和APOE(-/-)鼠中,COG1410的作用效果更明显。
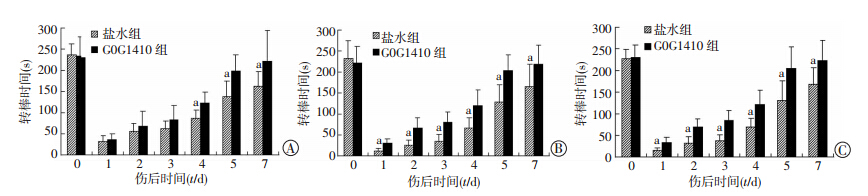 |
| a:P<0.05,与COG1410组比较 A:ε3鼠;B:APOE(-/-)鼠;C:ε4鼠图 3 转棒时间用于评定脑损伤后小鼠的平衡运动功能情况 |
在与炎症相关的脑水肿检测中,ε3鼠在盐水组与COG1410组伤后1 d的脑含水量差异不具有统计学意义(P>0.05,图 4A),而在伤后3、7 d的脑含水量差异具有统计学意义(P<0.05,图 4A);而在APOE(-/-)鼠和ε4鼠中,盐水组与COG1410组在伤后1、3、7 d脑含水量差异具有统计学意义(P<0.05,图 4B、C)。说明COG1410在3种小鼠中都具有减轻脑水肿的作用,而在APOE(-/-)鼠和ε4鼠中具有更明显的效果。
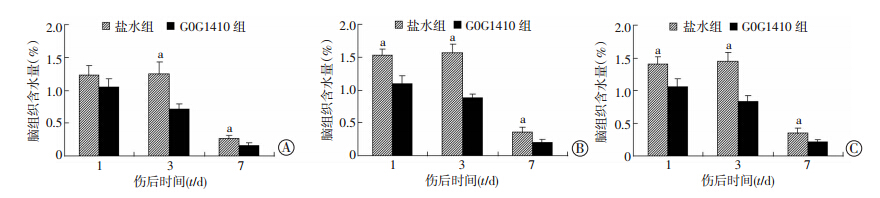 |
| a:P<0.05,与COG1410组比较 A:ε3鼠;B:APOE(-/-)鼠;C:ε4鼠 图 4 脑组织含水量用于判断不同基因型小鼠颅内高压的情况 |
Image-Pro Plus6.0软件对其APP表达的半定量分析结果显示,COG1410具有减轻APP表达的作用 (P<0.05,图 5A、B);而在ε4鼠中,盐水组与COG1410组在伤后1、3、7 d的APP表达差异不具有统计学意义(P>0.05,图 5C)。COG1410 对不同基因鼠早期脑损伤后胼胝体区APP表达影响的免疫组化染色结果见图 6,与半定量分析结果一致。这说明COG1410在ε3和APOE(-/-)鼠中具有减轻轴突损伤的效果,在ε4鼠中没有效果。
 |
| a:P<0.05,与COG1410组比较 A:ε3鼠;B:APOE(-/-)鼠;C:ε4鼠 图 5 半定量分析COG1410对不同基因型小鼠APP的表达情况 |
 |
| 图 6 APP的表达用于判断轴突的损伤情况 (S-P ×400) |
TBI作为神经外科最常见的疾病之一,严重威胁着人类的生命安全。然而目前为止,却没有一种有效的治疗早期脑损伤的药物。因此,对于急性脑损伤的药物干预治疗是非常迫切的。apoE蛋白作为机体的重要载脂蛋白,不仅参与脂蛋白的转化和代谢,而且还对神经组织的保护和修复功能具有重要作用[1, 7, 9, 10, 11]。在人类,APOE具有3种不同的等位基因:APOEε2、APOEε3、APOEε4。而ε4基因作为高危基因,在一系列急慢性神经系统疾病中拥有不良的预后,其中也包括颅脑创伤[2, 6, 9, 12]。
上述实验结果中我们发现:对比APOE(-/-)基因型小鼠,ε4/4基因型并没有进一步加重神经功能损伤和脑水肿的作用;而ε3/3基因型具有改善神经功能恢复和脑水肿的作用。说明ε4基因的存在并没有对机体带来负面影响;而ε3基因在早期颅脑创伤后则具有一定的抗炎和神经保护作用。而在ε3/3基因型和ε4/4基因型的对比当中,ε4/4基因型会产生一定的不良预后,因此,在纯合子ε4/4基因型脑外伤的病理变化中,ε4基因的不良预后可能仅在于缺乏ε3基因的抗炎和神经保护作用,并没有进一步加重神经系统损伤的作用。
对于APOE基因的多态性于颅脑创伤的重要关系已得到充分证实,这也说明apoE蛋白在脑损伤后可发挥重要的作用。因此,学者们研制出了apoE拟肽,其不仅能通过血脑屏障(blood-brain barrier,BBB),也保存了大部分全蛋白的特性,本研究运用的COG1410就是由apoE 受体结合区138~149氨基酸序列构成,其中140和145位点由氨基异丁酸取代,更增加了分子的稳定性和抗炎作用[13]。近期研究发现,COG1410具有降低轴突中APP沉积和小胶质细胞激活的作用[3],与其他急性脑损伤模型中的抗炎和神经保护功能是一致的[5, 8, 14]。然而,为了将apoE拟肽的神经保护作用运用于临床,探讨APOE基因多态性与apoE拟肽的神经保护作用的关系,本实验运用APOE转基因鼠作为试验对象,更好的模拟人类基因型,以求进一步说明apoE拟肽对于人类脑损伤的神经保护作用效果。
上述实验结果显示:在不同APOE基因型背景下,apoE拟肽的神经保护作用也不尽相同。在ε3、ε4和APOE(-/-)小鼠中,COG1410都具有缓解脑水肿和改善神经功能损伤的作用,说明在小鼠中,apoE3和apoE4蛋白的存在不会影响外源性apoE拟肽对于缓解脑水肿和改善神经功能损伤的作用。而COG1410的作用效果在ε4/4基因型中表现得更明显,其可能原因是由于ε4基因本身的不良预后,可以通过注射外源性apoE拟肽得到更好的改善。这也说明在缓解脑水肿和改善神经功能损伤方面,apoE拟肽不仅可以运用于ε3/3基因型,而且在具有不良预后的ε4/4基因型中可以达到更好的治疗效果。
对于ε4小鼠来说,apoE拟肽虽然具有缓解脑水肿和改善神经功能损伤的作用,但却不具有减轻轴突损伤的作用,这不仅说明apoE拟肽对于减轻轴突损伤和缓解脑水肿的作用机制是分离的,而且说明apoE4蛋白可以抑制apoE拟肽对轴突损伤的保护作用,其潜在原因可能是由于aopE4蛋白和apoE拟肽具有一定相同的蛋白分子结构,apoE4蛋白可以比apoE拟肽更好的结合相应的配体结构位点,却不发生相应的作用效果,减少了apoE拟肽对相应位点的结合,故而不表现出对轴突损伤的保护作用。进一步猜想,apoE4蛋白除了与外源性apoE拟肽发生了竞争性抑制外,是否也与apoE3蛋白产生一定的竞争性抑制。有研究结果发现,在阿尔茨海默病(alzheimer disease,AD)中,携带杂合子ε3/4的患者与携带纯合子ε4/4的患者一样,都更容易产生不良的预后[15],其一方面可能是机体内apoE3蛋白的不足,另一方面可能是apoE4蛋白竞争性抑制apoE3蛋白对神经系统的保护作用。因此,APOE4基因作为一种高危基因,其不利因素除了缺乏apoE优势蛋白的抗炎和神经保护作用,同时也具有抑制apoE优势蛋白在某些方面的神经保护作用。另一方面,在ε3和APOE(-/-)鼠中,COG1410具有降低APP沉积,减轻轴突损伤的作用,说明在apoE拟肽保护轴突损伤的过程中,apoE3蛋白可以和外源性apoE拟肽共存,不会与其发生竞争性抑制,不会影响apoE拟肽对轴突损伤的保护作用。因此在治疗急性期轴突损伤方面,将apoE拟肽运用于ε3/3基因型是可行的。
然而,本实验也存在相应缺陷,首先,所测指标仅包括脑水肿、神经功能学以及轴突损伤情况,对于早期脑损伤的检测指标还有很多,比如炎症因子、小胶质细胞的活化以及代谢指标和影像学资料,这些都需要我们进一步证实apoE拟肽在早期脑损伤的作用效果[16, 17];其次,本实验动物模型都是ε3和ε4的纯合子,想要更好的模拟人类用药,还需要对于APOE杂合子进行证实研究。
综上所述,COG1410作为一种新型的apoE拟肽,在APOEε3/3、APOEε4/4基因型都具有一定的神经保护作用。将其开发作为一种神经保护药物运用于临床,是非常有前途的新方案。
| [1] | Laskowitz D T, Vitek M P. Apolipoprotein E and neurological disease: therapeutic potential and pharmacogenomic interactions [J]. Pharmacogenomics, 2007, 8: 959-969. |
| [2] | Jiang Y, Sun X, Xia Y, et al. Effect of APOE polymorphisms on early responses to traumatic brain injury[J]. Neuroscience letters, 2006, 408(2): 155-158. |
| [3] | Jiang Y, Brody D L. Administration of COG1410 reduces axonal amyloid precursor protein immunoreactivity and microglial activation after controlled cortical impact in mice[J]. Journal of neurotrauma, 2012, 29(13): 2332-2341. |
| [4] | Wang H, Durham L, Dawson H, et al. An apolipoprotein E-based therapeutic improves outcome and reduces Alzheimer's disease pathology following closed head injury: evidence of pharmacogenomic interaction[J]. Neuroscience, 2007, 144(4): 1324-1333. |
| [5] | James M L, Sullivan P M, Lascola C D, et al. Pharmacogenomic effects of apolipoprotein e on intracerebral hemorrhage[J]. Stroke, 2009, 40(2): 632-639. |
| [6] | Laskowitz D T, Song P, Wang H, et al. Traumatic brain injury exacerbates neurodegenerative pathology: improvement with an apolipoprotein E-based therapeutic[J]. Journal of neurotrauma, 2010, 27(11): 1983-1995. |
| [7] | Brody D L, Mac Donald C, Kessens C C, et al. Electromagnetic controlled cortical impact device for precise, graded experimental traumatic brain injury[J]. Journal of neurotrauma, 2007, 24(4): 657-673. |
| [8] | Wang H, Aanderson L G, Lascola C D, et al. ApolipoproteinE mimetic peptides improve outcome after focal ischemia [J]. Exp Neurol, 2012, 241: 67-74. |
| [9] | Hoane M R, Kaufman N, Vitek M P, et al. COG1410 improves cognitive performance and reduces cortical neuronal loss in the traumatically injured brain[J]. Journal of neurotrauma, 2009, 26(1): 121-129. |
| [10] | Wang R, Hong J, Lu M, et al. ApoE mimetic ameliorates motor deficit and tissue damage in rat spinal cord injury[J]. Journal of neuroscience research, 2014, 92(7): 884-892. |
| [11] | Laskowitz D T, Lei B, Dawson H N, et al. The apoE-mimetic peptide, COG1410, improves functional recovery in a murine model of intracerebral hemorrhage[J]. Neurocritical care, 2012, 16(2): 316-326. |
| [12] | Kaufman N A, Beare J E, Tan A A, et al. COG1410, an apolipoprotein E-based peptide, improves cognitive performance and reduces cortical loss following moderate fluid percussion injury in the rat[J]. Behavioural brain research, 2010, 214(2): 395-401. |
| [13] | 江涌, 孙晓川, 夏玉先, 等. 载脂蛋白 E 基因多态性与颅脑损伤的相关性[J]. 中华创伤杂志, 2005, 21(7): 520-523. |
| [14] | Laskowitz D T, McKenna S E, Song P, et al. COG1410, a novel apolipoprotein E-based peptide, improves functional recovery in a murine model of traumatic brain injury[J]. Journal of neurotrauma, 2007, 24(7): 1093-1107. |
| [15] | Xu P T, Li Y J, Qin X J, et al. A SAGE study of apolipoprotein E3/3, E3/4 and E4/4 allele-specific gene expression in hippocampus in Alzheimer disease[J]. Molecular and Cellular Neuroscience, 2007, 36(3): 313-331. |
| [16] | 江涌, 孙晓川, 陈礼刚, 等. APOE基因亚型及其短肽COG1410对神经细胞损伤后早期凋亡的影响[J].第三军医大学学报,2014,36(6): 548-552. |
| [17] | 吴海涛, 江涌, 张晓冬, 等. 载脂蛋白 E 基因多态性影响星形胶质细胞损伤后早期 NF-κB 表达的实验研究[J]. 第三军医大学学报, 2010,32(2): 103-106. |



