2400037 重庆,第三军医大学新桥医院消化内科
2Department of Gastroenterology,Xinqiao Hospital,Third Military Medical University,Chongqing,400037,China
急性胰腺炎(acute Pancreatitis AP)是多种病因导致胰酶在胰腺内被激活后引起胰腺组织自身消化、水肿、出血甚至坏死的炎症反应,起病急,预后差,重者多伴有休克、多器官功能衰竭等严重并发症,临床病死率近30%,因此急性胰腺炎的发病机制一直是人们研究的热点。急性胰腺炎的发病机制复杂,目前公认的发病机制包括:胰酶异常激活学说、炎症因子学说、胰腺微循环障碍、肠道菌群易位学说以及钙超载学说[1]。钙超载是指细胞质内空间性的钙释放,近年众多报道都已证实胆汁酸、酒精代谢产物等刺激腺泡细胞后,可以导致细胞内Ca2+的异常积聚,而胞内的钙负载又促进了胰蛋白酶原的过度活化,引起胰腺自身消化性损伤[2, 3]。文献[4]报道细胞内Ca2+ 的上升幅度与胰腺的病理变化呈正相关。因此,曾有国外学者提出钙超载是急性胰腺炎发生的“扳机点”(trigger point)[5]。
钙超载的发生主要有两个重要机制:细胞内过多的钙集聚以及降钙机制的破坏,其中前一机制起主要作用,细胞内的钙集聚通常由内质网Ca2+ 释放(PLC-IP3通路)以及细胞膜上钙通道介导的细胞外Ca2+ 跨膜内流造成[6]。目前如CRAC钙通道、TRPV1通道、TRPC3钙通道等均有文献报道和AP钙超载相关,而钠钙交换体作为调控钙离子重要的双向通道,是否也和AP钙超载有关,至今尚少见报道。
钠钙交换体首见报道于枪乌贼巨大神经轴突及豚鼠心脏上[7],作为细胞膜上一种重要的双向转运蛋白已被证实在胰腺、心肌、神经元等多种组织中均有表达,NCX有3个亚型:NCX1、NCX2、NCX3,近年来NCX1因在人类生理及疾病的研究中具有重要作用而颇受关注。钠钙交换体NCX1具备钙外排及钙内流的双向调控模式(当其被激活时会将3个钠离子转运至细胞内/外,同时将一个钙离子移出/入细胞),生理状态下NCX1是钙外排的主要途径,例如在生理性的胰岛素分泌时NCX1的作用是泵出胞浆内多余钙离子以维持生理功能的平衡[8, 9]。而在一些病理状态下NCX1的离子转运方向发生抑转[10]。以往文献报道在脑缺血损伤、肝癌增殖等病理过程中细胞内钙离子均明显增高,而NCX1在上述病理过程中的作用就是将外钙泵入,导致细胞内钙离子浓度增加,从而引起下游一系列生物学效应[11, 12]。
那么钠钙交换体NCX1作为胞膜上重要的钙离子调节通道,是否介导了急性胰腺炎钙超载的发生,并进一步通过上调其表达水平共同促进急性胰腺炎的发展。因此,本研究拟在大鼠胰腺腺泡细胞中及大鼠AP模型内验证钠钙交换体NCX1在急性胰腺炎发生、发展中的相关作用。
1 材料与方法 1.1 主要材料原代大鼠胰腺腺泡细胞为本实验室自己分离,SD雄性大鼠购自第三军医大学实验动物中心。
1.2 试剂与仪器1640细胞培养液及胎牛血清(美国HyClone公司),雨蛙素、Ⅰ型胶原酶及大豆胰蛋白酶原抑制剂(美国Sigma-Aldrich公司),NCX1、IL-6、TNF-α抗体(Abcam公司),反转录试剂盒(日本TaKaRa公司),生化分析仪(美国Beckman公司)。
1.3 细胞分离及培养 1.3.15~6周龄雄性SD大鼠,体质量180~220 g,禁食不禁水12 h,腹腔注射无菌麻药致死后迅速摘取胰腺组织放入盛有HEPES缓冲液的平皿中(缓冲液:130 mmol/L NaCl,5 mmol/L KCl,10mmol/L HEPES,11 mmol/L 葡萄糖,9 mmol/L丙酮酸钠,1 mmol/L MgCl2·6H2O,1 mmol/L CaCl2,0.01% 胰蛋白酶原抑制剂,4 μmol/L NaOH调整pH值为7.4)。
1.3.2尽量摘除胰腺组织中的血管、淋巴及筋膜组织,用缓冲液清洗干净,用5 mL缓冲液配制混合消化液(含2 mg/mLⅠ型胶原酶和1mg/mL胰蛋白酶原抑制剂)。用配制成的消化液在胰腺被膜下多点注射,使成发泡状。
1.3.3在平皿内将胰腺组织剪成0.5 mm3左右大小碎片,移入25 mL三角烧瓶中,37 ℃振荡水浴,20 min后改用新的混合消化液5 mL处理,过程中用滴管轻轻吹打,约10 min。
1.3.4直至显微镜下见大量由数个胰腺腺泡细胞围成的腺泡团,150目不锈钢网筛过滤,用含4%的牛血清白蛋白的缓冲液终止消化,将分离的胰腺腺泡细胞重悬于含20%小牛血清的1640培养基,放入37 ℃、5% CO2孵箱平衡30 min恢复其活力。
1.3.5用4%的台盼蓝染色,活力大于90%后证实细胞分离成功,进行下一步实验[13, 14]。
1.4 实验分组及胰腺炎模型的诱导 1.4.1 细胞实验分组及方法实验分阴性对照组、雨蛙素组、雨蛙素+NCX1抑制剂组共3组,雨蛙素组在胰腺腺泡细胞中按照每孔(约1.5×106个细胞)加入10-7 mol/L雨蛙素作用1 h[13];阴性对照组加入等量PBS;雨蛙素+NCX1抑制剂组提前30 min按10-6mol/L加入NCX1特异性抑制剂KB-R7943[15]。在雨蛙素刺激1 h后收集细胞检测各组NCX1及炎症因子TNF-α、IL-6的表达。
1.4.2 动物实验分组及方法实验同样分为阴性对照组、雨蛙素组、雨蛙素+NCX1抑制剂组,每组3只大 鼠。雨蛙素组:在SD大鼠称质量后按照50 μg/(kg·h) 剂量腹腔注射雨蛙素[16],共6次;阴性对照组注射相应剂量无菌生理盐水;雨蛙素+NCX1抑制剂组在每次雨蛙素注射前30 min按3×10-6 mol/(kg·h)腹腔注入NCX1特异性抑制剂KB-R7943,共6次。诱导结束后6 h同时麻醉处死大鼠[16]。
1.5 qRT-PCR检测使用TRIzol提取总RNA,将总RNA逆转录为cDNA,采用SYBR Green两步法进行PCR扩增反应:95 ℃预变性30 s;95 ℃变性5 s;60 ℃退火30 s,扩增40个 循环。GAPDH作为内参,每个标本设置3个复孔。
1.6 Western blot检测SDS裂解液提取总蛋白,沸水浴5 min使蛋白变性,使用RCDC法测定蛋白浓度,每孔上样量80 μg进行SDS-PAGE电泳。常规湿转法转膜,5%脱脂奶粉室温封闭2 h,一抗4 ℃孵育过夜(NCX1浓度稀释比例1 ∶3 000;TNF-α浓度稀释比例1 ∶1 000;IL-6浓度稀释比例1 ∶1 000;β-actin浓度稀释比例1 ∶500),二抗室温孵育1 h(兔抗1 ∶10 000;鼠抗1 ∶5 000)。ECL化学发光法显影。
1.7 胰腺组织苏木精-伊红染色取胰腺组织置于4%中性甲醛缓冲液固定,常规脱水、包埋、切片、HE染色,内镜下观察组织学改变情况。
1.8 血清淀粉酶测定采用第三军医大学新桥医院检验科Beckman生化分析仪测定AP模型大鼠血清淀粉酶浓度。在建模6 h后麻醉各组大鼠,抽取左心室血液3 mL,4 000 r/min 离心5 min后收取血液上清。
1.9 统计学处理应该SPSS 13.0统计软件分析,数据以x±s表示,两组间比较采用t检验或非参数秩和检验,多组间比较采用单因素方差分析。
2 结果 2.1 胰腺腺泡细胞的分离使用Ⅰ型胶原酶消化大鼠胰腺组织分离胰腺腺泡细胞,将分离的胰腺腺泡细胞重悬于含20%小牛血清的1640培养基,使用倒置显微镜观察,可见大量悬浮的呈球形的胰腺腺泡细胞,结果见图 1。

|
| 图 1 倒置显微镜观察使用Ⅰ型胶原酶分离大鼠的胰腺腺泡细胞变化 (×100) |
采用雨蛙素诱导胰腺腺泡细胞发生体外AP,分别 在雨蛙素加入后30 min,1、3、6、12 h检测NCX1、TNF-α mRNA的表达变化,筛选最佳雨蛙素刺激时间点。qRT-PCR结果显示在雨蛙素刺激腺泡细胞1 h后,NCX1表达达到高峰,变化最为明显,其表达量(3.205±0.428)较阴性对照组表达量(0.709±0.125)明显升高(P<0.01);与此同时TNF-α的表达量(1.823±0.265)较阴性对照组(0.408±0.03)也显著升高(P<0.01)。
2.3 NCX1抑制剂KB-R7943对AP中NCX1、TNF-α、IL-6 mRNA表达变化的影响选取1 h为最佳作用时间点,采用雨蛙素诱导胰腺腺泡细胞发生体外AP,qRT-PCR实验结果显示雨蛙素组的NCX1 mRNA表达量(16.044±0.692)明显高于阴性对照组(1.000±0.134)(P<0.001);TNF-α mRNA表达量(2.121±0.255)明显高于阴性对照组(1.000±0.110)(P<0.01);同时IL-6 mRNA表达量(7.469±0.813)也明显高于阴性对照组(1.000±0.431)(P<0.01)。而当加入NCX1特异性抑制剂KB-R7943处理细胞后,qRT-PCR结果显示雨蛙素+NCX1抑制剂组的NCX1 mRNA表达量(0.386±0.175)明显低于雨蛙素组(P<0.001);TNF-α mRNA表达量(0.691±0.149)明显低于雨蛙素组(P<0.01);同时IL-6 mRNA表达量(0.506±0.173)也明显低于雨蛙素组(P<0.01)。这表明NCX1抑制剂KB-R7943能明显下调雨蛙素诱导的AP中NCX1、TNF-α、IL-6 mRNA的增高。
2.4 雨蛙素刺激胰腺腺泡细胞后不同时间点NCX1蛋白表达水平的变化采用雨蛙素诱导胰腺腺泡细胞发生体外AP后,分别在雨蛙素加入后30 min,1、3、6、12 h检测NCX1蛋白的表达变化,Western blot结果显示雨蛙素刺激细胞1 h后,NCX1蛋白水平较阴性对照组明显升高(P<0.05,图 2)。

|
| 1:阴性对照组;2:雨蛙素刺激30 min;3:雨蛙素刺激1 h;4:雨蛙素刺激3 h;5:雨蛙素刺激6 h;6:雨蛙素刺激12 h 图 2 Western blot检测雨蛙素刺激腺泡细胞后NCX1在不同时间点蛋白表达水平的变化 |
选取1 h为最佳时间点,采用雨蛙素诱导胰腺腺泡细胞发生体外AP,Western blot 检测结果显示雨蛙素组NCX1及炎症因子TNF-α、IL-6的蛋白表达较阴性对照组均明显上调(P<0.01)。而当使用NCX1特异性抑制剂KB-R7943处理细胞后,NCX1以及炎症因子TNF-α、IL-6的蛋白表达水平较雨蛙素组均明显下降(P<0.05)。由此可见,NCX1抑制剂KB-R7943能明显下调雨蛙素诱导的AP中NCX1、TNF-α、IL-6 的蛋白增高(图 3)。
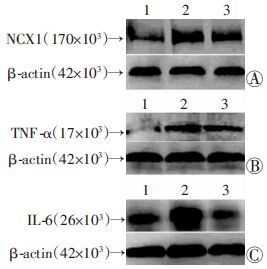
|
| 1:阴性对照组;2:雨蛙素组;3:雨蛙素+NCX1抑制剂组 a:P<0.01,与阴性对照组比较;b:P<0.05,与雨蛙素组比较:c: P<0.01,与雨蛙素组比较 图 3 Western blot检测各组胰腺腺泡细胞中NCX1(A)、 TNF-α(B)、IL-6(C)的蛋白表达变化 |
各组大鼠胰腺组织经HE染色,镜下见阴性对照组胰腺腺泡排列规则,腺泡腔完整,无炎性细胞浸润,未见充血、水肿及坏死等。而雨蛙素组镜下可见胰腺叶间隔及小叶间隔距离增宽,伴有炎性细胞浸润,血管充血扩张,以及散在多发坏死。在雨蛙素+NCX1抑制剂组可见腺腺泡排列基本规则,腺泡腔大部分完整,胰腺叶间隔及小叶间隔距离有所增宽,有少量炎性细胞浸润,无明显血管扩张及充血坏死。可见使用NCX1特异性抑制剂KB-R7943后,其胰腺组织的病理改变较雨蛙素组明显减轻(图 4)。
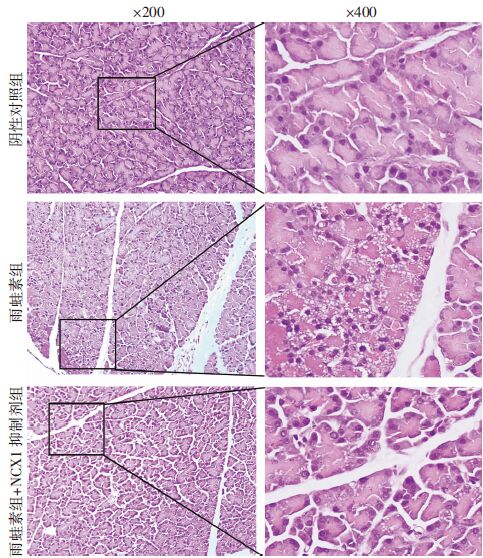
|
| 图 4 各组胰腺组织病理学变化 (HE) |
采用生化分析仪测定各组AP模型大鼠血清淀粉 酶浓度。结果显示雨蛙素组血清淀粉酶浓度(1 938.15± 99.97)IU/L明显高于阴性对照组(322.01±20.70)IU/L (P<0.001)。而同时腹腔注射NCX1特异性抑制剂KB-R7943后,其血清淀粉酶浓度(1 192.47±93.59)IU/L较雨蛙素组有明显下降(P<0.01)。
2.8 NCX1抑制剂KB-R7943对AP模型大鼠胰腺组织内NCX1、TNF-α、IL-6 mRNA表达的影响采用雨蛙素腹腔注射SD大鼠建立急性胰腺炎模型6 h后,麻醉致死大鼠。提取胰腺组织总RNA,qRT-PCR检测各组大鼠胰腺组织中NCX1以及炎症因子TNF-α、IL-6 mRNA的表达。结果显示雨蛙素组的NCX1 mRNA表达量(0.527±0.059)明显高于阴性对照组(0.237±0.034)(P<0.01);TNF-α mRNA表达量(0.920±0.260)明显高于阴性对照组(0.173±0.063)(P<0.01);IL-6 mRNA表达量(0.507±0.006)也明显高于阴性对照组(0.127±0.078)(P<0.01)。而当加入NCX1特异性抑制剂KB-R7943后,雨蛙素+抑制剂组的NCX1 mRNA表达量(0.158±0.059)明显低于雨蛙素组(P<0.01);TNF-α mRNA 表达量(0.362±0.065)明显低于雨蛙素组(P<0.01); IL-6 mRNA表达量(0.290±0.053)也明显低于雨蛙素组(P<0.05)。这就说明在大鼠体内,NCX1抑制剂KB-R7943也能够明显下调AP中NCX1及炎症因子TNF-α、IL-6 mRNA的增高。
3 讨论近年来钙超载学说在急性胰腺炎发病机制的研究中逐渐受到重视。已有文献报道证实,当可诱导急性胰腺炎发生的超强刺激因素如酒精代谢产物、胆汁酸、脂肪酸等破坏了腺泡细胞内Ca2+ 的平衡时,其内质网Ca2+ 储存池消耗殆尽,进而诱发细胞外钙离子大量涌入胞内,而胞液中持续的Ca2+ 升高将会导致胰蛋白酶原的异常激活[17],使得细胞大量坏死。而当腺泡细胞的应答不强烈时,Ca2+ 从内质网储存池中释放不完全,细胞的坏死发生也相对减少。可见钙超载导致的腺泡内胰蛋白酶原的异常激活,进而引发的自身消化是急性胰腺炎发生的关键事件[18]。
文献[19, 20]报道CRAC钙通道、TRPV1通道、TRPC3钙通道等与AP的发生有密切关系,但给予上述钙通道特异性的阻断剂或者通过shRNA敲除其表达后,并不能完全抑制因刺激因素导致的细胞内钙升高,只能在一定程度上有效的降低钙超载的程度。由此可见,上述离子通道并非是介导AP钙超载的唯一途径,必然还存在着其他参与钙超载调控的钙离子通道。因此,本研究就钠钙交换体NCX1在促进急性胰腺炎发生、发展中的作用进行探讨。
首先我们从大鼠胰腺中分离胰腺腺泡细胞,采用雨蛙素孵育诱导体外急性胰腺炎发生。Western blot和qRT-PCR结果证实在AP中NCX1蛋白及其mRNA表达水平较阴性对照组明显升高,炎症因子TNF-α、IL-6在蛋白和mRNA表达水平较阴性对照组也显著上调。而当加入NCX1特异性抑制剂KB-R7943预处理腺泡细胞后,NCX1蛋白及mRNA的表达水平较雨蛙素组均明显下调;同时TNF-α、IL-6在蛋白和mRNA水平较雨蛙素组也显著下调。文献[14, 21, 22]报道在AP中,胰腺腺泡细胞能够通过自身分泌炎症细胞因子,促进白细胞向损伤胰腺组织趋化,加重局部及全身炎症反应,促进腺泡细胞坏死。这就从细胞水平说明钠钙交换体NCX1与急性胰腺炎的发生、发展密切相关,而抑制钠钙交换体NCX1可有效降低钙超载,从而减轻腺泡细胞自身分泌的AP相关炎症因子水平,进而可以减轻AP炎症反应。
当然急性胰腺炎发生是复杂的病理生理过程,各因素之间既互相独立又相互渗透,共同促进AP的发生、发展,选择性建立动物AP模型是探讨其发病机制和治疗策略的新视窗。所以我们进一步采用雨蛙素注射大鼠腹腔建立动物胰腺炎模型[12],发现雨蛙素组AP大鼠的血清淀粉酶较阴性对照组正常大鼠明显升高(P<0.001);而抑制NCX1后,大鼠血清淀粉酶较雨蛙素组又明显下降(P<0.01)。此外我们通过qRT-PCR也验证了在雨蛙素组大鼠胰腺组织中NCX1及炎症因子TNF-α、IL-6 mRNA较阴性对照组有明显 上调;而通过KB-R7943抑制NCX1后,其NCX1、TNF-α 及IL-6 mRNA较雨蛙素组又显著下调。这表明在AP模型大鼠中,抑制NCX1功能后可以明显抑制与急性胰腺炎相关的炎症因子及淀粉酶的升高。最后我们观察了AP模型大鼠的胰腺组织学改变,HE染色结果显示当我们使用NCX1特异性抑制剂KB-R7943后,与雨蛙素组大鼠相比,胰腺组织的病理改变明显减轻,这就充分说明抑制NCX1后可以有效减轻、缓解大鼠急性胰腺炎的严重程度。
| [1] | Sah R P, Garg P, Saluja A K. Pathogenic mechanisms of acute pancreatitis[J]. Curr Opin Gastroenterol, 2012, 28(5): 507-515. |
| [2] | Petersen O H, Tepikin A V, Gerasimenko J V, et al. Fatty acids, alcohol and fatty acid ethyl esters: toxic Ca2+ signal generation and pancreatitis[J]. Cell Calcium, 2009, 45(6): 634-642. |
| [3] | Weber H, Roesner J P, Nebe B, et al. Increased cytosolic Ca2+ amplifies oxygen radical-induced alterations of the ultrastructure and the energy metabolism of isolated rat pancreatic acinar cells[J]. Digestion, 1998, 59(3): 175-185. |
| [4] | Yamaguchi Y, Akizuki E, Matsumura F, et al. Intracellular calcium affects neutrophil chemoattractant expression by macrophages in rats with cerulean-induced pancreatitis[J]. Dig Dis Sci, 1998, 43(4): 863-869. |
| [5] | Ward J B, Petersen O H, Jenkins S A, et al. Is an elevated concentration of acinar cytosolic free ionised calcium the trigger for acute pancreatitis?[J]. Lancet, 1995, 346(8981): 1016-1019. |
| [6] | Li J, Zhou R, Zhang J, et al. Calcium signaling of pancreatic acinar cells in the pathogenesis of pancreatitis[J]. World J Gastroenterol, 2014, 20(43): 16146-16152. |
| [7] | Mukai M, Terada H, Sugiyama S, et al. Effects of a selective inhibitor of Na+/Ca2+ exchange, KB-R7943, on reoxygenation-induced injuries in guinea pig papillary muscles[J]. J Cardiovasc Pharmacol, 2000, 35(1): 121-128. |
| [8] | Herchuelz A, Kamagate A, Ximenes H, et al. Role of Na/Ca exchange and the plasma membrane Ca2+ ATPase in beta cell function and death[J]. Ann N Y Acad Sci, 2007, 1099: 456-467. |
| [9] | Hamming K S, Soliman D, Webster N J, et al. Inhibition of beta-cell sodium-calcium exchange enhances glucose-dependent elevations in cytoplasmic calcium and insulin secretion[J]. Diabetes, 2010, 59(7): 1686-1693. |
| [10] | Khananshvili D. Sodium-calcium exchangers (NCX): molecular hallmarks underlying the tissue-specific and systemic functions[J]. Pfluger Arch, 2014, 466(1): 43-60. |
| [11] | Dong H, Shim K N, Li J M, et al. Molecular mechanisms underlying Ca2+-mediated motility of human pancreatic duct cells[J]. Ann J Physiol Cell Physiol, 2010, 299(6): C1493-C1503. |
| [12] | Sathish V, Delmotte P F, Thompson M A, et al. Sodium-calcium exchange in intracellular calcium handling of human airway smooth muscle[J]. PLoS One, 2011, 6(8): e23662. |
| [13] | Tamizhselvi R, Koh Y H, Sun J, et al. Hydrogen sulfide induces ICAM-1 expression and neutrophil adhesion to caerulein-treated pancreatic acinar cells through NF-kappaB and Src-family kinases pathway[J]. Exp Cell Res, 2010, 316(9): 1625-1636. |
| [14] | 付兰英, 饶春燕, 赵晓晏. 硫化氢对离体大鼠胰腺腺泡细胞炎症因子表达的影响[J]. 第三军医大学学报, 2013, 35(8): 784-788. |
| [15] | Chang P C, Wo H T, Lee H L, et al. Paradoxical effects of KB-R7943 on arrhythmogenicity in a chronic myocardial infarction rabbit model[J]. J Cardiol, 2014, [Epub ahead of print]. |
| [16] | Kim M S, Hong J H, Li Q, et al. Deletion of TRPC3 in mice reduces store-operated Ca2+ influx and the severity of acute pancreatitis[J]. Gastroenterology, 2009, 137(4): 1509-1517. |
| [17] | Criddle D N, Gerasimenko J V, Baumgartner H K, et al. Calcium signalling and pancreatic cell death: apoptosis or necrosis?[J]. Cell Death Differ, 2007, 14(7): 1285-1294. |
| [18] | Gerasimenko J V, Gerasimenko O V, Petersen O H. The role of Ca2+ in the pathophysiology of pancreatitis[J]. J Physiol, 2014, 592(Pt 2): 269-280. |
| [19] | Gerasimenko J V, Gryshchenko O, Ferdek P E, et al. Ca2+ release-activated Ca2+ channel blockade as a potential tool in antipancreatitis therapy[J]. Proc Natl Acad Sci U S A, 2013, 110(32): 13186-13191. |
| [20] | Vigna S R, Shahid R A, Liddle R A. Ethanol contributes to neurogenic pancreatitis by activation of TRPV1[J]. FASEB J, 2014, 28(2): 891-896. |
| [21] | Gukovskaya A S, Gukovsky I, Zaninovic V, et al. Pancreatic acinar cells produce, release, and respond to tumor necrosis factor-alpha. Role in regulating cell death and pancreatitis[J]. J Clin Invest, 1997, 100(7): 1853-1862. |
| [22] | Ramudo L, Manso M A, Vicente S, et al. Pro- and anti-inflammatory response of acinar cells during acute pancreatitis. Effect of N-acetyl cysteine[J]. Cytokine, 2005, 32(3/4): 125-131. |



