2. 口腔疾病与生物医学重庆市重点实验室;
3. 口腔疾病与生物医学重庆市重点实验室
2. Chongqing Key Laboratory of Oral Diseases and Biomedical Sciences;
3. Key Laboratory of Oral Biomedical Engineering of Chongqing Colleges and Universities, the Stomatological Hospital of Chongqing Medical University, Chongqing, 401147, China
骨质疏松(osteoporosis,OP)是以骨量丢失且易发骨折的一种全身代谢性疾病,约50%绝经后妇女的骨折与骨质疏松有关[1]。骨髓贴壁基质细胞(mesenchymal stem cells,MSCs)是存在于骨髓中的多能干细胞,其作为成骨细胞的前体细胞在OP发病过程中发挥着重要的作用[2]。研究表明MSCs增殖能力的降低会导致OP的发生[3]。MSCs存在雌激素受体,在雌激素缺乏所导致的骨质疏松症的病理环境下,MSCs的生物学特性发生改变,进而加剧了骨质疏松症的发生和发展,然而其中的机制仍不明确。近年来,microRNA已成为研究的热点,其在调控干细胞的增殖与分化过程中发挥着重要的作用[4, 5, 6]。细胞自身microRNA表达的改变将影响其状态及生物学功能[7, 8]。有研究报道miR-181a参与调控细胞的增殖[9, 10]。那么miR-181a是否能够调控MSCs的增殖?本实验采用雌激素缺乏下骨质疏松症小鼠为模型,将骨质疏松症的MSCs与正常小鼠的MSCs中miR-181a的表达进行对比,探寻miR-181a能否调控骨髓贴壁基质细胞的增殖,进而在骨质疏松症的发生、发展中发挥作用。
1 材料与方法 1.1 材料 1.1.1 动物模型建立选取8周龄健康C57BL/6雌性小鼠(第四军医大学实验动物中心提供)20只,1%戊巴比妥钠腹腔麻醉后,经双侧腹下区手术切口摘除双侧卵巢,为OVX组;另选20只行腹腔麻醉后,于其双侧腹下区取少量脂肪组织,为假手术组(Sham组)。小鼠在无特殊致病源(SPF)级动物房饲养8周。
1.1.2 实验材料α-MEM培养基和胰蛋白酶购于美国Gibco公司;胎牛血清购于浙江天杭生物科技有限公司;细胞总RNA提取试剂盒和一步法RT-PCR试剂盒购于大连TaKaRa公司;siPORTTM NeoFXTM转染试剂购于美国Ambion公司;化学合成miR-181a购于广州锐博生物科技有限公司;CD3及CD28抗体购于美国Ambion公司。
1.2 实验方法 1.2.1 Micro-CT扫描鉴定骨质疏松模型将术后2个 月的C57BL/6小鼠用1%戊巴比妥钠麻醉(依据小鼠体质量,麻药浓度比例为0.3 mL/100 g),待小鼠处于麻醉状态时,用胶带固定小鼠前后肢,进行Micro-CT (GE公司,美国)扫描,观察小鼠股骨骭骺端骨密度变化。
1.2.2 血清雌二醇水平检测小鼠在处理前采眼眶血,分离出血清,用小鼠雌激素酶联免疫吸附测定试剂盒测定血清雌二醇水平。
1.2.3 小鼠骨髓贴壁基质细胞原代培养及纯化将断颈处死后的C57BL/6小鼠酒精浸泡5 min,超净台内分离其股骨,用培养液冲出骨髓,轻柔吹打并制成单细胞悬液,置于培养皿中,加入10 mL α-MEM(含20% FBS),隔2 d换液,待细胞密度至80%传代。
1.2.4 MSCs细胞表型鉴定将生长状态较好的P3代细胞消化后,用含3% FBS的PBS清洗1次后重悬,分别加入CD29、CD34、CD105、CD45,4 ℃避光1 h,1 000 r/min离心5 min,弃上清,用含3% FBS的PBS清洗2次,再次重悬,流式细胞仪检测。
1.2.5 MSCs成骨诱导及茜素红染色取P3代细胞,接种于6孔板中(2×105/孔),成骨诱导液诱导,隔2 d换液1次,21 d后,PBS清洗2遍,多聚甲醛室温固定20 min,PBS清洗2遍,加入茜素红染液,37 ℃染色1 h,PBS清洗2遍,拍照。
1.2.6 MSCs成脂诱导及油红O染色取P3代细胞,接种于6孔板中(2×105/孔),成脂诱导液培养,隔2 d换液1次,14 d后,PBS清洗2遍,多聚甲醛室温固定20 min,PBS清洗2遍,用油红染色,室温1 h,PBS清洗2遍,拍照。
1.2.7 MTT检测MSCs的增殖能力取P3代细胞常规消化离心,计数,以2 500/孔设置7组,每组7孔(6个复孔,1个对照孔)接种于96孔板,180 μL培养液培养7 d,每天定时检测细胞增殖能力。检测时每孔加20 μL MTT(5 g/L) 37 ℃孵育4 h后,弃上清液,加入150 μL二甲基亚砜,避光充分振荡10 min,酶标仪选取490 nm测定光密度值[D(490)],以时间为横轴,D(490)值为纵轴绘制生长曲线。
1.2.8 Real-time PCR检测miR-181a miRNA表达分别收集去势小鼠组和假手术组P3代细胞用PBS洗2次,加入1 mL TRIzol,提取细胞总RNA,琼脂糖凝胶电泳检测RNA纯度,将获取的RNA用反转录试剂盒合成cDNA,参照GenBank数据库及软件设计引物(表 1);RT-PCR检测miRNA-181a的表达(反应体系及反应条件)参照产品说明。
| 基因 | 引物序列 |
| U6 | 上游:5′-CTCGCTTCGGCAGCACA-3′ 下游:5′-AACGCTTCACGAATTTGCGT-3′ |
| miR-181a | 上游:5′-AACATTCAACGCTGTCGGTGAGT-3′ 下游:5′-CTCCTTAGAATCTGTTTGCTCTCATA-3′ |
稀释siPORT TM NeoFXTM 转染试剂:用50 μL不含血清培养基稀释1 μL,轻轻混匀并室温孵育5 min;稀释miRNA用50 μL不含血清培养基稀释0.25 μL、20 μmol 的miRNA mimic(0.5 μL 20 μmol的inhibitor)存储液,轻轻混匀,室温孵育5 min。将稀释后的siPORT TM NeoFXTM 转染试剂与稀释后的miRNA轻轻混匀,室温10 min静置后加入含有细胞的96孔板,置于37 ℃的CO2培养箱48 h。
1.3 统计学分析实验重复3次以上,采用SPSS 11.0统计软件进行分析,多组间总体比较用方差分析,两两独立样本比较用t检验。
2 结果 2.1 血清雌二醇水平测定小鼠术后2个月,对2组小鼠血清雌二醇水平进 行检测,发现OVX组20只小鼠血清雌二醇水平为(48.88±17.89)pg/mL,Sham组20只小鼠血清雌二醇水平为(10.44±3.80)pg/mL,OVX组显著低于Sham组(P < 0.05)。
2.2 Micro-CT分析骨参数结果小鼠术后2个月,为了验证骨质疏松症模型是否构建成功,进而分析了OVX组与Sham组小鼠骨体积分数(BV/TV)、骨表面积体积比(BS/BV)、骨小梁厚度(Tb.Th)、骨小梁数量(Tb.N)及骨小梁分离度(Tb.Sp),结果表明2组差异均有统计学意义(P < 0.05,图 1、表 2)。
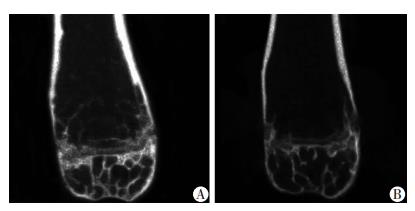 |
| A:假手术组;B:去势组 图 1 OVX及Sham组Micro-CT二维表现 |
| (n=20,x±s) | ||||||
| 组别 | BV/TV(%) | BS/BV(1/mm) | Tb.Th(mm) | Tb.N(1/mm) | Tb.Sp(mm) | BMD(mg/cc) |
| Sham组 | 19.25±3.42 | 26.34±2.22 | 0.821±0.07 | 2.21±0.3 | 0.33±0.11 | 435.78±19.45 |
| OVX组 | 6.34±2.69 | 36.38±3.15 | 0.042±0.02 | 4.32±0.6 | 0.81±0.11 | 267.33±17.33 |
为了验证实验培养的细胞为MSCs,进行了细胞表面标志及多向分化能力的鉴 定。P3代MSCs表型鉴定结果见图 2,结果表明Sham组细胞CD34表达率为4.3%,CD29表达率为76.6%,有68.5%的细胞表达CD73,有90.7%表达Sca-1(图 2A);OVX组细胞CD34表达率为4.6%,CD29表达率为77.1%,69.1%的细胞表达CD73,92.3%表达Sca-1(图 2B),提示分离培养的细胞为MSCs。
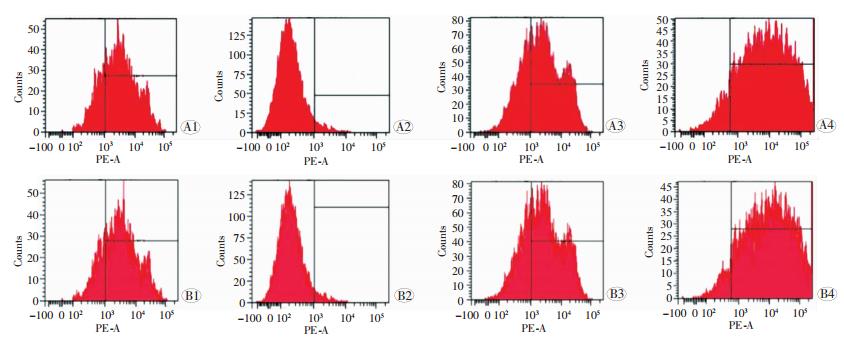 |
| A: Sham组 A1:CD29; A2:CD34; A3:CD73; A4:Sca-1; B: OVX组 B1:CD29; B2:CD34; B3:CD73; B4:Sca-1 图 2 P3代MSCs表型鉴定结果 |
MSCs成骨诱导21 d,镜下见钙盐沉淀,茜素红染色呈橘红色,中央区呈褐色,周边偏黄发亮。可见Sham组的矿化结节多于OVX组,经过十六烷基吡啶溶解钙化结节进行定量检测,Sham组光密度值高于OVX组。成脂诱导14 d后,镜下可见较多脂滴位于细胞内,脂滴成串珠样结构,油红O染色可见透亮的红色。经过异丙醇溶解脂滴进行定量检测,OVX组光密度值高于Sham组(图 3)。
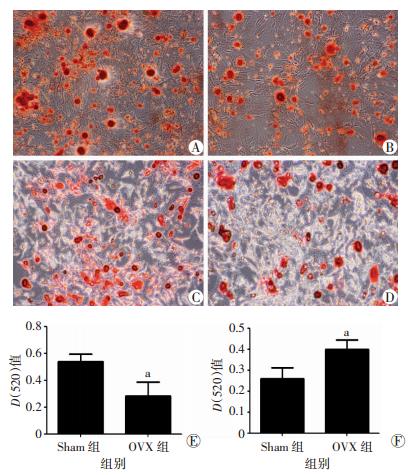 |
| A:Sham组成骨诱导(茜素红 ×100);B:OVX组成骨诱导(茜素红 ×100);C:Sham组成脂诱导(油红 ×100);D:OVX组成脂诱导(油红 ×100); E:两组MSCs成骨分化能力比较;F:两组MSCs成脂分化能力比较 a:P<0.05,与 Sham组比较 图 3 骨髓贴壁基质细胞的鉴定 |
MTT结果显示,Sham组与OVX组中的MSCs增殖活性在第4天起出现显著差异,Sham组MSCs的增殖能力显著高于OVX组(P < 0.05,图 4)。
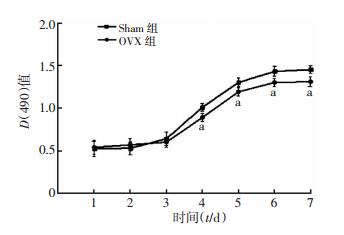 |
| a:P<0.05 ,与 Sham组比较 图 4 Sham组与OVX组小鼠MSCs生长曲线比较 |
结果显示,OVX组MSCs中miR-181a 的表达水平 为(1.38±0.09),Sham组为(0.91±0.05),OVX组MSCs 中miR-181a表达水平显著高于Sham组(P < 0.05)。
2.6 转染miR-181a后MSCs的增殖情况将Pre-181a、Pre-NC、ANT-181a、ANT-NC分别转染入MSCs,对各组转染后MSCs进行RT-PCR检测,发现Pre-181a组MSCs中miR-181a 的表达水平较Pre-NC组高,ANT-181a组MSCs中miR-181a 的表达水平较ANT-NC组高,差异均有统计学意义(P < 0.05,图 5)。MTT结果显示,Pre-181a组与Pre-NC组,ANT-181a组与ANT-NC组MSCs的增殖能力在第4天时差异有统计学意义(P < 0.05)。其中Pre-181a组较Pre-NC组显著降低(P < 0.05),而ANT-181a组较ANT-NC组显著增高(P < 0.05,图 6)。
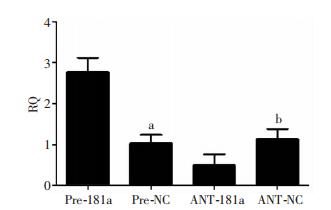 |
| a:P<0.05,与Pre-181a组;b:P<0.05,与ANT-181a组比较 图 5 转染miR-181a后各组miR-181a的表达 |
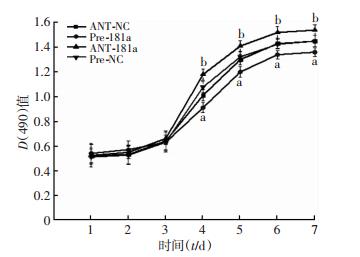 |
| a:P<0.05,与Pre-NC组比较,b:P<0.05,与ANT-NC组比较 图 6 转染miR-181a后各组MSCs的增殖能力比较 |
绝经后骨质疏松是由于雌激素缺乏引起的骨形成障碍的结果,雌激素能通过影响成骨细胞与破骨细胞的活性来维持骨形成与骨吸收的动态平衡[11]。骨髓贴壁基质细胞在适宜条件下能够通过分化形成多种中胚层组织,包括骨及骨髓基质结缔组织,参与维持骨的动态平衡,其在骨质疏松发病过程中发挥着重要的作用[12]。近年来,microRNA其在骨质疏松症中所发挥的作用受到了越来越多的关注。所以本实验探讨雌激素缺乏所致骨质疏松中雌激素水平降低对MSCs中miR-181a表达的影响,并调控相关靶基因影响MSCs的增殖能力。
本实验发现,将小鼠双侧卵巢摘除后2个月,其骨小梁数量、骨密度及骨体积分数与假手术组小鼠相比,均存在不同程度的降低,该结果与Kovacic等[13]发现的相一致。MSCs以多向分化和自我更新的能力为特征。目前,大多的研究主要聚焦于骨质疏松症病理环境下MSCs分化能力的改变,而对MSCs增殖能力的改变研究较少。Garcia-Moreno等[14]发现,在雌激素缺乏所致骨质疏松症中,MSCs能够表达Fas蛋白从而抑制其向成骨细胞放向分化,进一步加剧骨质疏松症的产生。Santiago-Mora等[15]发现骨质疏松症中MSCs的成骨能力较弱,而成脂能力较强。Yang等[16]发现,在雌激素缺乏所致骨质疏松症小鼠中存在某种因子导致MSCs的骨形成能力受损。并且在骨质疏松症小鼠中,MSCs在骨受损部位的成骨能力也有一定程度的降低,导致骨质疏松症骨损伤的加剧[17]。本实验发现,来源于骨质疏松症小鼠的MSCs成骨能力明显低于假手术组,而成脂能力明显强于假手术组,则进一步证明了该结论。更加令人感兴趣的是,本实验发现在骨质疏松症中MSCs的增殖能力弱于正常小鼠来源的MSCs,说明存在某种因素能够影响MSCs的生物学性能,进而影响骨质疏松症的发生和发展。miR-181a高表达于骨髓与胸腺中并参与调控造血干细胞的增殖与分化[18, 19]。miR-181a能调控间充质细胞中的TGF-β通路,TGF-β信号通路可影响大多数细胞的增殖,迁移及分化[20, 21]。研究发现miR-181a通过抑制TGF-β通路中的TGFBR1和TGFBRAP1两个靶基因调控间充质细胞的增殖[22]。本实验发现miR-181a在雌激素缺乏的骨质疏松症中其表达增高,表明雌激素缺乏的骨质疏松症的病理环境下,MSCs中miR-181a表达的改变,可能对MSCs的生物学特性产生一定作用。近期有研究发现,在人类骨质疏松症的病理环境中,存在某种microRNA能够调控成骨细胞的分化和增殖,进而可能对骨质疏松症的发生和发展产生影响[23]。而MSCs作为成骨细胞的前体细胞,miR-181a表达的改变影响MSCs的生物学性能,则更加可能加剧骨质疏松症的发生[24]。在本实验中人为上调或下调MSCs中的miR-181a的水平后,MSCs的增殖出现抑制或增强,提示miR-181a可能调控了促进细胞增殖的靶基因,miR-181a上调抑制了这些靶基因的转录后表达,减慢了MSCs的增殖过程。这与实验中OVX组MSCs中miR-181a表达增高,增殖能力降低相一致。值得思考的是在本实验中上调miR-181a后细胞增殖能力提高但仍不显著,对于这种轻度改变可能是因为生物体内与细胞增殖相关的靶基因会受到多个miroRNA共同调控。或者是一个microRNA调控一系列功能相互协同的microRNA来实现的[25]。因此后续实验将进一步探索miR-181a在MSCs中与增殖相关的靶基因。
综上所述,本实验证明了雌激素缺乏所致的骨质疏松症中miR-181a表达的改变能够影响MSCs自身增殖能力,为后续实验探讨绝经后骨质疏松的发生、发展提供了有力依据。
| [1] | Rachner T D, Khosla S, Hofbauer L C. Osteoporosis: now and the future[J]. Lancet, 2011, 377(9773): 1276-1287. |
| [2] | Teitelbaum S L. Stem cells and osteoporosis therapy[J]. Cell Stem Cell, 2010, 7(5): 553-554. |
| [3] | Rodriguez J P, Rios S, Fernandez M, et al. Differential activation of ERK1,2 MAP kinase signaling pathway in mesenchymal stem cell from control and osteoporotic postmenopausal women[J].J Cell Biochem, 2004, 92(4): 745-754. |
| [4] | Bartel D P. MicroRNAs: genomics, biogenesis, mechanism, and function[J]. Cell, 2004, 116(2): 281-297. |
| [5] | Khraiwesh B, Arif M A, Seumel G I, et al. Transcriptional control of gene expression by microRNAs[J]. Cell, 2010, 140(1): 111-122. |
| [6] | Plasterk R H. micro RNAs in animal development[J]. Cell, 2006, 124(5): 877-881. |
| [7] | Kosik K S. MicroRNAs and cellular phenotypy[J]. Cell, 2010, 143(1): 21-26. |
| [8] | Stadler B M, Ruohola-Baker H. Small RNAs: keeping stem cells in line[J]. Cell, 2008, 132(4): 563-566. |
| [9] | Chen G, Zhu W, Shi D, et al. MicroRNA-181a sensitizes human malignant glioma U87MG cells to radiation by targeting Bcl-2[J]. Oncol Rep, 2010, 23(4): 997-1003. |
| [10] | Li Q J, Chau J, Ebert P J, et al. miR-181a is an intrinsic modulator of T cell sensitivity and selection[J]. Cell, 2007, 129(1): 147-161. |
| [11] | Riggs B L, Khosla S, Melton L J 3rd. Sex steroids and the construction and conservation of the adult skeleton[J]. Endocr Rev, 2002, 23(3): 279-302. |
| [12] | Hofer E L, La-Russa V, Honegger A E, et al. Alteration on the expression of IL-1, PDGF, TGF-beta, EGF, and FGF receptors and c-Fos and c-Myc proteins in bone marrow mesenchymal stroma cells from advanced untreated lung and breast cancer patients[J]. Stem Cells Dev, 2005, 14(5): 587-594. |
| [13] | Kovacic N, Grcevic D, Katavic V, et al. Fas receptor is required for estrogen deficiency-induced bone loss in mice[J]. Lab Invest, 2010, 90(3): 402-413. |
| [14] | Garcia-Moreno C, Catalan M P, Ortiz A, et al. Modulation of survival in osteoblasts from postmenopausal women[J]. Bone, 2004, 35(1): 170-177. |
| [15] | Santiago-Mora R, Casado-Diaz A, De-Castro M D, et al. Oleuropein enhances osteoblastogenesis and inhibits adipogenesis: the effect on differentiation in stem cells derived from bone marrow[J]. Osteoporos Int, 2011, 22(2): 675-684. |
| [16] | Yang N, Wang G, Hu C, et al. Tumor necrosis factor α suppresses the mesenchymal stem cell osteogenesis promoter miR-21 in estrogen deficiency-induced osteoporosis[J]. J Bone Miner Res, 2013, 28(3): 559-573. |
| [17] | Wu X, Pang L, Lei W, et al. Inhibition of Sca-1-positive skeletal stem cell recruitment by alendronate blunts the anabolic effects of parathyroid hormone on bone remodeling[J]. Cell Stem Cell, 2010, 7(5): 571-580. |
| [18] | Liu G, Min H, Yue S, et al. Pre-miRNA loop nucleotides control the distinct activities of mir-181a-1 and mir-181c in early T cell development[J]. PLos One, 2008, 3(10): e3529. |
| [19] | Ebert P J, Jiang S, Xie J, et al. An endogenous positively selecting peptide enhances mature T cell responses and becomes an autoantigen in the absence of microRNA miR-181a[J]. Nat Immunol, 2009, 10(11): 1162-1169. |
| [20] | Derynck R, Zhang Y E. Smad-dependent and Smad-independent pathways in TGF-beta family signalling[J]. Nature, 2003, 425(6958): 577-584. |
| [21] | Yoshimura A, Wakabayashi Y, Mori T. Cellular and molecular basis for the regulation of inflammation by TGF-beta[J]. J Biochem, 2010, 147(6): 781-792. |
| [22] | Liu, Wang Y, Fan H, et al. MicroRNA-181a regulates local immune balance by inhibiting proliferation and immunosuppressive properties of mesenchymal stem cells[J]. Stem Cells, 2012, 30(8): 1756-1770. |
| [23] | Li H1, Xie H, Liu W, et al. A novel microRNA targeting HDAC5 regulates osteoblast differentiation in mice and contributes to primary osteoporosis in humans[J]. J Clin Invest, 2009, 119(12): 3666-3677. |
| [24] | Cohen A, Shmoish M, Levi L, et al. Alterations in micro-ribonucleic acid expression profiles reveal a novel pathway for estrogen regulation[J]. Endocrinology, 2008, 149(4): 1687-1696. |
| [25] | Check-Hayden E. Thousands of proteins affected by miRNAs[J]. Nature, 2008, 454(7204): 562. |



