2 400037 重庆,第三军医大学新桥医院泌尿外科
2Department of Urology, Xinqiao Hospital, Third Military Medical University, Chongqing, 400037, China
膀胱逼尿肌兴奋性异常是临床上常见的膀胱功能障碍,是多种膀胱病变如膀胱过度活动症(overactive bladder,OAB)、糖尿病性膀胱、神经源性膀胱等的共同发病机制之一[1, 2]。对于膀胱兴奋性调控的研究理论主要有神经源性和肌源性两大学说,膀胱中具有起 搏功能的Cajal间质细胞(interstitial cells of Cajal,ICCs)的发现使得肌源性学说日益受到重视[3, 4]。肌源性学说中各种离子通道对膀胱功能的调控尤为引人注目[5]。超极化激活环核苷酸门控阳离子通道(hyperpolarization-activated cyclic nucleotide-gated channels) 即HCN通道,有1~4四个亚型,在心脏和神经元中引发起搏电流,调节心脏和神经元的节律[6]。研究表明,大鼠和人类膀胱ICCs中HCN1~4亚型都有表达,且鼠类以HCN1为主,HCN通道在膀胱中很可能担任着兴奋起搏的角色[7, 8]。ICCs的兴奋起搏信号传导至膀胱平滑肌进而引起平滑肌的兴奋,Ca2+相关通道的参与是这其中的重要一环。大电导钙激活钾 通道(large-conductance Calcium-activated potassium channels) 即BK通道,由α、β(1~4)亚基构成,广泛表达于神经组织、腺体及平滑肌中,能被NS1619、IBTX特异性地激活和拮抗[9]。在平滑肌,质膜去极化及细胞内Ca2+浓度升高都可以将其激活,引发钾离子外流,导致膜电位的复极化和超级化,这是对细胞外Ca2+内流的一种反馈[10]。研究表明,膀胱平滑肌和ICCs中都有BK通道的表达,BK通道参与了膀胱收缩功能的调控,其下调或上调可导致OAB或膀胱功能障碍等疾病[11]。HCN通道和BK通道在膀胱ICCs兴奋性的调控中都发挥了重要作用,二者存在着可能的顺承关系,且都与Ca2+这一重要的第二信使密切相关,但关于二者相互影响的研究尚少见报道。本研究旨在研究小鼠HCN1通道基因敲除对其膀胱ICCs中BK通道表达和功能的影响,初步探讨这种影响对膀胱兴奋性调控的意义。
1 材料与方法 1.1 动物来源2月龄健康清洁的野生型C57BL/6J小鼠(体质量16~20 g)购自第三军医大学大坪医院野战外科研究所实验动物中心,取未经任何特殊处理的48只(雌雄各半)作为对照组,记为正常组。健康清洁的HCN1通道基因敲除的C57BL/6J小鼠(经删选鉴定为纯合子)购自美国杰克逊实验室,雌雄交配传代,幼鼠长至2月龄(体质量16~20 g)时投入使用,取48只(雌雄各半)作为实验组,记为敲基因组。取用动物时雌雄随机分配。
1.2 主要试剂和仪器TRIzol(总RNA抽提试剂)、Tubulin抗体等购自碧云天生物技术研究所。RT-PCR反转录试剂盒购自日本TaKaRa公司。Q-PCR荧光染料SYBR GREEN购自日本TOYOBO公司。Anti-KCNMA1、Anti-KCNMB1~4等一抗购自英国Abcam公司。Anti-c-kit一抗(ICCs特异性标记抗体)购自美国Santa Cruz公司。单腔器官浴槽系统、一维位移微调器、5 g量程JZJ01型肌肉张力换能器、RM-6240C型多通道生理信号采集处理系统购自成都仪器厂。木瓜蛋白酶、胰酶抑制剂、二硫苏糖醇(DTT)、Ⅱ型胶原蛋白酶购自美国Sigma 公司。胎牛血清(FBS)、DMEM/F-12培养基购自美国Gibco公司。钙离子荧光探针Fluo4-AM购自日本同仁化学研究所。
1.3 反转录PCR(RT-PCR)和荧光定量PCR(Q-PCR)
断颈处死小鼠,常规消毒后取膀胱,PBS快速清洗后用液氮冷冻研磨。所得组织粉末置于TRIzol中,按TRIzol说明书方法提取膀胱组织总RNA。Thermo紫外分光光度计测浓度及纯度后,取浓度适宜、纯度合格的RNA按TaKaRa试剂盒方法将其反转录成cDNAs。取cDNAs为模板,按TaKaRa试剂盒SYBR GREEN荧光定量PCR方法配置反应体系,用Step One Plus实时荧光定量PCR仪采用相对定量法做荧光定量PCR检测敲基因组小鼠膀胱中BK通道各亚基表达有何变化,内参为β-actin。各亚基基因表达以相对表达量(自身表达量/内参表达量)来表示。PCR引物购自上海生工公司,序列及产物长度见表 1。
| 基因 | 引物序列 | 产物长度(bp) |
| KCNMA1 | 上游:5′-GCCCTGTTAGATGGTCCCTTTG-3′ | 110 |
| 下游:5′-AGCCGGTAAATTCCAAAACAAAGC-3′ | ||
| KCNMB1 | 上游:5′-CCCCTGGGCTTCTGATCTAATG-3′ | 257 |
| 下游:5′-GGGGCAGAGCAGGAAAATAGAC-3′ | ||
| KCNMB2 | 上游:5′-AGCCAGCAACTTTTCTTTCATCAC-3′ | 177 |
| 下游:5′-CATGCCTACCAACACCCAGTC-3′ | ||
| KCNMB3 | 上游:5′-CGACGACGAGGCCATCAGG-3′ | 156 |
| 下游:5′-AAGGGGCCATCGGGACTGTAG-3′ | ||
| KCNMB4 | 上游:5′-GGCGTTTGTGGTGGGTGTTCTC-3′ | 202 |
| 下游:5′-CGGCCCCTTCCATCTCCTG-3′ | ||
| β-actin | 上游:5′-GTCCCTCACCCTCCCAAAAG-3′ | 266 |
| 下游:5′-GCTGCCTCAACACCTCAACCC-3′ |
按前述方法处死小鼠取膀胱,液氮研磨后将组织粉末置于预冷的RIPA+PMSF混合液中,冰浴裂解30 min,4 ℃下12 000×g离心15 min后小心吸取上清液即膀胱总蛋白。立即用BCA法测定浓度,按体积比4 ∶1加入SDS-PAGE蛋白上样缓冲液后于97 ℃恒温金属浴仪上加热7 min后取出,-80 ℃分装保存待用。使用SDS-PAGE凝胶电泳分离蛋白(恒压:浓缩胶80 V,40 min,分离胶120 V,50~70 min),每泳道上样 量为50 μg总蛋白,电泳结束后250 mA恒流转膜 70 min。5% BSA摇床室温封闭2 h,按蛋白Marker指示位置 切取目的条带,TBST漂洗后,anti-KCNMA1(1 ∶1 000),anti-KCNMB1(1 ∶500),anti-KCNMB2(1 ∶1 000),anti-KCNMB3(1 ∶1 000),anti-KCNMB4(1 ∶1 000),Tubulin(1 ∶1 000)等一抗抗体4 ℃摇床孵育过夜。TBST漂洗3次,每次10 min,辣根酶标记山羊抗兔、山羊抗小鼠IgG抗体室温孵育2 h,重复TBST漂洗3次,ECL化学发光液显影,凝胶成像系统曝光,保存图像。结果用Quantity One软件处理,各亚基蛋白表达以相对灰度值(目的条带灰度值/内参条带灰度值)表示。
1.5 膀胱ICCs原代细胞分离以D-Hanks液为溶剂,配置分离酶Ⅰ:木瓜蛋白酶(0.5 mg/mL)、Ⅱ型胶原蛋白酶(0.5 mg/mL)、DTT(1 mg/mL)、BSA(1 mg/mL)、胰酶抑制剂(1 mg/mL) 和分离酶Ⅱ:Ⅱ型胶原蛋白酶(1 mg/mL)、DTT(1 mg/mL)、 BSA(1 mg/mL)。按前述方法处死小鼠取膀胱,立即置于预冷的D-Hanks液中,切开膀胱,小心剔除浆膜和粘膜层,在分离酶Ⅰ中将组织剪成肉糜样,37 ℃消化5 min,1 000×g离心1.5 min,去除上清液,加入分离酶Ⅱ在37 ℃下继续消化,同时取液滴显微镜下观察。待镜下观察到游离细胞后即以1 000×g离心 3 min 终止消化。弃上清后加入适量含10% FBS的DMEM/F-12培养基,吹打30次后用200目细胞筛过滤后即得到急性分离细胞悬液。ICCs镜下呈长梭形,有较多细小侧枝突起。
1.6 免疫荧光双标实验将1.5中所得细胞悬液转移至NEST玻底培养皿,加入适量含10% FBS的DMEM/F-12培养基,在37 ℃、95% O2+5% CO2的孵箱中培养使细胞贴壁。然后将贴壁细胞用PBS液漂洗3次,每次5 min(下同),用4%多聚甲醛液固定20 min。PBS液漂洗 3次,1% BSA在室温下封闭30 min,重复PBS液漂洗3次。加入Anti-c-kit和Anti-KCNMA1一抗,放入湿盒,4 ℃过夜。PBS液漂洗3次后避光孵育荧光素标记的二抗,室温下孵育2 h。随后孵育DAPI(染核)10 min,PBS液漂洗3次后滴加抗荧光淬灭封片剂。然后在TCS SP5激光共聚焦显微镜下镜检,所有ICCs均使用同等放大倍数和激发光条件。用血清代替一抗孵育作为阴性对照。
1.7 离体逼尿肌肌条实验封闭单腔器官浴槽系统流出口,加入15 mL新鲜配置的Krebs液,通入恒流95% O2+5% CO2混合气,连接恒温水浴箱,设定温度37 ℃预热5 min。按前述方法处死小鼠取膀胱,置于4 ℃ Krebs液中,小心剔除黏膜层,沿纵轴将组织切成2 mm×2 mm×6 mm的肌条,将肌条一端固定于浴槽系统底部,一端用丝线连接于装有一维位移微调器的肌肉张力换能器,使肌条处于完全松弛状态并垂直浸没在Krebs液中。连接多通道生理信号采集处理系统,选择张力模式,调节灵敏度为0.75 g,扫描速度10 s/d。静置平衡10 min后,调节一维位移微调器缓慢牵拉肌条,使其张力升至0.3 g,待肌条出现自发性收缩且平稳,观察记录时间-张力变化曲线,10 min后加入BK通道阻滞剂IBTX(终浓度100 nmol/L),观察变化并记录10 min,Krebs液洗脱两遍,继续观察记录10 min。取记录最平稳的2 min进行检测,数据用多通道生理信号采集处理系统软件处理。
1.8 激光共聚焦显微镜下检测钙荧光将1.5中所得细胞悬液转移至NEST玻底培养皿,加入适量含10% FBS的DMEM/F-12培养基,在37 ℃、95% O2+5% CO2的孵箱中培养使细胞贴壁。然后用Hanks液漂洗2次,加入1 μmol/L的fluo-4AM溶解液200 μL覆盖皿底避光孵育30 min。 用Hanks液漂洗后继续滴加Hanks液200 μL覆盖皿底,在激光共聚焦显微镜下观察ICCs内钙荧光,激发光波长为456 nm。运用Leica TIRF动态影像收集系统以12 帧/min对ICCs内钙荧光进行实时影像采集。分别加入BK通道激动剂NS1619(终浓度30 μmol/L)和阻滞剂IBTX(终浓度200 nmol/L)后观察记录小鼠膀胱ICCs内钙荧光的变化,比较敲基因组和正常组小鼠膀胱ICCs内钙荧光的变化对NS1619和IBTX的敏感程度,以此评价2组小鼠ICCs中BK通道的功能变化。数据采用相对荧光强度进行记录,相对荧光强度(RFI)=F1/F0,F1=每记录时点的荧光强度,F0=基础荧光强度即加药前的平均荧光强度。然后绘制F1/F0对时间的变化曲线。
1.9 统计学分析所得数据以x±s表示,采用SPSS 19.0软件统计,组间计量资料比较进行t检验。
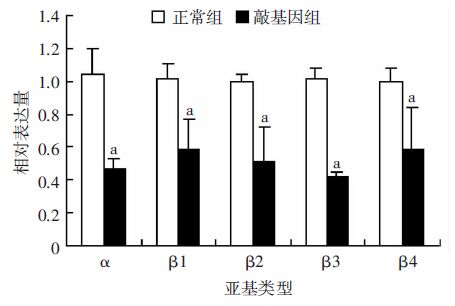
2 结果 2.1 Q-PCR检测BK通道各亚基的表达变化经RT-PCR、Q-PCR检测发现,敲基因组小鼠膀胱 内BK通道各亚基的相对表达量均低于正常组(图 1)。 由此可见,在mRNA水平,敲基因组小鼠膀胱中BK通道各亚基的表达降低,提示HCN1通道基因敲除下调了膀胱中BK通道的基因表达。
|
| a:P<0.01,与正常组比较 图 1 Q-PCR检测敲基因组和正常组膀胱中BK通道各亚基的表达变化 |
Western blot重复检测多次,统计蛋白表达相对灰度值,发现敲基因组(K)小鼠膀胱总蛋白中BK通道各亚基的相对灰度值均低于正常组(N)(图 2)。由此可见,在蛋白水平,敲基因组小鼠膀胱中BK通道各亚基的表达降低,提示HCN1通道基因敲除下调了膀胱中BK通道的基因表达。

|
| A:敲基因组和正常组α亚基表达对比;B:敲基因组和正常组β1亚基表达对比;C:敲基因组和正常组β2亚基表达对比;D:敲基因组和正常组β3亚基表达对比;E:敲基因组和正常组β4亚基表达对比;F:各亚基相对灰度值统计;a:P<0.01,b:P<0.05,与正常组比较 图 2 Western blot检测敲基因组和正常组膀胱中BK通道各亚基的表达变化 |
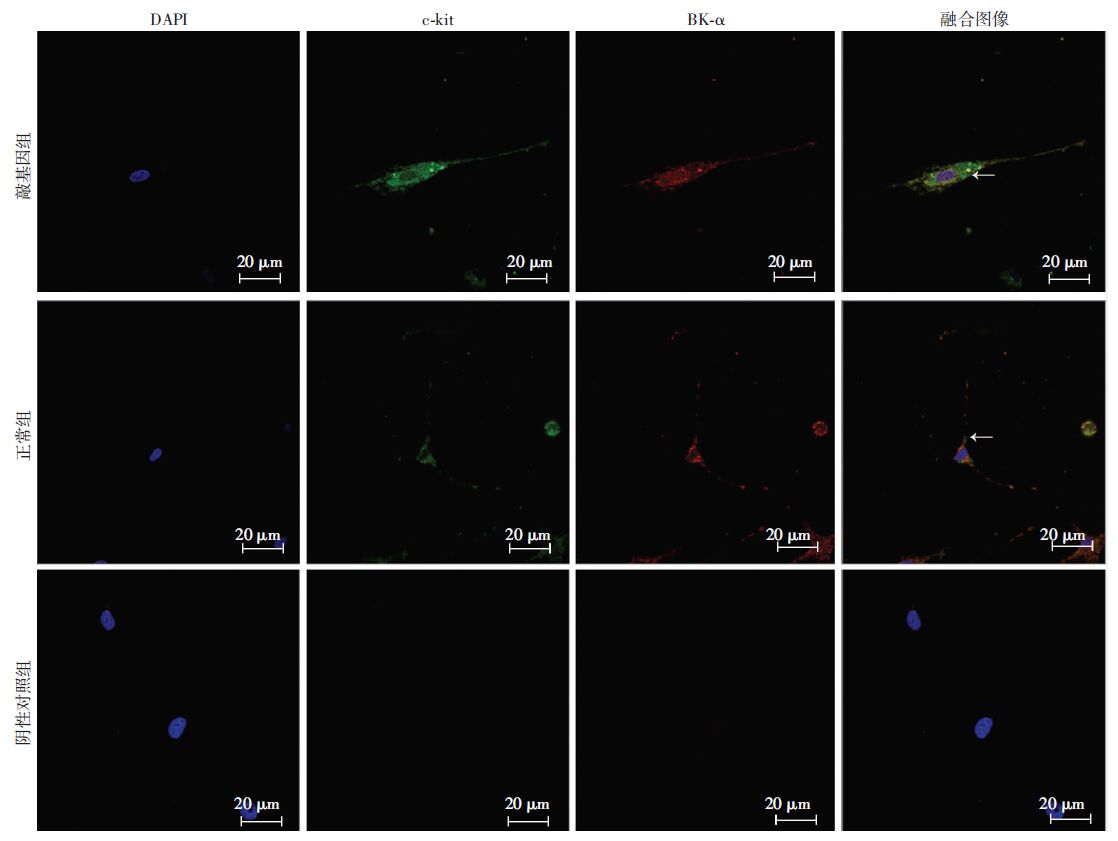
镜下可见c-kit阳性的ICCs,核大,染色质分散,多毛刺样突起。比较小鼠膀胱ICCs中α亚基荧光密度敲基因组(570.40±41.02)较正常组(1 018.00±64.44)显著降低(P<0.01,图 3)。说明敲基因组ICCs内BK通道α亚基表达降低,提示HCN1通道基因敲除下调了膀胱ICCs中BK通道的基因表达。
|
| 图 3 免疫荧光双标实验检测敲基因组和正常组小鼠膀胱ICCs中BK-α亚基表达变化 |
离体逼尿肌肌条实验检测加入BK通道阻滞剂IBTX前后肌条收缩的变化(图 4)。加入IBTX后,敲基因组肌条收缩幅度由(0.083±0.034)增加到(0.091±0.037)(P<0.01);正常组肌条收缩幅度由(0.130±0.020)增加到(0.151±0.031)(P<0.05)。进一步比较加药前后肌条收缩幅度的变化值,发现敲 基因组(0.008±0.005)显著低于正常组(0.021±0.014)(P<0.05)。 由此可见敲基因组小鼠肌条对IBTX的反应低于正常组,提示敲基因小鼠膀胱中BK通道的功能降低。

|
| 图 4 离体逼尿肌肌条实验加入IBTX前后肌条收缩波形变化 |
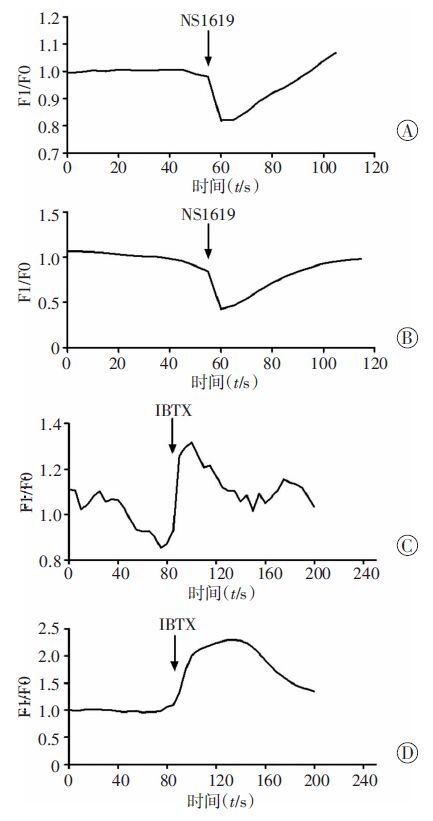
激光共聚焦镜检结果显示:加入NS1619后,敲基因组[(123.38±1.00)vs(114.98±10.86),P<0.05]和正常组[(133.37±8.97)vs(101.55±10.86,P<0.01]ICCs内钙荧光均降低,比较钙荧光的变化值(加药前-加药后),敲基因组(13.88±7.35)显著低于正常组(49.31±21.12)(P<0.01)。加入IBTX后,敲基因组[(97.28±8.32)vs(110.85±8.22),P<0.01]和正常组[(75.20±2.48)vs(142.20±26.56),P<0.01] ICCs内钙荧光均增高,比较钙荧光的变化值(加药后-加药前),敲基因组(24.10±5.07)显著低于正常组(72.35±24.94)(P<0.01)。将结果绘制成F1/F0对时间的变化曲线如图 5。不论加入激动剂或阻滞剂,敲基因组加药前后ICCs内钙荧光的变化程度 均小于正常组,说明敲基因组膀胱ICCs内钙荧光的变化对BK通道激动剂、阻滞剂的敏感程度均低于正常组。提示敲基因小鼠膀胱ICCs中BK通道的功能降低。
|
| A:敲基因组加入NS1619前后ICCs内钙荧光的F1/F0变化曲线;B:正常组加入NS1619前后ICCs内钙荧光的F1/F0变化曲线;C:敲基因组加入IBTX前后ICCs内钙荧光的F1/F0变化曲线;D:正常组加入IBTX前后ICCs内钙荧光的F1/F0变化曲线 图 5 激光共聚焦镜检加入NS1619或IBTX前后ICCs内钙荧光的变化 |
膀胱ICCs是类似于胃肠道ICCs的间质细胞,藉以其特异性标记物c-kit、波形蛋白等区分膀胱ICCs和膀胱平滑肌细胞。其作用可能有:膀胱收缩活动的起搏,神经、牵张刺激等信号的整合及传递等。ICCs与膀胱平滑肌细胞紧密相联,两者之间存在大量的缝隙连接,这可能是其传导兴奋的结构基础[12]。
以往对膀胱中离子通道的研究大都集中于平滑肌细胞,自ICCs发现以来,研究者相继在ICCs上发现了多种离子通道的存在及它们对ICCs兴奋性的调控。特别是ICCs中HCN通道的发现使得其作为兴奋起搏细胞的理论有了强大的说服力[7, 8]。HCN通道是Pacemaker细胞的电生理结构基础:它在超极化激活,使Na+、K+内流引发膜电位的自动去极化,导致Ca2+内流,引发动作电位。膜电位复极化后,它调节细胞膜电位向阈电位靠近,对下一次动作电位的触发起着正向作用[6]。HCN通道的这种自动除极功能决定了它极有可能是ICCs作为起搏细胞的核心。在小鼠体内敲除其膀胱主要表达的亚型-HCN1后,将对膀胱收缩产生一系列影响。肌条实验证实,小鼠HCN1通道基因敲除后,其肌条收缩能力减弱。这可能是兴奋起搏的减少所导致的。而在逼尿肌过度活动的模型中,HCN通道的表达升高[13]。这些都说明HCN通道对膀胱兴奋起搏起着重要作用。
BK通道在哺乳动物组织中广泛表达,其α亚基是其离子孔道的形成亚基,而β1~4亚基则主要负责对其功能的调控。BK通道具有电压敏感和Ca2+敏感双重特性,质膜去极化及细胞内Ca2+浓度升高都可以将其激活,引发钾离子外流,导致膜电位的复极化和超级化,是对细胞外Ca2+内流的一种反馈[9, 10]。在膀胱,BK 通道可以通过反馈性抑制平滑肌细胞的兴奋来调节膀胱收缩功能[11]。
本研究发现小鼠HCN1通道基因敲除下调了其膀胱ICCs中BK通道的表达和功能。HCN1通道基因敲除后可能导致了膀胱兴奋起搏的不足,导致膀胱收缩性的减弱。而下调BK通道的表达及其功能,将减少BK通道对ICCs兴奋性的负反馈,维持其兴奋性向正向发展。这对于维持敲基因小鼠膀胱的正常生理功能是有利的。这种下调可以看做是对HCN1通道基因敲除后膀胱收缩减弱的一种代偿。
研究表明,膀胱中只有ICCs上表达HCN通道[7],而BK通道则在平滑肌细胞和ICCs上都有表达。ICCs上的HCN1通道基因敲除除了下调其自身BK通道的表达及功能外,还可能将这种影响传递到了膀胱中的平滑肌细胞。ICCs作为起搏细胞,其兴奋性传导有赖于其细胞突起与平滑肌细胞间的缝隙连接。在结构上,ICCs与平滑肌细胞组成了一个关联紧密的网。这可能是这种影响传递的生理结构基础。而关于小鼠HCN1通道基因敲除下调其膀胱ICCs中BK通道的表达和功能的具体机制还有待于进一步研究,可能的机制包括通道蛋白结构的交联、共同的通道调控通路如PKC蛋白激酶信号通路等的相互影响[14, 15]。HCN1通道基因敲除对膀胱ICCs中BK通道的表达及功能的下调显示了HCN通道作为ICCs起搏功能机制的核心地位,为膀胱兴奋性调控的研究提供了新内容。
| [1] | Bragg R, Hebel D, Vouri S M, et al. Mirabegron: a Beta-3 agonist for overactive bladder [J]. Consult Pharm, 2014, 29(12): 823-837. |
| [2] | Arrellano-Valdez F, Urrutia-Osorio M, Arroyo C, et al. A comprehensive review of urologic complications in patients with diabetes [J]. Springerplus, 2014, 3: 549. |
| [3] | Sakakibara R, Tateno F, Kishi M, et al. Neurology and the bladder: how to assess and manage neurogenic bladder dysfunction, with particular references to the neural control of micturition [J]. Brain Nerve, 2014, 66(5): 527-537. |
| [4] | Juszczak K, Maciukiewicz P, Drewa T, et al. Cajal-like interstitial cells as a novel target in detrusor overactivity treatment: true or myth? [J]. Cent European J Urol, 2014, 66(4): 413-417. |
| [5] | Brading A F, Brain K L. Ion channel modulators and urinary tract function [J]. Handb Exp Pharmacol, 2011(202): 375-393. |
| [6] | Herrmann S, Schnorr S, Ludwig A. HCN channels--modulators of cardiac and neuronal excitability[J]. Int J Mol Sci, 2015, 16(1): 1429-1447. |
| [7] | He P, Deng J, Zhong X, et al. Identification of a hyperpolarization-activated cyclic nucleotide-gated channel and its subtypes in the urinary bladder of the rat [J]. Urology, 2012, 79(6): 1411. e7-1411. e13. |
| [8] | Xue L, Li Y, Han X, et al. Investigation of hyperpolarization-activated cyclic nucleotide-gated channels in interstitial cells of Cajal of human bladder[J]. Urology, 2012, 80(1): 224. e13-224. e18. |
| [9] | Torres Y P, Granados S T, Latorre R. Pharmacological consequences of the coexpression of BK channel alpha and auxiliary beta subunits [J]. Front Physiol, 2014, 5: 383. |
| [10] | Rothberg B S. The BK channel: a vital link between cellular calcium and electrical signaling[J]. Protein Cell, 2012, 3(12): 883-892. |
| [11] | Petkov G V. Central role of the BK channel in urinary bladder smooth muscle physiology and pathophysiology [J]. Am J Physiol Regul Integr Comp Physiol, 2014, 307(6): R571-R584. |
| [12] | Rusu M C, Folescu R, Manoiu V S, et al. Suburothelial interstitial cells [J]. Cells Tissues Organs, 2014, 199(1): 59-72. |
| [13] | Deng T, Zhang Q, Wang Q, et al. Changes in hyperpolarization-activated cyclic nucleotide-gated channel expression and activity in bladder interstitial cells of Cajal from rats with detrusor overactivity [J]. Int Urogynecol J, 2015, [Epub ahead of print]. |
| [14] | Reetz O, Strauss U. Protein kinase C activation inhibits rat and human hyperpolarization activated cyclic nucleotide gated channel (HCN)1——mediated current in mammalian cells [J]. Cell Physiol Biochem, 2013, 31(4/5): 532-541. |
| [15] | Hristov K L, Smith A C, Parajuli S P, et al. Large-conductance voltage- and Ca2+-activated K+ channel regulation by protein kinase C in guinea pig urinary bladder smooth muscle [J]. Am J Physiol Cell Physiol, 2014, 306(5): C460-C470. |



