超极化激活的环核苷酸门控通道(hyperpolarization-activated cyclic nucleotide-gated channel,HCN)的基因亚型HCN4及其介导的起搏离子流(funny current,If)是窦房结细胞4期自动去极化形成的关键环节[1]。但既往研究表明,一系列围绕HCN基因开展的重建生物起搏点的实验方法,都不可避免地在移植过程中出现了起搏功能退化或消失的现象[2,3,4]。由此可见,仅仅重建If的离子通道无法形成持久有效的生物起搏点。而近年来发现的参与胚胎心脏早期发育的矮小同源盒基因亚型2(short stature homobox 2,Shox2)能够显著抑制Nkx2.5并有效上调HCN4的表达,是调控胚胎心脏细胞向窦房结分化而不向工作心肌细胞分化的关键因素[5]。因此,利用Shox2作为转录调控因子诱导多能干细胞向具有一定起搏功能的窦房结样细胞分化,是生物起搏研究的一种理想选择。本研究采用慢病毒转染技术,将目的基因Shox2整合进犬骨髓间充质干细胞(canine mesenchymal stem cells,cMSCs)的基因组中,再与乳鼠心肌细胞(rat ventricular myocytes,NRVMs)共培养诱导其向心脏起搏样细胞分化,以检测在Shox2基因的影响下cMSCs生理生化特点的改变,并深入探讨Shox2基因作为生物起搏靶基因的可能性。 1 材料与方法 1.1 实验动物
出生1~3 d的SPF级SD乳大鼠 20只(体质量50~60 g),健康成年犬1只(体质量10~14 kg),雌雄不限,由第三军医大学实验动物中心提供。 1.2 主要仪器和试剂
胎牛血清(美国Gibco公司);α-MEM培养基、胰酶(美国HyClone公司);PCR试剂盒 (日本TOYOBO公司);兔抗小鼠Shox2多克隆抗体、兔抗犬HCN4多克隆抗体、兔抗犬Nkx2.5多克隆抗体(英国Abcam公司);兔抗犬缝隙连接蛋白43(Cx43)、45(Cx45)多克隆抗体、兔抗犬Tbx3多克隆抗体(美国Santa Cruz公司);荧光倒置显微镜 (日本Olympus公司);Zeiss LSM710激光共聚焦显微镜(德国Zeiss公司);Axonpatch 200B膜片钳放大器、Digidata 1440 AD/DA转换器(美国Axon公司) 1.3 实验方法 1.3.1 犬骨髓间充质干细胞分离纯化
抽取健康成年犬骨髓,参照文献[6]采用密度梯度离心法结合贴壁法分离出cMSCs,隔天换液培养并传代,选取生长旺盛的第3代细胞备用。 1.3.2 慢病毒载体构建根据NCBI小鼠Shox2
mRNA序列构建包装慢病毒载体pLentis-mShox2-红色荧光蛋白(red fluorescent protein,RFP)及pLentis-RFP,载体内携带嘌呤霉素抗药基因用于后续实验中细胞纯化。简述如下:使用全基因合成法获得小鼠Shox2的编码区DNA序列。用BamHⅠ和EcoRⅠ对mShox2合成序列和慢病毒载体pLentis-CMV-RTP-SFFV进行酶切,回收酶切产物,然后用T4 DNA连接酶连接载体和mShox2的编码区片段,连接产物转化感受态细菌,挑取长出的克隆,培养并提取质粒,然后将质粒进行酶切以及测序鉴定,确定构建正确的克隆(pLentis-CMV-RTP-SFFV-Shox2)用于后继实验。使用磷酸钙转染法转染293T细胞包装慢病毒颗粒,收集的病毒用于后面的细胞转染。 1.3.3 慢病毒感染cMSCs
取对数生长期的第3代cMSCs分为4组:A组(RFP-cMSCs组)、B组(RFP-cMSCs +NRVMs共培养组)、C组(Shox2-RFP-cMSCs组)、D组(Shox2-RFP-cMSCs +NRVMs共培养组)。将细胞接种于6孔板,
1.0×105/孔,在37 ℃、5% CO2孵箱内过夜,直至细胞达到60%融合后换液,按照MOI=20将所需病毒分别加入培养液中,每孔液体量为1 mL,摇匀使病毒液与细胞充分接触,孵箱内培养24 h后弃去病毒液并换液,72 h后荧光显微镜下观察其转染效率。 1.3.4 乳鼠心肌细胞共培养
取新生1~3 d的SD乳大鼠,低温无菌条件下取出心脏,置于提前4 ℃预冷的D-Hanks液中,反复冲洗3次后,眼科剪剪成1~2 mm3体积的碎块,加入0.1%Ⅱ型胶原酶在37 ℃水浴锅中消化5 min,弃去上清后再次加入胶原酶进行分次消化,20 min/次,收集每次消化后的上清液,按1 ∶1 比例加入α-MEM完全培养基终止,经200目筛网过滤成单细胞悬液,1 000 r/min离心5 min,弃上清,加入适量培养基差速贴壁30 min,收集上清计数后接种于100 mm培养皿中。37 ℃、5% CO2培养24 h后,将转染阳性的cMSCs按照cMSCs:乳鼠心肌细胞1 ∶4的比例加入到培养皿中进行共培养,5 d后予5 μg/mL嘌呤霉素加压筛选72 h,PBS冲洗3次,收集存活贴壁的Shox2-RFP-cMSCs或RFP-cMSCs进行检测[7]。 1.3.5 定量RT-PCR分析
TRIzol提取筛选后细胞内的总RNA,使用荧光定量逆转录盒转录为cDNA,按照SYBR法实时荧光定量PCR试剂盒及Agilent公司Stratagene Mx3000P实时荧光定量PCR仪的使用说明书进行实验操作[8]。使用引物见表 1。
| 基因 | 引物序列 | 扩增片段(bp) |
| mShox2 | 上游 5′-ACTATCCAGACGCTTTCATGCG-3′ 下游 5′-TTCGATTTTGAAACCAAACCTGTAC-3′ | 192 |
| cNkx2.5 | 上游 5′-CCGAGCCTGGTAGGAAAGGG-3′ 下游 5′-AAATCCAAGGGACGTGGAGACA-3′ | 120 |
| cTbx3 | 上游 5′-GTAAGATGTTCTGGGCTGGATAAA-3′ 下游 5′- GTAGCAGGGCTGTCTGGGTG-3′ | 167 |
| cHCN4 | 上游 5′-AGGGCACCATCGGCAAGA-3′ 下游 5′-CCACGCTCAGCGAATACAGG-3′ | 186 |
| cCx45 | 上游 5′-CAGCAGACTTCCTTGCCCTCATA-3′ 下游 5′-CTTAGCATTGGACAGTTCGGTGT-3′ | 298 |
| cCx43 | 上游 5′-TGCTATGACAAATCCTTCCCAATC-3′ 下游 5′-GCCGTGCTCTTCAATTCCATACTT-3′ | 237 |
| cGAPDH | 上游 5′-GAGATCCCGCCAACATCAAA-3′ 下游 5′-GGCATCAGCAGAAGGAGCAG-3′ | 146 |
用RIPA裂解液提取cMSCs的总蛋白,BCA试剂盒测蛋白浓度, 接着行SDS-PAGE电泳,上样30 μg/孔,电泳后转移至PVDF膜上,5%牛血清蛋白室温封闭1 h后加入一抗(兔源Shox2、HCN4、Nkx2.5、Tbx3、Cx43、Cx45和GAPDH)4 ℃ 摇床孵育过夜,二抗孵育1 h。 1.3.7 免疫荧光检测
将cMSCs制成细胞爬片,4%多聚甲醛室温固定15 min,用含0.2% Triton X-100和0.3% H2O2的甲醇溶液封闭15 min,山羊血清封闭15 min后加入一抗(兔源Shox2、HCN4、Nkx2.5、Cx30、Cx45)4 ℃过夜,二抗室温孵育1 h,抗荧光淬灭封片剂封片,激光共聚焦显微镜检查。 1.3.8 全细胞膜片钳检测
将共培养后的MSCs放入灌流槽,灌流细胞外液,电极现拉现用,充灌电极内液后阻抗为4~6 MΩ,室温控制在(25±1)℃,应用Clampex程序采样,电压钳方式进行电流记录,钳制电位-30 mV,给予幅值-40 mV到-160 mV的超极化脉冲,步阶为10 mV,最后回归到+20 mV,在+20 mV处测量尾电流。封接破膜后形成全细胞记录模式,所有记录数据应用pCLAMP10.1软件进行处理,并用Boltzmanne方程Itail/Imax=A/{1.0 +exp[(V-V1/2)/k]}拟合If电流的激活曲线,并求算出半激活电压(V1/2)及曲线的斜率(k)。 1.4 统计学分析
应用SPSS 18.0统计软件,数据用x ±s表示。组间比较采用单因素方差分析。 2 结果 2.1 cMSCs的形态学观察和慢病毒转染MSCs的效率
cMSCs传代至P3时,已基本纯化,呈均匀的长梭形或多边形,折光性好。慢病毒转染(MOI=20)72 h后,4组cMSCs转染效率可以达到(85.0±4.5)%(n=5),慢病毒转染能力较好。细胞形态及生长活性未见明显改变。 2.2 转染阳性细胞诱导后相关基因mRNA的表达
Shox2基因转染成功,Shox2-RFP-cMSCs组及Shox2-RFP-cMSCs+NRVMs共培养组均过表达Shox2。Shox2-RFP-cMSCs+NRVMs共培养组细胞经过共培养诱导分化后心脏传导系统特异性基因HCN4、Cx45、Tbx3的表达较其他组明显增加(P<0.05),而Nkx2.5及Cx43的表达较RFP-cMSCs +NRVMs共培养组明显减少(P<0.05,图 1)。
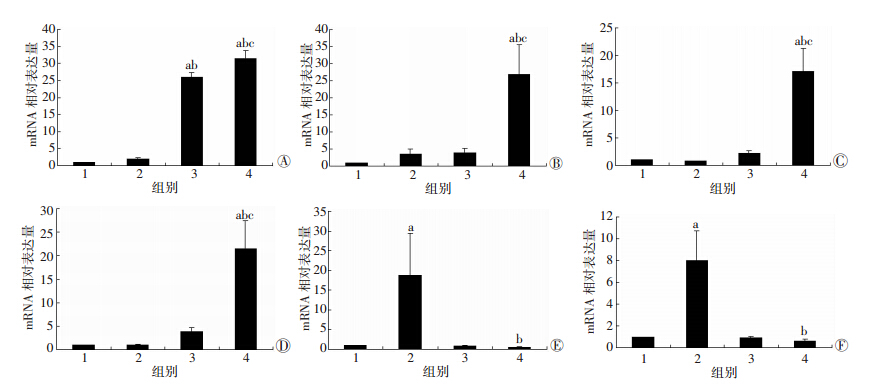 |
| 1:RFP-cMSCs组;2:RFP-cMSCs +NRVMs共培养组;3:Shox2-RFP-cMSCs组;4:Shox2-RFP-cMSCs +NRVMs共培养组 A:Shox2基因;B:Tbx3基因;C:Cx45基因;D:HCN4基因;E:Cx43基因;F:Nkx2.5基因 a:P<0.05,与RFP-cMSCs组比较;b:P<0.05,与RFP-cMSCs +NRVMs共培养组比较;c:P<0.05,与Shox2-RFP-cMSCs组比较图 1 4组细胞相关基因的mRNA表达 |
Shox2-RFP-cMSCs +NRVMs共培养组细胞相关蛋白HCN4、Cx45、Tbx3的表达均较RFP-cMSCs明显增加,工作心肌细胞相关的Nkx2.5及Cx43较RFP-cMSCs +NRVMs共培养组明显降低(图 2)。
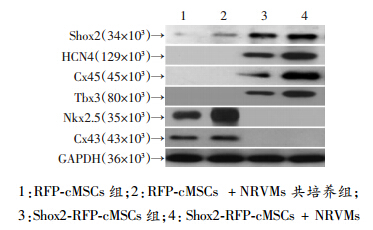 |
| 1:RFP-cMSCs组;2:RFP-cMSCs +NRVMs共培养组; 3:Shox2-RFP-cMSCs组;4:Shox2-RFP-cMSCs+NRVMs 共培养组图 2 Western blot检测4组细胞相关蛋白的表达 |
经激光共聚焦显微镜检测结果显示,Shox2-RFP-
cMSCs组和Shox2-RFP-cMSCs +NRVMs共培养组细胞均有HCN4通道蛋白的形成,且沿细胞膜表面均匀分布,而RFP-cMSCs组和RFP-cMSCs +NRVMs共培养组仅见RFP荧光表达,无HCN4蛋白形成(图 3)。
 |
| A~D:RFP-cMSCs组;E~H:RFP-cMSCs +NRVMs共培养组;I~L:Shox2-RFP-cMSCs组;M~P:Shox2-RFP-cMSCs +NRVMs共培养组;A、E、I、M:DAPI;B、F、J、N:转染病毒携带的红色荧光;C、G、K、O:HCN4;D、H、L、P:融合图像图 3 4组细胞免疫荧光检测HCN4通道蛋白的表达 (激光共聚焦显微镜) |
全细胞膜片钳结果显示,转染Shox2的Shox2-RFP-cMSCs组和Shox2-RFP-cMSCs +NRVMs共培养组细胞均可以记录到超极化激活的内向电流,该电流具有明显的时间及电压依赖特性(图 4A),且对Cs+ 敏感,当细胞外液中加入CsCl(4 mmol/L)阻断剂后,该内向电流被阻断,当细胞外液中的CsCl被洗脱后,内向电流又迅速恢复(图 4B、C)。根据记录到的尾电流重建该内向电流激活曲线(图 4F)和翻转电位(图 4D、E),并进行计算,得到膜片钳实验数据(表 2)。而仅转染RFP的RFP-cMSCs组和RFP-cMSCs +NRVMs共培养组细胞,均未能记录到超极化激活的内向电流。
| 组别 | 检出率(%) | 电流幅值(pA,-140 mV) | 膜电容(pF) | 电流密度(pA/pF,-140 mV) | 半数最大激活电压(mV) | 斜率 | 时间激活常数(ms) | 翻转电位(mV) |
| Shox2-RFP-cMSCs组 | 15(3/20) | -1 014.6±17.8 | 24.0±6.5 | -41.3±7.6 | -92.3±6.2 | -16.7±1.7 | 421.0±61.0 | -27.4±3.8 |
| Shox2-RFP-cMSCs+NRVMs共培养组 | 76(19/25) | -1 078.1±13.4 | 24.7±7.8 | -43.6±5.3 | -89.4±3.7 | -16.3±1.5 | 415.3±58.0 | -28.9±6.7 |
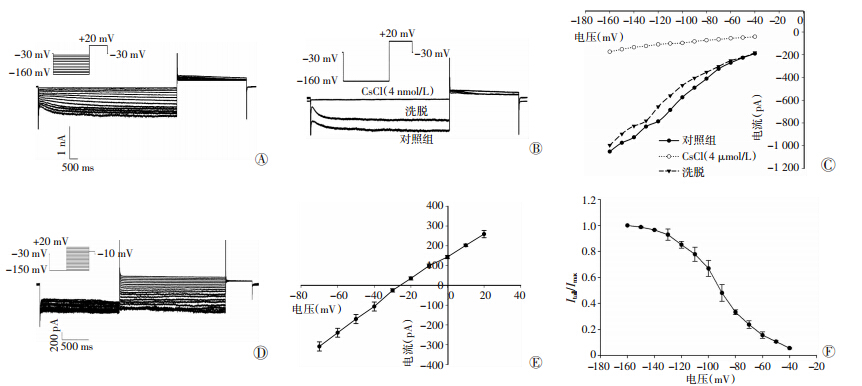 |
| A:Shox2-MSCs记录到的内向电流;B:CsCl阻断和洗脱;C:电流-电压关系;D:翻转电位;E:翻转电位求算曲线;F:If电流激活曲线 |
Shox2基因是近年发现的与胚胎心脏发育分化密切相关的转录调控因子。在胚胎心脏发育的过程中,Shox2基因在窦状角区域的特异性表达,能够显著抑制Nkx2.5。Shox2基因的无效突变或Nkx2.5在窦房结的异位表达,都将使窦房结区域的发育严重受损,HCN4和Tbx3的表达明显降低,心脏搏动频率减慢。而Shox2在右心房区域的异位表达,将导致窦房结区域的扩大[5,9,10]。可以认为,Shox2基因的正常表达,是胚胎时期窦房结正常发育的关键保障。
在胚胎心脏发育的过程中,高表达Tbx3的区域最终会形成包括窦房结在内的心脏传导系统[11,12];相反,转录调控因子Nkx2.5只局限于工作心肌区域表达,窦房结等传导系统表达阴性[5];而缝隙连接蛋白Cx43和Cx45的主要区别在于对电信号的传导性不同,Cx43具有较高的传导性,易受外来电信号影响,集中在工作心肌细胞中表达;Cx45的传导性较低,能形成较高的细胞内阻抗,主要在传导系统内表达[10]。本研究选用的Tbx3、Cx43、Cx45等窦房结细胞标志物均具有较高的特异性,受到Shox2基因的调控,可以用来鉴别MSCs细胞的分化方向。
MSCs作为一种便于取材、易于分离培养,理想的组织修复种子细胞,具有稳定的自我更新能力和多向分化潜能,可在体内外不同诱导方法下(如化学试剂、电刺激微环境、心肌环境、组织工程等方法[7,13,14,15])分化为心肌细胞。但单纯地利用上述诱导方法,只能使MSCs分化成为工作心肌细胞,并不能生成具有自主搏动能力的起搏样细胞。因此,选用具有分化调控能力的Shox2基因来尝试促进MSCs向起搏样细胞分化,可以为探索生物起搏治疗提供一种新的思路。
本研究采用慢病毒载体将Shox2基因转染到cMSCs 的基因组中,目的就是利用Shox2基因的调控作用,在cMSCs与NRVMs共培养的诱导分化过程中,促进cMSCs向具有相对完整起搏功能的“窦房结样”细胞分化,而不是仅仅依靠HCN基因来重建If的离子通道。研究结果显示,仅仅将Shox2基因整合进MSCs的基因组中,并不能诱使MSCs完整有效地向起搏样细胞分化,只有在转染了Shox2基因的同时再通过一定的方法进行诱导,MSCs才能较好地形成具有明显的电压依赖性与时间依赖性的超极化激活的If并且高表达HCN4、Tbx3、Cx45等窦房结标志性基因。
综上所述,在心肌微环境的诱导条件下,携带外源基因Shox2的cMSCs通过表达HCN4基因产生了生物起搏离子流If,获得了一定的起搏功能,成功向窦房结样细胞分化。但关于其获得的起搏功能是否能在宿主体内维持,仍有待进一步体内实验验证。我们将继续利用能稳定表达Shox2的MSCs进行动物实验,验证利用Shox2基因重建生物起搏点的可行性。
| [1] | Ripplinger C M, Bers D M. Human biological pacemakers intrinsic variability and stability[J]. Circulation, 2012, 125(7): 856-858. |
| [2] | Verkerk A O, Wilders R. Pacemaker activity of the human sinoatrial node: effects of HCN4 mutations on the hyperpolarization-activated current[J]. Europace, 2014, 16(3): 384-395. |
| [3] | Qu J, Plotnikov A N, Danilo P Jr, et al. Expression and function of a biological pacemaker in canine heart[J]. Circulation, 2003, 107(8): 1106-1109. |
| [4] | Jun C, Zhihui Z, Lu W, et al. Canine bone marrow mesenchymal stromal cells with lentiviral mHCN4 gene transfer create cardiac pacemakers[J]. Cytotherapy, 2012, 14(5): 529-539. |
| [5] | Espinoza-Lewis R A, Yu L, He F, et al. Shox2 is essential for the differentiation of cardiac pacemaker cells by repressing Nkx2-5[J]. Dev Biol, 2009, 327(2): 376-385. |
| [6] | 杨玉霞, 郑健樑, 张平, 等. 密度梯度离心结合贴壁法培养成年大鼠骨髓间充质干细胞的生物学特性[J].中国组织工程研究与临床康复, 2007, 11(3): 583-586. |
| [7] | Wen L, Zhang C, Nong Y, et al. Mild electrical pulse current stimulation upregulates S100A4 and promotes cardiogenesis in MSC and cardiac myocytes coculture monolayer[J]. Cell Biochem Biophys, 2013, 65(1): 43-55. |
| [8] | 王婵, 张倩, 沙马阿直, 等. 硝苯地平对ApoE-/-小鼠RAW264.7巨噬细胞源性胆固醇逆向转运的影响[J]. 第三军医大学学报, 2014, 36(9): 910-913. |
| [9] | Espinoza-Lewis R A, Liu H, Sun C, et al. Ectopic expression of Nkx2.5 suppresses the formation of the sinoatrial node in mice[J]. Dev Biol, 2011, 356(2): 359- 369. |
| [10] | Christoffels V M, Moorman A F. Development of the cardiac conduction system: why are some regions of the heart more arrhythmogenic than others?[J]. Circ Arrhythm Electrophysiol, 2009, 2(2): 195-207. |
| [11] | Hoogaars W M, Tessari A, Moorman A F, et al. The transcriptional repressor Tbx3 delineates the developing central conduction system of the heart[J]. Cardiovasc Res, 2004, 62(3): 489-499. |
| [12] | Greulich F, Rudat C, Kispert A. Mechanisms of T-box gene function in the developing heart[J]. Cardiovasc Res, 2011, 91(2): 212-222. |
| [13] | Qian Q, Qian H, Zhang X, et al. 5-Azacytidine induces cardiac differentiation of human umbilical cord-derived mesenchymal stem cells by activating extracellular regulated kinase[J]. Stem Cells Dev, 2012, 21(1): 67-75. |
| [14] | Hou J, Lu A L, Liu B W, et al. The combination of BMP-2 and 5-AZA is advantageous in rat bone marrow-derived mesenchymal stem cells differentiation into cardiomyocytes[J]. Cell Biol Int, 2013, 37(12): 1291- 1299. |
| [15] | Fukuhara S, Tomita S, Yamashiro S, et al. Direct cell-cell interaction of cardiomyocytes is key for bone marrow stromal cells to go into cardiac lineage in vitro[J]. J Thorac Cardiovasc Surg, 2003, 125(6): 1470-1480. |



