埃博拉病毒(Ebola virus,EBOV)引起的埃博拉病毒病(Ebola virus disease,EVD)是迄今发现的凶猛烈性传染病之一[1, 2]。自1976 年在扎伊尔(现刚果民主共和国)靠近埃博拉河(Ebola River)的一个村庄(Yambuku)以及在苏丹的恩扎拉(Nzara) 地区同时发生的两起暴发流行以来,先后在几内亚、利比里亚、塞拉利昂、苏丹、乌干达、刚果、加蓬等非洲国家发生过 8次较大规模人群流行,平均病死率高达67.98% (47.41%~89.51%)[3]。尤其是2014年3月在西非几内亚报告出现首批EVD病例后,疫情通过陆路边界传到塞拉利昂和利比里亚,又通过飞机上的1名旅客传到尼日利亚,演变成自1976以来最大的埃博拉疫情。截止2014年8月13日WHO报告累计确诊或疑似病例2 127例,死亡1 145例,主要集中在几内亚、利比里亚和塞拉利昂等西非三国[4]。随后,疫情在不断进展,截至2015年1月14日西非三国确诊病例为13 427 例,其中塞拉利昂和几内亚病死率为41.03%(4 226/10 300),引起了全球的高度关注[5]。为加强对EVD的防控,现从病原学角度对EBOV的形态特征、基因组结构、侵入机制、微生物学检查等方面作一介绍。 1 EBOV的生物学特性
EBOV属于丝状病毒科(Filoviridae)中埃博拉病毒属(Ebolavirus)成员。根据EBOV基因组差异及宿主谱不同可分为5种[6, 7],即:扎伊尔埃博拉病毒(Zaire-EBOV)、苏丹埃博拉病毒(Sudan-EBOV)、本迪布焦埃博拉病毒(Bundibugyo-EBOV)、塔伊森林埃博拉病毒(Tai Forest-EBOV)和雷斯顿埃博拉病毒 (Reston-EBOV)。不同种EBOV的毒力差异较大,Zaire- EBOV的毒力最强,曾引起多次暴发流行,2014年暴发流行于西非的EVD即为该种病毒所致[8];Sudan-EBOV的毒力仅次于Zaire-EBOV,也有多次流行报道,致死率约 50%;Bundibugyo-EBOV 的毒力更次之,曾有2次引起人感染的报道;Tai Forest-EBOV可对黑猩猩致死,对人的毒力相对弱;Reston-EBOV对非人灵长类动物(如黑猩猩、猴等)有致死性,人可以感染但不发病或发病轻微[6, 9, 10]。 1.1 形态与结构
EBOV为一种丝状单股负链RNA 病毒,电镜下呈线形管状结构,长300~1 500 nm,直径约 80 nm。病毒常呈分枝状,毒力强的病毒通常呈现中等长度[3, 11]。病毒结构较复杂,含有依赖RNA之RNA聚合酶复合体的病毒核心(core),具有螺旋对称的病毒核衣壳(nucleocapsid),病毒表面有包膜(envelope),包膜上镶嵌有病毒基因组编码的刺突(图 1)。
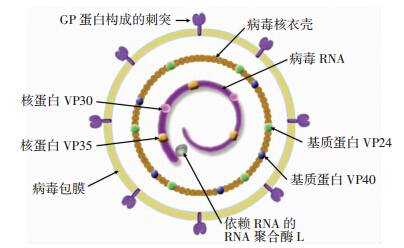 |
| 图 1 EBOV的结构示意图(横截面) |
EBOV 基因组全长约 18.9 kb,不分节段,拥有7个开放阅读编码框,编码7种病毒特异性结构蛋白[3],其在基因组上的排列见图 2。与脊髓灰质炎病毒等单股正链RNA病毒不同,EBOV基因组的5′端不带帽状结构(5′-Cap),3′端也不带poly A尾(poly-adenyl-ation),这种负链RNA基因组进入易感细胞后,不能直接与核糖体结合,启动病毒相关复制酶的合成,而需要由病毒颗粒本身携带的依赖RNA的RNA聚合酶先启动,将病毒基因组转录成正链(mRNA),再进行病毒的复制。病毒核心由2种核糖核蛋白(RNP) 及1条RNA分子构成,其中的线性负链RNA分子呈螺旋状,其上除结合有2种核糖核蛋白(VP35和VP30)外,还结合了1种结构蛋白L,该L蛋白即为依赖RNA的 RNA 聚合酶;VP35 蛋白是L 蛋白的1种辅因子,与EBOV复制相关;VP30 则与EBOV的转录有关。病毒核心之外则由核衣壳蛋白NP形成的核壳体包裹,对病毒RNA起保护作用。核衣壳与病毒包膜之间存在VP24和VP40 2种基质蛋白,与EBOV的成熟和释放相关。病毒的最外层由病毒包膜包裹,此类包膜来源于宿主细胞膜,在包膜上有糖蛋白刺突,称为GP蛋白,是一种跨膜蛋白,相对分子质量 (150~170)×103,其主要功能是识别靶细胞上的病毒受体并促进EBOV与靶细胞膜融合,有助于病毒感染宿主细胞,同时该GP蛋白可诱导机体产生中和抗体,是目前研制EVD疫苗的重要候选靶点;在EBOV复制过程中,会释放一种可溶性蛋白称为sGP,相对分子质量 (60~70 )×103,可能参与EBOV的致病性[6, 13]。
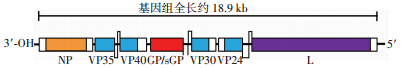 |
| 图 2 EBOV基因组及其结构蛋白编码区 |
EBOV可在人、猴、豚鼠等哺乳类动物细胞中增殖,其中Vero-E6、Hela-229、Vero-98 细胞最敏感[14]。病毒接种后,6~7 d 后可出现细胞病变,表现为细胞变圆,皱缩,甚至脱落,导致明显的致细胞病变效应(cytopathogenic effect,CPE)。将EBOV接种于猕猴后可产生与人类EVD类似的症状,并可致死。在仓鼠与豚鼠中,经多次传代后也可引起动物死亡。 1.4 抵抗力
EBOV在室温条件下较稳定,对温度敏感,60 ℃ 60 min可被灭活,对紫外线、γ射线、脂溶剂和酚类消毒剂均敏感。 2 EBOV的致病性
人类对EBOV普遍易感,感染后可发生EVD,以往称埃博拉出血热(Ebola haemorrhagic fever,EHF),潜伏期3~12 d。临床表现为突发高热(常≥39 ℃)、头痛、咽喉疼痛及肌肉痛,极度乏力;随后出现恶心、呕吐、腹痛、腹泻等症状;重症者可出现神志改变,如谵妄、嗜睡等,可伴有全身多部位不同程度出血,并可并发心肌炎、肺炎和多器官功能损害;病死率40%~90%[15, 16]。 2.1 传染源
EVD患者及可疑患者是重要传染源。目前虽然认为EVD是一种自然疫源性疾病,可在人和动物之间传播,但迄今对EBOV的自然储存宿主还不十分清楚,狐蝠科的果蝠可能是其中重要的一种[17],对EBOV在自然界中的循环方式尚有待深入研究。灵长类动物(如人、大猩猩、黑猩猩、猴类等)是EBOV的终末宿主,病毒可在人与非人灵长类之间传播[18]。 2.2 传统途径
接触传播是最主要的EBOV传播途径。EVD患者的血液、分泌液(如精液、唾液等)、排泄物(如尿液、粪便等)可含有高滴度的病毒,传染性强;此外,被患者血液或体液等污染的物品(如衣物、床单、毛巾等)也具有传染性。目前虽没有EBOV经空气传播的直接证据,但近距离接触EVD患者的喷溅物(如飞沫等)可导致传播[3, 5]。EBOV主要经眼、鼻、口腔黏膜以及破损的皮肤而侵入人体,经一定潜伏期后发病。 2.3 致病机制
EBOV 的致病机制尚不明确,其所致EVD的主要病理改变是单核吞噬系统 (mononuclear phagocytic system,MPS) 细胞受损,弥散性血管内凝血(disseminated inravascular coagulation,DIC),以及全身器官坏死,肝、肾、脾等脏器坏死尤为明显[19, 20]。故推测EBOV侵入机体后,先导致局部淋巴结感染,侵入单核细胞和巨噬细胞等MPS细胞,病毒再随这些受染细胞向其他组织转移;当EBOV被释放到淋巴液或血液中,可以引起肝、肾、脾等脏器以及全身巨噬细胞的感染,释放大量的炎症性细胞因子和细胞趋化因子,一些血管活性物质可引起血管内皮细胞的通透性增加,通过表面黏附因子、促凝因子和组织因子等复杂的病理作用,导致DIC的发生。
EVD的另一个重要临床特点是对宿主免疫反应的抑制作用[21],许多患者在还没有出现有效的免疫反应之前就已死亡,更有甚者,在患病后幸存者的恢复期血清中根本检测不到EBOV中和抗体的存在。有研究表明EBOV的VP35蛋白具有抑制干扰素产生功能[22]。在EBOV感染晚期患者的脾脏和淋巴结中可检测到大量的淋巴细胞凋亡,推测EBOV感染直接攻击免疫细胞,导致其凋亡,是产生免疫抑制效应的重要基础之一。淋巴细胞凋亡可能与EBOV特异性蛋白的作用有关,如VP40、GP等可通过上调肿瘤坏死因子(tumor necrosis factor,TNF)相关性凋亡诱导配体(TNF-related apoptosis-inducing ligand,TRAIL) 的表达,进而激活MPS细胞,树突状细胞(dendritic cell,DC)等,经由EVD发病过程中持续存在的高水平之IFN-α的作用,引起细胞凋亡的发生,进而起到抵抗宿主免疫防御的作用[23, 24]。这种对凋亡的调控可能也是EBOV 免疫致病的重要机制。 3 EBOV的微生物学检查
EBOV是高度危险的病原体,归类于生物危害度最高的4级病原体。进行活病毒的分离、培养和检测等操作必须在具有4级生物安全设施的实验室(BSL-4)中进行。在非洲疫区主要通过检测EBOV的特异性IgM和IgG抗体,以及通过检查病毒抗原或核酸等方法来进行疾病诊断[25]。 3.1 特异性抗体的检查
患者血液中的病毒特异性IgM抗体一般出现在EBOV感染早期,通常出现在发病后2~9 d,持续存在至发病之后的1~6个月;IgG抗体则通常在发病后6~18 d出现,可持续存在至发病后2年以上[26]。通过基因工程重组等方法制备的EBOV核心蛋白羧基端多肽作为抗原,建立的检测EBOV IgG抗体的ELISA方法,特异性和敏感性均较高。但对于少数急性期血清中特异性抗体滴度很低的患者,最好同时进行病毒抗原或核酸的检测,以免漏诊。 3.2 病毒特异性抗原和核酸的检查
有研究表明,检测EBOV病毒特异性抗原与检测病毒RNA的结果一致性几乎高达100%,敏感性也高。此外,由于对存在活病毒样本的处理要求很高(常要求在BSL-4中进行),仅用于病毒特异性抗原和核酸检查的样本可先用γ射线照射,灭活病毒后再采用ELISA法进行病毒抗原检测或采用实时荧光定量反转录PCR (RT-PCR) 进行病毒RNA的检测,实验安全性增高,且对实验结果没有显著影响。 3.3 病毒分离与鉴定
从病原学的角度,如果能从疑似EVD患者标本中分离鉴定出EBOV是临床诊断EVD的金标准。然而,由于对EBOV活病毒进行分离培养的要求非常严格,需要特殊的安全措施,故病毒分离培养目前尚不作为疫区EVD诊断的常用方法。在有安全防护的条件下,采集患者或EVD可疑患者的血液、痰液、骨髓液等标本,接种HeLa-229、Vero-E6、Vero-98等细胞[14],37 ℃ 5% CO2条件下培养3~7 d,出现CPE表现者,再采用病毒特异性单克隆抗体免疫荧光法等检测病毒的存在及复制状态,或通过RT-PCR等进行病毒鉴定。 4 预防建议 4.1 重视预防
控制EVD的扩散首先要贯彻以预防为主的方针。常规的措施包括密切关注世界范围内EVD疫情的发展动态;加强国境的检验与检疫,对来自疫区的猴子、黑猩猩等非人灵长类动物应暂停或限制进口;对来自疫区的有出血症状的疑似患者,应尽早隔离观察;一旦有确诊患者,应向卫生主管部门及时报告,同时对患者实施严格隔离,启用带有空气过滤装置的隔离设备;医护人员、检验人员、实验人员应穿戴有效的隔离服进行救治和操作,以防意外。 4.2 研制特异性疫苗预防
疫苗是预防和控制传染病的重要手段。目前对EVD尚无有效的疫苗上市,但EVD暴发的严重性及高致死率驱动着相关疫苗的研发[27]。基于EBOV的高危害性,传统疫苗,包括灭活疫苗、减毒疫苗等,并不适合于 EBOV的预防。在灭活疫苗制备过程中,需要大量地扩增病毒,这样会极大地增加实验操作人员的感染机会,而且,已有实验证实向豚鼠体内注射灭活EBOV病毒所诱导的抗病毒免疫并没有保护作用。减毒活疫苗除在制备过程中存在同样的实验人员感染风险外,疫苗在进入人体后可能出现的毒力恢复也是其安全性的严峻考验。
目前,重组疫苗是 EBOV 疫苗研制的重要方向和热点。将EBOV具有保护性表位的GP蛋白编码基因插入如狂犬病病毒[28]、鼠巨细胞病毒[29]、水疱性口炎病毒[30]等病毒疫苗株的基因组所构建的重组病毒疫苗,被证实具有很好的保护性能。以水疱性口炎病毒为骨架的重组疫苗不仅能起预防作用,甚至可在EBOV病毒暴露后给机体提供有效保护,如攻毒后 24 h 接种该重组疫苗,模型小鼠保护率可达 100%,在恒河猴和豚鼠模型中的保护率也可达 50%[30]。2014年9月,葛兰素史克生产的埃博拉疫苗在美国国立卫生研究院(national institutes of health,NIH)开展了Ⅰ期临床试验,通过健康人接种考察了疫苗的安全性能,即将开展大规模临床试验。我国科学家自主研发的针对2014基因突变型的重组埃博拉疫苗,已获得临床试验批件,正在开展Ⅰ、Ⅱ期临床试验。 5 展望
EBOV是引起人类迄今烈性传染病EVD的元凶。EBOV的病原学研究尚有许多盲区,包括病原体的变异与进化、自然循环的重要环节与传播方式、病毒的致病机制、病毒的免疫机制与免疫逃逸、宿主的免疫应答、易感动物模型的建立、微生物学检查新方法、病毒疫苗的适用靶点与构建策略等。建立有效和主动控制EVD的道路还十分遥远,呼吁加大对EBOV病原学基础研究的投入力度,鼓励有条件的研究机构和团队从不同角度探索EBOV及其引起的EVD。多源之水汇流成河,相信通过不懈的努力,智慧的人类最终能找到控制EBOV的有效途径。
志谢 衷心感谢本校微生物学教研室尚伟龙老师在文中插图制作上给予的帮助| [1] | Rosenthal P J, Bausch D G. Perspectives on Ebola [J]. Am Trop Med Hyg, 2015, [Epub ahead of print]. |
| [2] | Chiappelli F, Bakhordarian A, Thames A D, et al. Ebola: translational science considerations [J]. J Transl Med, 2015, 13(1): 11. |
| [3] | World Health Organiztion (WHO): Ebola virus disease[EB/OL][2015-01-26]. |
| [4] | 盛子洋, 范东瀛, 安静. 埃博拉病毒, 何去何从[J]. 微生物学免疫学进展, 2014, 42(5): 60-64. |
| [5] | 毛青, 杨智清, 陈盛, 等. 从埃博拉出血热到埃博拉病毒病:更新认识、科学救治[J]. 第三军医大学学报, 2015, 37(4): 277-281. |
| [6] | Barrette R W, Xu L, Rowland J M, et al. Current perspectives on the phylogeny of Filoviridae [J]. Infect Genet Evol, 2011, 11(7): 1514-1519. |
| [7] | Li Y H, Chen S P. Evolutionary history of Ebola virus [J]. Epidemiol Infect, 2014, 142(6): 1138-1145. |
| [8] | Baize S, Pannetier D, Oestereich L, et al. Emergence of Zaire Ebola virus disease in Guinea [J]. N Engl J Med, 2014, 371(15): 1418-1425. |
| [9] | Towner J S, Sealy T K, Khristova M L, et al. Newly discovered ebola virus associated with hemorrhagic fever outbreak in Uganda[J]. PLoS Pathog, 2008, 4(11): e1000212. |
| [10] | Gupta M, MacNeil A, Reed Z D, et al. Serology and cytokine profiles in patients infected with the newly discovered Bundibugyo ebolavirus [J]. Virology, 2012, 423(2): 119-124. |
| [11] | Olival K J, Hayman D T. Filoviruses in bats: current knowledge and future directions [J]. Viruses, 2014, 6(4): 1759-1788. |
| [12] | Hong J E, Hong K J, Choi W Y, et al. Ebola hemorrhagic Fever and the current state of vaccine development [J]. Osong Public Health Res Perspect, 2014, 5(6): 378-382. |
| [13] | Cristina J, Moreno P, Moratorio G, et al. Genome-wide analysis of codon usage bias in Ebolavirus [J]. Virus Res, 2015, 196: 87-93. |
| [14] | Zaki S R, Goldsmith C S. Pathologic features of filovirus infections in humans [J]. Curr Top Microbiol Immunol, 1999, 235: 97-116. |
| [15] | Chowell G, Nishiura H. Characterizing the transmission dynamics and control of ebola virus disease [J]. PLoS Biol, 2015, 13(1): e1002057. |
| [16] | 石明, 沈宇清. 埃博拉病毒侵染细胞机制的研究进展[J]. 病毒学报, 2013, 29(1): 71-74. |
| [17] | Mari-Saez A, Weiss S, Nowak K, et al. Investigating the zoonotic origin of the West African Ebola epidemic [J]. EMBO Mol Med, 2014, 7(1): 17-23. |
| [18] | Weingartl H M, Nfon C, Kobinger G. Review of Ebola virus infections in domestic animals [J]. Dev Biol (Basel), 2013, 135: 211-218. |
| [19] | Martines R B, Ng D L, Greer P W, et al. Tissue and cellular tropism, pathology and pathogenesis of Ebola and Marburg viruses [J]. J Pathol, 2015, 235(2): 153-174. |
| [20] | Rasmussen A L, Okumura A, Ferris M T, et al. Host genetic diversity enables Ebola hemorrhagic fever pathogenesis and resistance[J]. Science, 2014, 346(6212): 987-991. |
| [21] | Mateo M, Carbonnelle C, Reynard O, et al. VP24 is a molecular determinant of Ebola virus virulence in guinea pigs [J]. J Infect Dis, 2011, 204 (Suppl 3): S1011-S1020. |
| [22] | Basler C F, Wang X, Muhlberger E, et al. The Ebola virus VP35 protein functions as a type Ⅰ IFN antagonist [J]. Proc Natl Acad Sci U S A, 2000, 97(22): 12289-12294. |
| [23] | Gupta M, Spiropoulou C, Rollin P E. Ebola virus infection of human PBMCs causes massive death of macrophages, CD4 and CD8 T cell sub-populations in vitro [J]. Virology, 2007, 364(1): 45-54. |
| [24] | Hensley L E, Young H A, Jahrling P B, et al. Proinflammatory response during Ebola virus infection of primate models: possible involvement of the tumor necrosis factor receptor superfamily [J]. Immunol Lett, 2002, 80(3): 169-179. |
| [25] | World Health Organiztion (WHO). Laboratory guidance for the diagnosis of Ebola virus disease[EB/OL][2015-01-26]. |
| [26] | 中华人民共和国国家卫生和计划生育委员会. 埃博拉出血热防控方案[EB/OL](2014-08-01)[2015-01-26]. |
| [27] | Tully C M, Lambe T, Gilbert S C, et al. Emergency Ebola response: a new approach to the rapid design and development of vaccines against emerging diseases[J]. Lancet Infect Dis, 2015, [Epub ahead of print]. |
| [28] | Macneil A, Reed Z, Rollin P E. Serologic cross-reactivity of human IgM and IgG antibodies to five species of Ebola virus [J]. PLoS Negl Trop Dis, 2011, 5(6): e1175. |
| [29] | Blaney J E, Wirblich C, Papaneri A B, et al. Inactivated or live-attenuated bivalent vaccines that confer protection against rabies and Ebola viruses [J]. J Virol, 2011, 85(20): 10605-10616. |
| [30] | Tsuda Y, Caposio P, Parkins C J, et al. A replicating cytomegalovirus-based vaccine encoding a single Ebola virus nucleoprotein CTL epitope confers protection against Ebola virus [J]. PLoS Negl Trop Dis, 2011, 5(8) : e1275. |



