蛛网膜下腔出血(subarachnoid hemorrhage,SAH)有着很高的致死致残率[1]。已证实,SAH的早期阶段是出血后最危险的时间段,出现早期脑损伤(early brain injury,EBI)的一系列病理生理过程,即包含血脑屏障通透性改变、急性脑血管痉挛和脑水肿等是导致患者急性期死亡的最主要原因[2]。如何有效地治疗早期脑损伤成为防治SAH的主要目标,但其确切机制尚不清楚。
我们先前的研究证实[3],大鼠SAH后脑铁含量的升高与铁调素(hepcidin,Hepc)的表达增高有关,但是Hepc引起细胞内铁代谢紊乱的机制仍不明确。研究提示,作为细胞铁转运的关键蛋白,膜铁转运蛋白1(ferroportin 1,Fpn1)及铜蓝蛋白(ceruloplasmin,CP)可能为Hepc表达的关键下游因子。Fpn1目前被认为是唯一确定的介导细胞内铁向细胞外转运的转运体。动物实验研究证实Fpn1的表达降低会引起铁在神经细胞的沉积[4],又因其在血脑屏障的表达较高,提示Fpn1在神经元铁输出及血脑屏障铁转运过程中可能发挥重要作用。CP主要氧化二价铁转变为三价铁,二价铁通过血脑屏障后被CP氧化后才能与转铁蛋白结合并被脑组织摄取。CP的表达降低会导致细胞内游离二价铁的过度积累,因而更容易受到氧化应激的伤害。因此,Fpn1和CP的表达改变可能是引起细胞内铁代谢紊乱的直接原因并可能在SAH后对早期脑损伤起着重要作用。然而目前SAH后上述分子表达的变化情况尚不清楚,为此,本研究通过建立大鼠SAH模型,利用形态学分析与分子生物学学检测,观察Fpn1和CP在SAH后铁代谢紊乱中的表达以及这种表达对SAH过程中脑水肿与脑通透性变化中的可能影响,以期为进一步阐明Fpn1和CP表达异常引起的铁代谢紊乱在SAH后EBI中的重要作用及其机制提供实验证据。
1 材料与方法 1.1 实验动物及分组清洁级(SPF)动物实验室标准条件下饲养的健康成年雄性Sprague-Dawley大鼠96只购于重庆医科大学实验动物中心,体质量(300±50)g,所有涉及动物的相关操作及动物的处死方法得到重庆医科大学附属第一医院伦理委员会批准。实验动物分为蛛网膜下腔出血(SAH)组和假手术(sham)对照组,各48只。并根据SAH后的处理时间分为24 h组和72 h组(参考文献[5, 6],BBB通透性的改变及脑水肿的高峰时间分别为24 h和72 h)。24 h组24只用于Western blot检测、24只用于免疫组化检测、24只用于BBB通透性检测;72 h组24只用于脑水肿检测;各组均为12只SAH+12只sham。
1.2 大鼠SAH模型的制备采用大鼠视交叉前池注血法构建大鼠SAH模型[7]。3.5%水合氯醛以100 g/mL剂量腹腔麻醉大鼠,麻醉满意后取仰卧位,固定于操作板后常规消毒右侧腹股沟处。逐层分离皮肤及皮下组织,暴露右侧股动脉,粗线留置结扎线,覆盖保护切口待用。取俯卧位,固定大鼠于小动物立体定位仪上,消毒头部皮肤,确定大鼠颅顶中线位置,纵向剪开约1 cm皮肤,分离皮下组织,暴露骨膜,钝性分离骨膜,暴露颅骨。显露前囟点,在距前囟前0.5 cm,中线旁开0.3 cm处标记。用电动牙科钻钻孔,孔径约0.1 cm,小心挑破硬脑膜,可见清亮脑脊液流出,确认未损伤颅内血管。直径约0.5 mm塑料细管沿前颅窝方向紧靠颅骨,注意避让脑组织,缓慢深入到颅底,进入深度约1 cm,细管另一端与1 mL空针相连并缓慢抽取约微量脑脊液证实到达颅底且管通畅。迅速以1 mL空针行大鼠右侧股动脉穿刺术,抽取大鼠股动脉血约0.3 mL,确保血液未凝固后缓慢注入蛛网膜下腔,时间控制在30 s左右,并观察动物呼吸等生命体征。注入完毕后观察未见血液溢出取出细管,颅骨小孔用医用骨蜡封严,敷料覆盖头部创口,缝合右侧腹股沟皮肤切口后观察颅骨小孔未见出血,逐层缝合头皮。保持头低位30 min。sham组模型构建同上,区别在于仅置管后注入等量0.9%生理盐水。
1.3 BBB通透性的测定据文献[5]报道方法进行。大鼠SAH模型构建后24 h常规麻醉,4%伊文思蓝液(evans blue,EB)以2.5 mL/kg体质量从大鼠尾静脉注入,确认进入循环系统后循环约1 h。后以PBS磷酸盐缓冲液主动脉灌注,确认灌注液呈清亮后停止,断头取脑,称质量。按照10 mL/g质量浸入甲酰胺溶液,在60 ℃恒温水浴箱中抽提24 h,甲酰胺溶液呈现深浅不同的蓝色,脑组织呈现无色透明状。以纯甲酰胺溶液作为对照组,设定分光光度计的波长为620 nm,调定纯甲酰胺溶液的比值然后测定含有EB的甲酰胺溶液的光密度值,测定EB的量,从而评价BBB通透性改变的大小。
1.4 脑水肿的测定于大鼠构建SAH模型后72 h断头取脑,以高精度电子天平测定脑组织湿质量(wet weight,WW)精确到万分之一克。称量后脑组织置于100 ℃烤箱烤干24 h,高精度电子天平称量干质量(dry weight,DW),精确到万分之一克。脑水肿测定参照以下公式:脑水肿值=[(WW-DW)/WW]×100%[8]。
1.5 免疫组织化学法检测Fpn1和CP的表达构建大鼠SAH模型24 h后麻醉大鼠,打开胸腔,自左心室至主动脉弓处以灌注针进入,4%多聚甲醛灌注固定后断头取脑,分离大脑皮层与海马行石蜡包埋切片,厚度4 μm。选用碧云天公司的免疫组化试剂盒,按照说明书以S-P法进行染色,以PBS缓冲液代替一抗作空白对照。主要操作步骤如下:脱蜡、酒精梯度脱水至水;过氧化氢处理10 min,枸橼酸缓冲液热修复30 min,山羊血清室温20 min。然后加入一抗兔抗Fpn1(1 ∶200;Abcam,USA)和一抗兔抗CP(1 ∶200;Abcam,USA)4 ℃孵育过夜。二抗工作液使用生物素标记山羊抗兔IgG(博士德,武汉),37 ℃孵育15 min;使用辣根酶标记链霉卵白素工作液(S-A/HRP)与二抗结合孵育15 min,显色剂选用DAB液。常规苏木精复染、盐酸酒精分化、乙醇脱水后中性树脂封片。切片各取5个视野,显微镜下400倍放大,在相同的光强度环境下拍摄照片,定量比较各图片的平均光密度值,出现在细胞膜及细胞间隙的黄褐色色素沉积认定为阳性。使用专业图像分析软件(Image-Pro plus 6.0图像分析系统)测定不同区域及组别蛋白表达的光密度值,半定量分析目的蛋白在大鼠大脑皮层的分布[9]。
1.6 Western blot检测Fpn1和CP的表达大鼠SAH模型构建24 h后断头取脑,低温环境下分离大鼠海马组织后-80 ℃超低温冰箱留存备用。海马组织置于匀浆器,加入组织裂解液(购自碧云天公司),振荡混匀,并于冰水浴中裂解30 min,匀浆液呈清凉半透明状。加入上样缓冲液强力混匀后置于100 ℃水浴箱中静置3~5 min,在高速离心机上4 ℃条件下离心,控制转速为12 000 r/min持续15 min,然后弃去离心沉淀,回收清亮上层液。蛋白浓度测定选用BCA法。标准蛋白质变性方法后离心完毕,上样。按照使用说明配制电泳用胶,PVDE转膜。封闭液采用5%脱脂牛奶。取光滑蜡板,滴加1 ∶100抗目的蛋白抗体(抗Fpn1和CP抗体,Abcam,USA),内参条带滴加1 ∶2 000抗GAPDH抗体(中杉生物,中国),完成后置于4 ℃冰箱孵育。二抗抗体为羊抗兔(中杉生物,中国,1 ∶2 000),滴加后置于37 ℃恒温箱中孵育约1 h。标准方法配制AB发光液。显影曝光选用凝胶成像仪,条带结果分析使用Quantity One软件,以
GAPDH作为内参照条带,计算结果与其比值。
以表示计量资料,采用统计软件SPSS 18.0进行检 验。两组之间比较行t检验。检验水准设定为α=0.05。
2 结果 2.1 SAH后BBB通透性的改变通过渗出的伊文思蓝的量来评估BBB通透性改 变的差异。SAH组和sham组光密度值分别为(0.450± 0.010)、(0.404±0.010),二者存在统计学差异(P<0.01),证实构建的大鼠SAH模型造成了严重的BBB通透性改变。
2.2 SAH后脑水肿改变在构建SAH模型后72 h大鼠脑水肿达到最大值,脑组织含水量SAH平均达到78.01%,sham组平均值则为75.74%,两组脑水肿差值达到2.27%。证实构建SAH模型后出现明显脑水肿,脑组织含水量变化有统计学差异(P<0.05),可见SAH模型后血脑屏障通透性及脑组织含水量均较sham组明显加剧,证实构建模型造成严重脑损伤。
2.3 免疫组化染色检测大鼠大脑皮层与海马Fpn1和CP的表达免疫组化染色结果显示,Fpn1和CP两种蛋白在大鼠大脑皮层和海马均有表达。在sham组可见到在细胞质内Fpn1和CP的阳性表达,而在SAH组仅见到弱阳性表达(图 1)。阳性主要表现为细胞质内的黄褐色聚集,阴性则相对较弱。局部放大后,我们进一步观察到Fpn1和CP为浆甚至膜分泌型蛋白,少量分布于细胞质及细胞间质。SAH模型24 h后Fpn1和CP在大鼠大脑皮层的表达各组差异显著(表 1)。

|
| ↑:示Fpn1和CP阳性表达 |
| 图 1 免疫组化检测各组大鼠大脑皮层和海马Fpn1和CP的细胞质表达 (标尺=40 μm) |
| 组别 | 脑皮层组织Fpn1 | 脑皮层组织CP | 脑海马组织Fpn1 | 脑海马组织CP |
| sham组 | 0.014 5±0.001 8 | 0.011 6±0.001 9 | 0.072 9±0.001 7 | 0.088 2±0.002 3 |
| SAH组 | 0.004 5±0.000 9a | 0.001 5±0.000 2a | 0.0163 0±0.002 0a | 0.018 0±0.002 6a |
Western blot证实构建SAH模型24 h后,大鼠大脑皮质和海马组织内Fpn1和CP的表达均较sham组明显下调(P<0.05),证实蛛网膜下腔出血后目的蛋白的表达均受抑制。图 2为SAH组和sham组大鼠皮质和海马组织Fpn1和CP表达,可见SAH后两种铁转运相关蛋白的表达均明显受抑制。
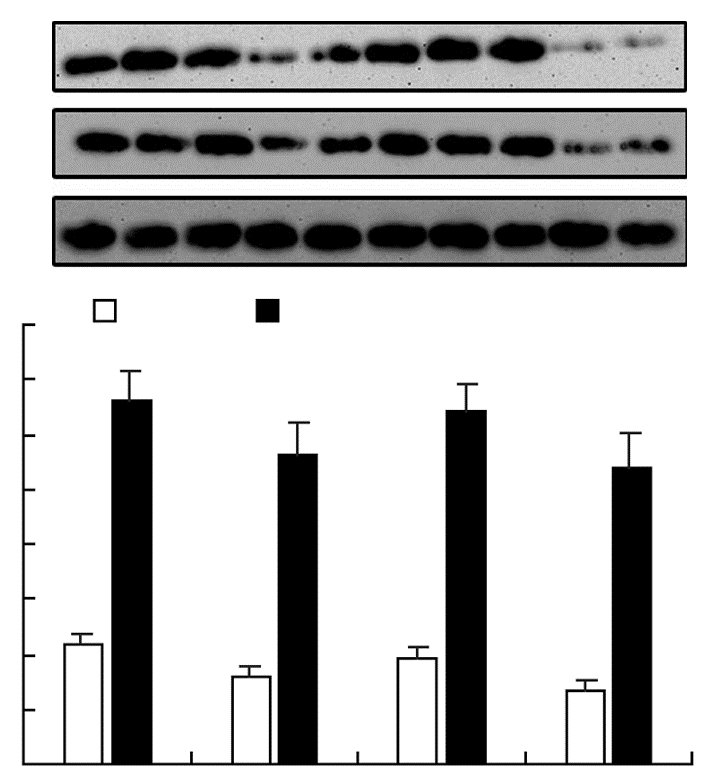
|
| 1-5:海马;6-10:皮层 A:Western blot 检测结果;B:半定量分析结果 a: P<0.05,与sham组比较 |
| 图 2 各组大鼠大脑皮层和海马Fpn1和CP的蛋白的表达 |
本课题组前期研究证实[3],大鼠SAH后脑铁含量的升高与铁调素的表达增高有关,但是铁调素引起细胞内铁代谢紊乱的机制仍不明确。本研究发现脑通透性与脑水肿都发生明显的改变,证明本研究所建立的动物模型是成功的。通过免疫组化与Western blot检测结果显示,SAH后Fpn1和CP表达较对照组明显降低,提示 二者表达的下降可能是SAH后铁代谢紊乱的重要原因。
Fpn1是铁代谢和转运的直接执行者之一。Hepc是Fpn1和CP的上游蛋白,后两者是铁代谢和转运的直接执行者。Hepc是由肝脏合成并分泌的多肽类物质,是调控Fpn1和CP表达的上游蛋白,从而直接影响细胞内外铁的代谢和转运。Pigeon等[10]首先发现Hepc对铁代谢的稳态存在调节作用。Frazer等[11]的研究发现血浆铁调素直接作用于小肠绒毛细胞,调节FPn1的表达,改变铁的运出率。Nemeth等[12]证实FPN1是Hepc的受体,Hepc可以使fpn1的表达降低并促进其降解。CP是一种重要的亚铁氧化酶,可以促进二甲铁离子氧化为三价,帮助铁与转铁蛋白结合。只有三价铁才能与转铁蛋白结合,因此,CP对机体铁转运和平衡具有重要作用[13]。文献报道证实大鼠SAH模型后,Hepc表达显著上调,且大鼠海马组织Hepc蛋白的表达量与海马铁含量呈正相关。而在本研究中发现SAH模型后Fpn1表达量降低,提示Fpn1在SAH中可能起着重要的作用,而这种作用可能受到升高的Hepc下调Fpn1的表达而产生。
CP是铁代谢和转运的另一个直接执行者。正常情况下,CP不能通过血脑屏障[14]。Klomp等[15]研究发现CP可以在人和鼠的中枢神经系统中表达,包括大脑皮层、基底节、海马、黑质、小脑、胼胝体等,提示脑内有CP的合成。无CP血症的研究发现包括中枢神经系统在内的多种组织器官中有过量铁的聚集,提示了CP的铁调节作用。铁代谢紊乱如何加剧SAH后的早期脑损伤的呢?研究发现,细胞内铁离子沉积的主要危害在于铁离子参与了机体在代谢过程中的活性氧簇反应(ROS),并使ROS反应性增强,产生羟自由基,导致生物分子氧化损伤。在脑损伤模型中研究发现ROS通过多种机制导致细胞凋亡[16, 17, 18]。铁离子还可以通过改变线粒体内Ca2+代谢紊乱直接导致细胞凋亡[19]。已有研究证实[20]脑内铁代谢紊乱是一些神经退行性疾病神经元凋亡的可能原因。但是在蛛网膜下腔出血后早期脑损伤诱导的内质网应激所致的细胞凋亡中是否存在相似的机制目前还不是很清楚。
内质网应激可以诱导两种铁代谢相关蛋白的上游蛋白Hepc表达升高[21]。其机制是Hepc基因片段中存在CCAAT增强子结合蛋白(CCAAT enhancer binding proteins,C/EBP)结合位点,C/EBP可与该位点结合诱导Hepc基因表达。而C/EBPα可与C/EBP其他家族成员形成异源二聚体,抑制C/EBP活性,进而抑制Hepc的表达[22]。CHOP是C/EBP转录因子家族成员,我们已经研究发现[23],CHOP可以耗竭C/EBPα对C/EBP其他家族成员的抑制作用,转而促进Hepc进的表达,提示CHOP是Hepc表达的上游因子,而CHOP则是内质网应激的关键位点,表明蛛网膜下腔出血后内质网应激和脑内铁代谢存在联系。而Hepc是如何调控铁代谢的,是本研究要解决的问题。而本研究同时发现SAH模型后CP表达量降低,提示通过Hepc调控的CP表达在SAH中同样起着重要的作用。
本研究及课题组前期研究结果[3]显示,SAH后内质网应激导致Hepc的表达升高,继而引起下游铁代谢相关蛋白Fpn1和CP的表达下调,造成神经元内的铁潴留从而加重脑水肿和血脑屏障通透性的破坏,提示对铁代谢相关蛋白和上游内质网应激蛋白的调控可能会对临床上蛛网膜下腔出血患者的预后产生良好作用,从而指导SAH的临床治疗。下一步的研究工作是对上述分子以及其他铁代谢相关的重要蛋白的表达进行干预,从多水平、多角度证明铁代谢相关蛋白的表达与下游事件的关系,如使用干扰RNA在基因水平上干预Hepc的表达等,以期通过降低其表达减轻SAH后早期脑损伤的发生程度,进一步解释SAH的发病机制,并为临床SAH的治疗提供新的思路。
| [1] | Kaptain G J, Lanzino G, Kassell N F. Subarachnoid haemorrhage: epidemiology, risk factors, and treatment options[J]. Drugs Aging, 2000, 17(3): 183-199. |
| [2] | Cahill J, Zhang J H. Subarachnoid hemorrhage: is it time for a new direction?[J]. Stroke, 2009, 40(3 Suppl): S86-S87. |
| [3] | 刘浏, 谭关平, 陈耀隆, 等. 实验性蛛网膜下腔出血后早期铁调素表达的变化[J]. 中国神经精神疾病杂志, 2013, 39(12): 710-714. |
| [4] | Li L, Li Y W, Zhao J Y, et al. Quantitative analysis of iron concentration and expression of ferroportin 1 in the cortex and hippocampus of rats induced by cerebral ischemia[J]. J Clin Neurosci, 2009, 16(11): 1466-1472. |
| [5] | 李志清. 蛛网膜下腔出血后血脑屏障通透性变化及其调控机制研究[D]. 沈阳: 中国医科大学, 2010. |
| [6] | 邵波.大鼠蛛网膜下腔出血后自噬激活和早期脑损伤的研究[D]. 杭州: 浙江大学, 2011. |
| [7] | Wang Z, Zuo G, Shi X Y, et al. Progesterone administration modulates cortical TLR4/NF-kappaB signaling pathway after subarachnoid hemorrhage in male rats[J]. Mediators Inflamm, 2011, 2011: 848309. |
| [8] | Hockel K, Trabold R, Scholler K, et al. Impact of anesthesia on pathophysiology and mortality following subarachnoid hemorrhage in rats[J]. Exp Transl Stroke Med, 2012, 4(1): 5. |
| [9] | Wang S M, Fu L J, Duan X L, et al. Role of Hepcidin in murine brain iron metabolism[J]. Cell Mol Life Sci, 2010, 67(1): 123-133. |
| [10] | Pigeon C, Ilyin G, Courselaud B, et al. A new mouse liver-specific gene, encoding a protein homologous to human antimicrobial peptide hepcidin, is overexpressed during iron overload[J]. J Biol Chem, 2001, 276(11): 7811-7819. |
| [11] | Frazer D M, Anderson G J. The orchestration of body iron intake: how and where do enterocytes receive their cues?[J]. Blood Cells Mol Dis, 2003, 30(3): 288-297. |
| [12] | Nemeth E, Tuttle M S, Powelson J, et al. Hepcidin regulates cellular iron efflux by binding to ferroportin and inducing its internalization[J]. Science, 2004, 306(5704): 2090-2093. |
| [13] | Gitlin J D. Aceruloplasminemia[J]. Pediatr Res, 1998, 44(3): 271-276. |
| [14] | Qian Z M, Wang Q. Expression of iron transport proteins and excessive iron accumulation in the brain in neurodegenerative disorders[J]. Brain Res Brain Res Rev, 1998, 27(3): 257-267. |
| [15] | Klomp L W, Farhangrazi Z S, Dugan L L, et al. Ceruloplasmin gene expression in the murine central nervous system[J]. J Clin Invest, 1996, 98(1): 207-215. |
| [16] | Jomova K, Vondrakova D, Lawson M, et al. Metals, oxidative stress and neurodegenerative disorders[J]. Mol Cell Biochem, 2010, 345(1/2): 91-104. |
| [17] | Ghribi O, Golovko MY, Larsen B, et al. Deposition of iron and beta-amyloid plaques is associated with cortical cellular damage in rabbits fed with long-term cholesterol-enriched diets[J]. J Neurochem, 2006, 99(2): 438-449. |
| [18] | Ong W Y, Halliwell B. Iron, atherosclerosis, and neurodegeneration: a key role for cholesterol in promoting iron-dependent oxidative damage?[J]. Ann N Y Acad Sci, 2004, 1012: 51-64. |
| [19] | Yeo J E, Kang S K. Selenium effectively inhibits ROS-mediated apoptotic neural precursor cell death in vitro and in vivo in traumatic brain injury[J]. Biochim Biophys Acta, 2007, 1772(11/12): 1199-1210. |
| [20] | Ke Y, Qian Z M. Iron misregulation in the brain: a primary cause of neurodegenerative disorders[J]. Lancet Neurol, 2003, 2(4): 246-253. |
| [21] | Oliveira S J, Pinto J P, Picarote G, et al. ER stress-inducible factor CHOP affects the expression of hepcidin by modulating C/EBPalpha activity[J]. PLoS One, 2009, 4(8): e6618. |
| [22] | Vecchi C, Montosi G, Zhang K, et al. ER stress controls iron metabolism through induction of hepcidin[J]. Science, 2009, 325(5942): 877-880. |
| [23] | He Z, Ostrowski RP, Sun X, et al. CHOP silencing reduces acute brain injury in the rat model of subarachnoid hemorrhage[J]. Stroke, 2012, 43(2): 484-490. |



