近年来,有关骨髓间充质干细胞(mesenchymal stem cells,MSCs)移植在心肌梗死(myocardial Infarction,MI)后组织修复等方面的研究带来了曙光[1]。基础研究显示,心肌梗死后移植或局部注射MSCs可在梗死交界区域存活并分化为心肌、血管内皮血管,改善心室重构,提高梗死后左心室功能[2, 3]。但目前对移植细胞低生存率的原因仍不清楚。核因子相关因子2(Nrf2)是抗氧化应激反应重要的因子 。当发生氧化应激时,Nrf2与Keap1分离并转位至核内与抗氧化反应元件结合,启动抗氧化反应元件介导的抗氧化酶蛋白和Ⅱ相解毒酶基因转录和表达,发挥抗氧化应激保护细胞作用[4]。但也有不一致的文献报道,Ichihara等[5]研究显示,Nrf2基因缺失能通过提高机体组织炎症反应而促进缺血组织的血管形成。这提示激活Nrf2对机体是不利的。那么Nrf2在机体中的作用是有力还是不利呢?而Nrf2在 MSCs中作用如何,Nrf2是不是抵御恶劣外环境并使其存活的关键因子呢?本课题组前期通过干扰MSCs中Nrf2的作用,观察到干扰细胞中Nrf2后,细胞增殖分化和迁移能力均下降,细胞凋亡率增加。为了进一步观察干扰Nrf2的MSCs在体内的作用,本研究应用干扰Nrf2的MSCs移植至心肌梗死的大鼠模型,观察其在心肌梗死后微环境中凋亡的情况及 对梗死后心功能的影响。
1 材料与方法 1.1 主要实验试剂与仪器沉默Nrf2基因(siRNA-Nrf2-EGFP-LV)和空载体携带EGFP的慢病毒载体(siRNA-EGFP-LV)购自南京凯基生物公司。DMEM培养基、胰蛋白酶和胎牛血清均购自HyClone公司。兔抗大鼠Nrf2抗体、HO-1抗体、caspase3抗体、Bcl-2抗体、Bax抗体、GAPDH抗体和HistoneH3抗体均购自Abcam公司;Masson和TTC染色试剂盒均购自南京奥多福尼生物科技有限公司。图像处理系统为德国莱卡公司的Leica Qwin Plus。
1.2 实验动物和分组2~3个月龄清洁级SD大鼠60只,雌雄不限,体质量200~250 g,购自中国人民解放军第三军医大学大坪医院实验动物中心[合格证号:SCXK(渝)2012-0005]。构建心肌梗死模型,利用随机数字表进行分组①siRNA-Nrf2-EGFP-LV转染MSCs移植组(Nrf2干扰组);②siRNA-EGFP-LV转染MSCs移植组(Nrf2正常组);③注射等体积PBS作对照(对照组n=12)。实验过程中如有动物死亡,则按同样方法补充相应的动物。
1.3 MSCs的培养、鉴定及慢病毒转染及Nrf2表达检测参考课题组前期实验方法[1, 6]培养细胞,采用全骨髓贴壁法培养获得大鼠骨髓MSCs。第3代(P3)细胞用于实验。
细胞转染方法参考课题组前期实验方法,细胞转染后72 h,应用流式细胞仪检测转染后细胞凋亡率,荧光显微镜观察转染细胞形态[1, 6]。在缺氧状态下,细胞转染siRNA-Nrf2-EGFP-LV,转染PBS作为对照,应用Western blot检测病毒转染后6 h(预实验得结果)MSCs中Nrf2蛋白的表达,最后使用奥德赛软件测出条带的积分光密度值(IOD),使用目的蛋白IOD与内参蛋白IOD的比值,进行统计学分析。重复转染细胞,细胞转染后72 h,胰蛋白酶消化细胞,以无血清DMEM制成MSCs细胞悬液用于细胞移植。
1.4 建立大鼠心肌梗死模型及细胞移植参照课题组前期实验建立大鼠心肌梗死模型,通过观察心室心肌局部心肌颜色变化及心电图ST段判断模型是否建立成功[1]。10 min后,采用胰岛素注射针在梗死交界区注射2×106/0.3 mL的细胞。逐层关胸,待大鼠转为苏醒状态时清除气管内分泌物,缓慢拔出器官插管并缝合。若出现提前死亡,及时补足各组大鼠数量。
1.5 心功能的测定心肌梗死细胞移植后28 d再次麻醉大鼠,剃毛后用频率为10 MHz的超声探头,置于大鼠胸骨左缘第4、5肋间,测量左室舒张末期内径(LVDd)和收缩末期内径(LVDs),并计算射血分数(EF)值。心功能检测完毕处死动物行相关病理学检查。
1.6 组织病理学检查在心肌梗死细胞移植后28 d处死大鼠立即取出心脏,沿梗死交界区中部垂直于长轴的方向切去厚约5 mm的心肌组织存放于10%多聚甲醛缓冲液中固定,常规脱水,透明,石蜡包埋。常规HE染色,并在普通显微镜下观察心肌组织结构。
1.7 TTC染色检测心境梗死面积心肌梗死细胞移植后28 d行心肌TTC染色。麻醉、消毒大鼠后打开大鼠胸腔,将1 mL新鲜配制的0.1% TTC溶液用1 mL注射器由下腔静脉逆行缓慢注入,保持心脏跳动3~4 min后,摘取心脏并用生理盐水洗净心脏中的残留血液,迅速置于-80 ℃冰箱冻存10 min,切片并置于4%多聚甲醛固定20~30 min,使用计算机图像分软件计算心肌梗死面积并测量室壁厚度。
1.8 组织免疫荧光检测心肌梗死区心肌凋亡蛋白caspase3的表达情况取-20 ℃梗死心肌切片,由于切片冻存前已经冰丙酮处理,故置于室温复温后直接加入1%BSA液封闭2 h,加兔抗大鼠caspase3抗体(1∶200),4 ℃湿盒过夜,PBS冲洗后加羊抗兔二抗37 ℃避光孵育1 h,PBS冲洗后加入DAPI染核10 min。用防荧光淬灭剂封片,在荧光显微镜下拍片并计算荧光强度。
1.9 Western blot检测梗死交界区Nrf2、Bcl-2、Bax的蛋白表达情况心肌梗死细胞移植后28 d,取梗死交界区心肌组织,加入适量的裂解液和PMSF(100∶1)后在冰上低温快速研磨匀浆、离心后取上清液。应用BCA蛋白定量试剂盒测定蛋白浓度。取样品上样行10%十二烷基硫酸钠(SDS)-聚丙酰胺凝胶电泳,再将电泳蛋白转移至硝酸纤维素膜上,以5%脱脂奶粉溶液于室温下封闭2 h,加入一抗于4 ℃摇床孵育过夜,加二抗于室温下避光孵育1 h。使用奥德赛软件测出条带的积分光密度值(IOD),使用目的蛋白IOD与内参蛋白IOD的比值,进行统计学分析。
1.10 统计学分析采用SPSS 17.0统计软件统计并分析本实验数据,所有数据以x±s表示,组间比较用单因素方差分析。
2 结果 2.1 骨髓间充质干细胞及病毒转染后增强型绿色荧光蛋白的表达情况镜下可见P3MSCs细胞形态呈长梭形状,分布均匀。慢病毒转染MSCs后72 h可见大量MSCs稳定表达绿色荧光,细胞形态未见明显改变,仍呈长梭形外观。
2.2 干扰siRNA对MSCs内Nrf2蛋白表达的情况观察细胞转染siRNA-Nrf2-EGFP-LV并在缺氧状态下预处理6h,Western blot检测结果显示,Nrf2干扰组Nrf2核蛋白(0.573±0.032)较对照组(0.104±0.051)表达显著降低(P<0.05),表明Nrf2 siRNA可成功干扰Nrf2的表达。
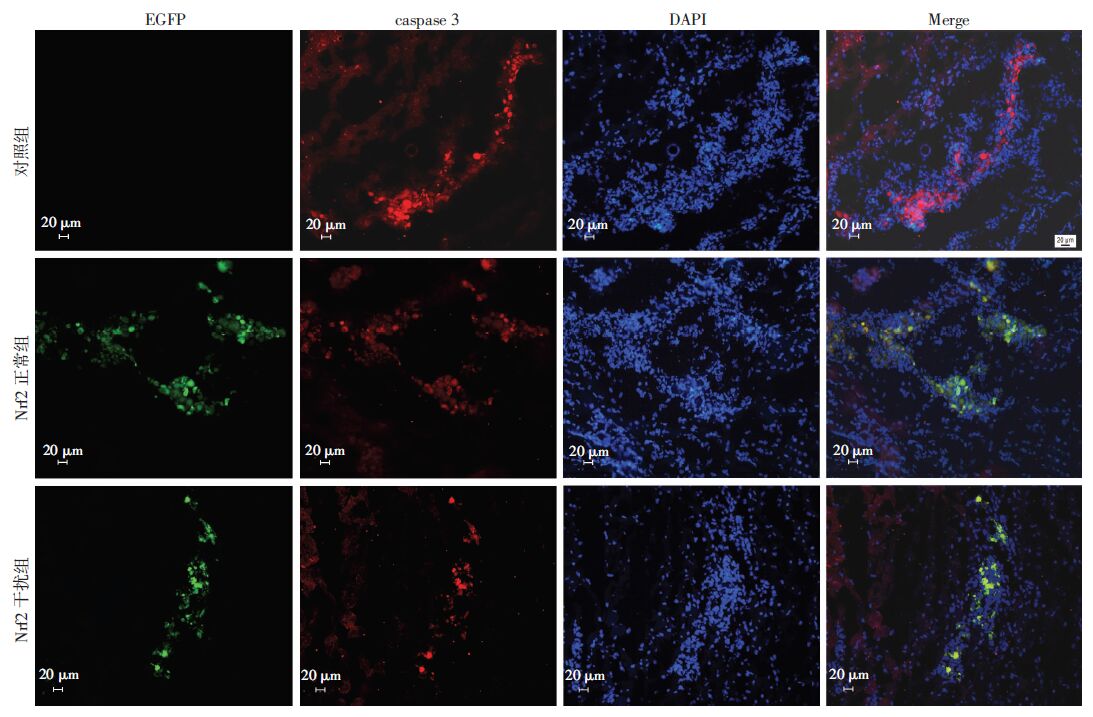
2.3 心肌梗死区移植细胞凋亡情况心梗细胞移植后7 d,梗死心肌区域检测到标记EGFP的MSCs存在,MSCs表达的区域caspase3表达阳性,从图中可见Nrf2干扰组EGFP及caspase3表达增加,Nrf2正常组caspase3表达降低,对照组未检测到EGFP表达(图 1)。梗死同一区域EGFP和caspase3表达阳性,表明携带GGFP的MSCs移植后在梗死局部发生凋亡。
|
| 图 1 大鼠心肌梗死并干扰Nrf2的MSCs移植后7 d免疫荧光检测心肌梗死局部EGFP和caspase3表达 (×200) |
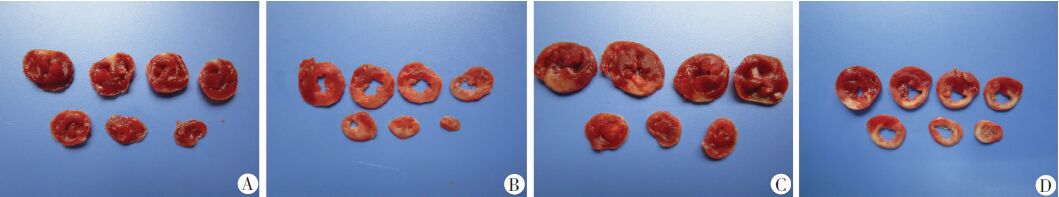
正常心肌组织HE染色显示结构完整,纤维排列整齐,细胞核、细胞质清晰可见,细胞间连接存在;心肌梗死细胞移植后28 d,Nrf2干扰组和对照组梗死交界区肌纤维排列稀疏紊乱,肌纤维断裂、间质充血水肿,并可见大量炎性细胞浸润;而Nrf2正常组上述病理改变均明显减轻。TTC染色显示,正常心肌染成砖红色,梗死心肌染成白色。心肌梗死细胞移植后28 d,TTC染色显示对照组梗死面积为(35.40±0.70)%,Nrf2正常组为(25.07±0.15)%,Nrf2干扰组为(35.3±0.41)%。Nrf2干扰组与Nrf2正常组比较心肌梗死面积增加(P<0.05),而与对照组比较,梗死面积无差异性(P>0.05,图 2)。
|
| A:正常心肌;B:对照组;C:Nrf2正常组;D:Nrf2干扰组 图 2 大鼠心肌梗死并干扰Nrf2的MSCs移植后28 d TTC染色观察大体标本 |
心梗细胞移植后28 d,采用Western blot检测各组大鼠左室心肌组织梗死交界区核蛋白Nrf2和凋亡相关蛋白表达,Bcl-2是促细胞生存,抗细胞凋亡基因,而Bax是促细胞凋亡基因,通过测定两种基因变化来评价Nrf2对细胞应激的影响。Western blot结果显示:与Nrf2正常组比较,Nrf2干扰组Nrf2、Bcl-2蛋白表达下降,Bax表达增加,差异有统计学意义(P<0.05);上述蛋白表达情况在Nrf2干扰组组与对照组相似,两组差异无统计学意义(P>0.05,图 3)。

|
| 1:Nrf2正常组;2:Nrf2干扰组;3:对照组 图 3 大鼠心肌梗死并干扰Nrf2的MSCs移植后28 d Western blot检测梗死心肌Nrf2及凋亡相关蛋白表达 |
心肌梗死细胞移植后28 d,超声心动图检测心功能结果显示,与对照组比较,siRNA-Nrf2转染MSCs移植组中LVDd和LVDs数值增大(P<0.05),EF值降低(P<0.05),差异均有统计学意义;而shRNA-Nrf2转染MSCs移植组与对照组比较,其LVDd和LVDs值均缩小(P<0.05),EF值增加(P<0.05,表 1)。
| (x±s,n=12) | |||
| 组别 | LVEF(%) | LVDd(mm) | LVDs(mm) |
| Nrf2正常组 | 52.35±11.580 | 0.79±0.025 | 0.61 ±0.026 |
| Nrf2干扰组 | 40.83±2.666a | 1.09±0.061a | 0.75±0.062a |
| 对照组 | 39.78±1.370 | 1.07±0.105 | 0.72±0.040 |
| a:P<0.05,与Nrf2正常组比较 | |||
近年来,有关MSCs移植在心肌梗死后组织修复等方面的研究提供了令人兴奋的结果[1, 2, 3]。我们前期动物实验研究也显示:基因修饰后的MSCs移植可改善心肌梗死后心脏功能并减轻血管成形术后再狭窄的发生[6]。然而,细胞移植低生存率仍是限制细胞疗效的关键[7]。细胞疗法导致细胞低生存率的确切机制目前仍不清楚。一方面可能与细胞从骨髓中分离出后,细胞不可避免地暴露在应激情况下,如低血清、缺氧、氧化应激。另一方面,由于炎症、化学损伤和炎症因子释放使凋亡蛋白表达增加。因此增加MSCs抵御恶劣微环境来增加细胞的治疗疗效是很有必要的。目前正在研究一些策略来改变细胞的生物特征和功能效应,例如,把细胞捕获在特殊的生物支架上,移植细胞预处理,改变细胞遗传学等。近来也有以下研究利用一些保护因子过表达在MSCs上增加细胞的生存能力。
Nrf2是内源性抗氧化应激的重要因子,当细胞损伤时Nrf2发挥重要的细胞保护作用,如缺血再灌注损伤[8]和炎症反应[9, 10]。同时,过表达Nrf2可减少心肌缺血再灌注损伤[11]。Mohammad等[12]在MSCs中过表达Nrf2后细胞死亡和细胞凋亡率明显减少,且在缺氧及氧化应激环境,MSCs中过表达Nrf2增加SOD和Ho-1的活性。在生理条件下,Nrf2与其胞浆抑制剂Keap1结合并呈低水平表达。当发生氧化应激时,Nrf2与Keap1分离并转位至核内从而诱导大量抗氧化和抗炎症基因表达[7]。但众所知之,细胞在缺氧、无血清及氧化应激情况下会发生死亡[13]。且多项研究显示:移植细胞仅仅有很低的生存率[14, 15]。再结合Barajas等[16]和Ichihara等[5]研究显示过度激活Nrf2对机体不利的作用。那么Nrf2究竟对细胞抗氧化应激的保护作用如何呢?
为了观察Nrf2对细胞的保护作用,前期课题组利用干扰Nrf2的慢病毒转染MSCs来干扰细胞中Nrf2的表达,观察到细胞中Nrf2被消弱后,细胞增殖、分化及迁移能力均减弱,同时细胞抗氧化基因HO-1表达明显减弱,MSCs对氧化应激环境的耐受能力明显降低,而Bcl-2表达显著下降,Bax表达显著增。进一步从反面证实了Mohammad等[12]将MSCs过表达Nrf2对细胞应对氧化应激的保护作用。为了在体内进一步验证体外结果。本实验利用转染siRNA-Nrf2的干细胞注射至心肌梗死大鼠的梗死交界区,观察移植细胞凋亡情况及对梗死后心功能的修复作用。结果显示:心肌梗死细胞移植后7 d,Nrf2正常组及Nrf2干扰组梗死心肌组织局部均可见Caspase3蛋白表达,但Nrf2正常组可见大量绿色荧光标记的EGFP表达,而Nrf2干扰组绿色荧光表达少,对照组未见荧光表达,提示梗死后细胞注射仍有部分细胞存活。心梗细胞移植后28 d,HE染色显示Nrf2干扰组梗死交界区心肌纤维排列紊乱,间质可见充血水肿明显可见大量炎性细胞浸润;而Nrf2干扰组心肌组织排列有序,间质充血减少炎性细胞浸润降低。TTC染色提示,Nrf2干扰组心肌梗死面积(35.3±0.41)%与Nrf2正常组(25.07±0.15)%比较明显增加(P<0.05),与对照组(35.40±0.70)%比较无差异性(P>0.05)。细胞移植对梗死后心功能的影响,Nrf2干扰组EF(40.83±2.67)%,LVDd,(1.09±0.061),LVDs(0.75±0.062),与Nrf2正常组EF(52.35±1.58)%,LVDd,(0.79± 0.0245),LVDs(0.61±0.026)比较(P<0.05),与对照组(EF,39.78%) (LVDd,1.07 mm)(LVDs,0.72 mm)比较,Nrf2干扰组对不能改善梗死后心功能(P>0.05)。由此可见,干扰MSCs中的Nrf2基因后,MSCs移植对梗死心脏无修复作用。
Bc1-2家族作为凋亡通路中的重要因子,在细胞凋亡过程中扮演了促凋亡和抗凋亡两个截然不同的角色,可分为以Bax为代表的促细胞凋亡因子和以Bc1-2为代表的抗细胞凋亡因子。Bcl-2/Bax比值对调控细胞凋亡有很重要的意义。本实验结果发现,心肌梗死细胞移植后28d,与Nrf2正常组比较,Nrf2干扰组心肌组织中Bcl-2表达降低,Bax表达增高,Bcl-2/Bax比值下降。由此可见,Nrf2信号在MSCs移植治疗中能保护细胞免受损伤并使其更有效地对梗死心肌发挥修复作用。
总之,本实验通过携带siRNA-Nrf2的慢病毒载体转染MSCs干扰细胞中Nrf2的表达后,干扰Nrf2的细胞移植不能有效改善心肌梗死面积,并且移植后促凋亡蛋白Bax表达增加,抑制凋亡蛋白Bcl-2表达减少,不利于所移植干细胞发挥心脏修复作用,这从反面为基因修饰的MSCs治疗心肌梗死提供了重要实验证据和理论依据。
| [1] | Chou S H, Lin S Z, Kuo W W, et al. Mesenchymal stem cell insights: prospects in cardiovascular therapy[J]. Cell Transplant, 2014, 23(4/5): 513-529. |
| [2] | Shi B, Long X, Zhao R, et al. Transplantation of mesenchymal stem cells carrying the human receptor activity-modifying protein 1 gene improves cardiac function and inhibits neointimal proliferation in the carotid angioplasty and myocardial infarction rabbit model [J]. Exp Biol Med (Maywood), 2014, 239(3): 356-365. |
| [3] | Zhao Y, Li T, Wei X, et al. Mesenchymal stem cell transplantation improves regional cardiac remodeling following ovine infarction[J]. Stem Cells Transl Med, 2012, 1(9): 685-695. |
| [4] | Ye M, Wang Q, Zhang W, et al. Oroxylin A exerts anti-inflammatory activity on lipopolysaccharide-induced mouse macrophage via Nrf2/ARE activation[J]. Biochem Cell Biol, 2014, 92(5): 337-348. |
| [5] | Ichihara S, Yamada Y, Liu F, et al. Ablation of the transcription factor Nrf2 promotes ischemia-induced neovascularization by enhancing the inflammatory response[J]. Arterioscler Thromb Vasc Biol, 2010, 30(8): 1553-1561. |
| [6] | 石蓓, 刘志江, 赵然尊, 等. 骨髓间充质干细胞移植对心肌梗死后心脏功能及损伤血管再狭窄的影响[J]. 中华医学杂志, 2011, 91(32): 2269-2273. |
| [7] | Li W, Ma N, Ong L L, et al. Bcl-2 engineered MSCs inhibited apoptosis and improved heart function[J]. Stem Cells, 2007, 25(8): 2118-2127. |
| [8] | Valen G. Extracardiac approaches to protecting the heart[J]. Eur J Cardiothorac Surg, 2009, 35(4): 651-657. |
| [9] | Tang Y L, Tang Y, Zhang Y C, et al. Improved graft mesenchymal stem cell survival in ischemic heart with a hypoxia-regulated heme oxygenase-1 vector[J]. J Am Coll Cardiol, 2013, 46(7): 1339-1350. |
| [10] | Huwer H, Welter C, Ozbek C, et al. Simultaneous surgical revascularization and angiogenic gene therapy in diffuse coronary artery disease[J]. Eur J Cardiothorac Surg, 2001, 20(6): 1128-1134. |
| [11] | Lee T M, Lin S Z, Chang N C. Antiarrhythmic effect of lithium in rats after myocardial infarction by activation of Nrf2/HO-1 signaling[J]. Free Radic Biol Med, 2014, 77: 71-81. |
| [12] | Mohammadzadeh M, Halabian R, Gharehbaghian A, et al. Nrf-2 overexpression in mesenchymal stem cells reduces oxidative stress-induced apoptosis and cytotoxicity[J]. Cell Stress Chaperones, 2012, 17(5): 553-565. |
| [13] | Zhu W, Chen J, Cong X, et al. Hypoxia and serum deprivation-induced apoptosis in mesenchymal stem cells[J]. Stem Cells, 2006, 24(2): 416-425. |
| [14] | Liu X B, Wang J A, Ji X Y, et al. Preconditioning of bone marrow mesenchymal stem cells by prolyl hydroxylase inhibition enhances cell survival and angiogenesis in vitro and after transplantation into the ischemic heart of rats[J]. Stem Cell Res Ther, 2014, 5(5): 111. |
| [15] | Lunde K, Solheim S, Aakhus S, et al. Intracoronary injection of mononuclear bone marrow cells in acute myocardial infarction [J]. N Engl J Med, 2006, 355(12): 1199-1209. |
| [16] | Barajas B, Che N, Yin F, et al. NF-E2-related factor 2 promotes atherosclerosis by effects on plasma lipoproteins and cholesterol transport that overshadow antioxidant protection[J]. Arterioscler Thromb Vasc Biol, 2011, 31(1): 58-66. |



