2. 400020 重庆,解放军第324医院神经内科
2. Department of Neurology, No. 324 Hospital of PLA, Chongqing, 400020, China
脑动脉硬化和血管性痴呆等慢性脑病的发病率逐年升高,严重威胁人类生命健康。研究发现这些疾病的共同致病机制之一在于慢性脑低灌注[1],但目前尚无针对性的治疗方法,某些药物在动物实验中具有保护性效果,而临床实验却令人失望。近年来动脉生成作为一种极具潜力的治疗方式备受关注,所形成的血管具有完全恢复阻塞区血供的潜力[2]。既往研究发现交感神经可能对外周动脉生成有重要影响[3],然而交感神经是否参与了脑动脉生成过程尚不明确。本研究通过右侧颈总动脉阻塞 (common carotid artery occlusion,CCAO)8周建立慢性脑低灌注模型,外科手术法去除同侧颈上交感神经节,观察失交感神经支配对慢性脑低灌注后脑动脉生成的影响。
1 材料与方法 1.1 主要材料与仪器尼龙线栓(型号2636-A4,北京西浓科技有限公司,北京);2,3,5-三苯基氯化四氮唑(TTC,Sigma公司,美国);一抗:Anti-alpha smooth muscle Actin antibody(ab5694,Abcam公司,英国);二步法免疫组化检测试剂盒(PV-6001,中杉金桥,北京)。体视学显微镜(SZX7,Olympus公司,日本);多普勒激光血流仪(LDF,型号VMS-LDF1,Moor公司,英国)。
1.2 动物分组SPF级雄性SD大鼠84只,体质量250~280 g,由第三军医大学实验动物中心提供。按随机数字表法分为动脉结扎+去神经组(联合组)、动脉结扎组、去神经组和假手术组,每组21只。每组又分为3个亚组(A、B、C),每个亚组7只:A组大鼠行乳胶灌注观察右侧软脑膜吻合支与Willis动脉环直径;B组大鼠行右侧大脑中动脉永久性阻塞(permanent middle cerebral artery occlusion,pMCAO),并测对应区域脑皮层血流量,24 h后行神经行为学评分,再断头取脑作TTC染色比较脑梗死体积大小;C组大鼠行免疫组化染色观察右侧软脑膜吻合支管径厚度。
1.3 建模大鼠用10%水合氯醛(350 mg/kg)深度麻醉后,动脉结扎组通过丝线结扎右侧颈总动脉8周建立慢性脑低灌注模型[4, 5]。去神经组采用外科手术法去除右侧颈上交感神经节[6],术后观察到大鼠同侧上睑下垂提示建模成功;联合组去除右侧颈上交感神经节并结扎同侧颈总动脉;假手术组不结扎颈总动脉、不去除颈上交感神经节,余操作相同。
1.4 乳胶灌注观察血管形态A组大鼠术后8周麻醉后打开胸腔,剪开右心耳,左心室插管并在150 mmHg的压力下注射5 mL天然乳胶与炭黑(50 μL/mL)的混合物。之后在体视学显微镜下拍照并测量软脑膜吻合支和大脑Willis动脉环的直径。软脑膜吻合支的直径取大脑前动脉(anterior cerebral artery,ACA)和大脑中动脉(middle cerebral artery,MCA)的结合处最细的一点测量,每个半球取8个点,取均值作为软脑膜的直径[7]。Willis动脉环直径取右侧大脑前动脉的嗅动脉分叉处测量[8]。
1.5 激光多普勒测量皮层脑血流量B组大鼠于头部右侧距离前囱3.5 mm的MCA血供区作一个切口,暴露颅骨,将激光多普勒探头置于颅骨上,记录右侧MCA血供区脑血流量(cerebral blood flow,CBF)作为基线值[9]。8周后各组进行pMCAO实验后再次在相同位置记录CBF,并计算pMCAO后CBF与基线值的比值。
1.6 pMCAO后神经行为学评分和TTC染色 1.6.1 pMCAOB组在测量CBF基线值后,通过血管内线栓法阻塞MCA[10]。将尼龙线栓置入颈总动脉内,经颈内动脉送入颅内约18 mm。
1.6.2 神经行为学评分于术后24 h评分,参考Zea Longa的评分标准(0分:无神经损伤症状;1分:不能完全伸展对侧前爪;2分:向对侧转圈;3分:向对侧倾倒;4 分:不能自发行走,意识丧失;5 分:死亡)。
1.6.3 TTC染色在pMCAO模型建成后24 h断头取脑,自前向后切成5片,片厚约2 mm。并放入2%的TTC中,37 ℃恒温孵育约30 min。放入4%多聚甲醛溶液中24 h,拍照后用Image-Pro Plus 6.0软件测量脑梗死面积,根据脑切片梗死面积及切片间距离计算脑梗死体积,并计算脑梗死体积所占百分率。
1.7 免疫组化染色观察软脑膜吻合支管壁厚度C组大鼠术后8周用生理盐水及4%的多聚甲醛灌注固定。取右侧大脑距中线1.5~3.5 mm的脑组织来观察右侧软脑膜吻合支管壁厚度,经脱水、透明、石蜡包埋后切片,片厚约4 μm。脱蜡、水化切片,3% H2O2孵育10 min,PBS冲洗3次,每次2 min;滴加一抗anti-α smooth muscle Actin antibody(抗平滑肌α-actin抗体,1 ∶400),4 ℃冰箱过夜,PBS冲洗3次,每次2 min,应用试剂盒并使用DAB显色,二甲苯透明后烤干、封片。拍照并测量软脑膜吻合支管壁厚度。
1.8 统计学分析采用Sigma Plot 12.5统计软件,计量资料以x±s表示,均数间比较采用单因素方差分析,组间的均数两两比较用LSD法。
2 结果 2.1 软脑膜吻合支和Willis动脉环结构的变化乳胶灌注结果显示:联合组软脑膜吻合支直径明显小于动脉结扎组,大于去神经组和假手术组(F=22.4,P<0.05),去神经组小于假手术组(P<0.05)。Willis动脉环直径明显小于动脉结扎组,大于去神经组和假手术组(F=414.9,P<0.05),去神经组小于假手术组(P<0.05,表 1,图 1)。
| 组别 | 软脑膜吻 合支直径 |
Wills动脉 环直径 |
软脑膜吻 合支厚度 |
| 联合组 | 40.1±5.9 | 322.0±23.0 | 6.9±0.3 |
| 动脉结扎组 | 47.4±6.0ac | 504.3±11.1ac | 8.0±0.5ac |
| 去神经组 | 27.8±2.3abc | 223.4±10.5abc | 2.8±0.4abc |
| 假手术组 | 33.7±3.6a | 245.3±18.3a | 4.2±0.6a |
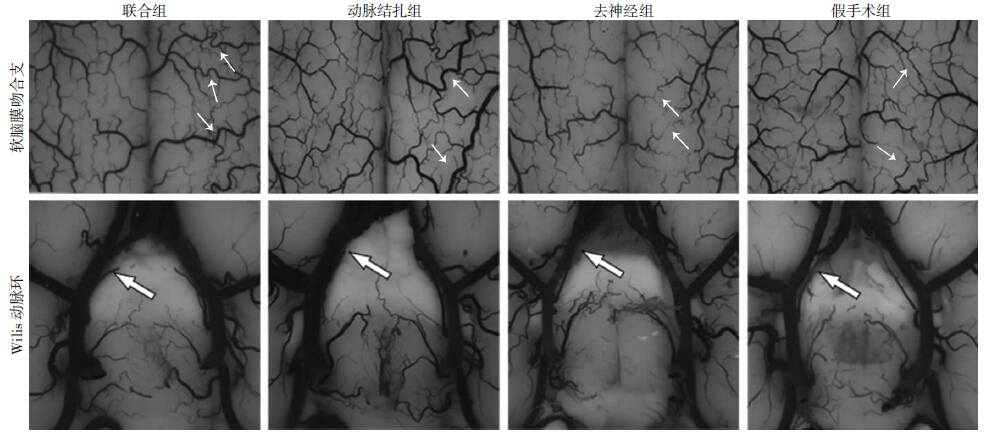 |
| ↑:示软脑膜吻合支; ⇑:示Willis动脉环 图 1 体视学显微镜观察各组大鼠软脑膜吻合支和Willis动脉环直径变化 (×10) |
免疫组织化学染色结果显示:联合组软脑膜吻合支管壁厚度明显小于动脉结扎组,大于去神经组和假手术组(F=201.7,P<0.05),去神经组小于动脉结扎组(P<0.05,表 1,图 2)。
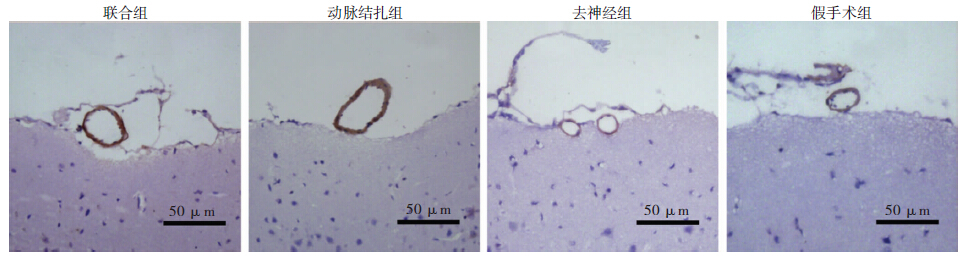 |
| A:联合组;B:动脉结扎组;C:去神经组;D:假手术组 图 2免疫组化染色观察各组大鼠软脑膜吻合支厚度变化 (S-P) |
8周后行pMCAO实验,联合组MCA区的CBF值与基线值的比值明显小于动脉结扎组,大于去神经组与假手术组(F=36.3,P<0.05),去神经组低于假手术组(P<0.05,表 2)。
| 组别 | 比值 |
| 联合组 | 27.6±4.3 |
| 动脉结扎组 | 35.7±4.5ac |
| 去神经组 | 16.3±3.4abc |
| 假手术组 | 20.7±2.4a |
8周后行pMCAO实验,神经行为学评分结果显示联合组评分明显高于动脉结扎组,低于去神经组和假手术组(F=20.0,P<0.05),去神经组大于假手术组(P<0.05)。行TTC染色后观察,脑梗死部分呈现白色,未损伤的脑组织呈现红色。结果显示联合组梗死体积百分率大于动脉结扎组,小于去神经组和假手术组(F=33.9,P<0.05),去神经组大于假手术组(P<0.05,表 3,图 3)。
| 组别 | 神经行为学评分 | 梗死体积百分率(%) |
| 联合组 | 1.7±0.5 | 32.0±6.7 |
| 动脉结扎组 | 0.7±0.7ac | 18.1±4.2ac |
| 去神经组 | 3.3±0.5abc | 50.4±7.6abc |
| 假手术组 | 2.4±0.8a | 42.6±6.3a |
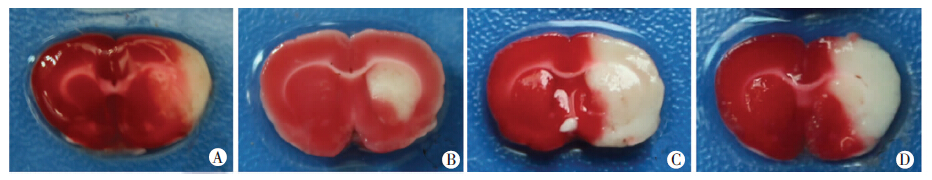 |
| A:联合组;B:动脉结扎组;C:去神经组;D:假手术组 图 3 各组大鼠pMCAO后脑梗死体积大体观察 |
近年来慢性脑低灌注的危害日益受重视,而动脉生成作为一种新的治疗手段备受关注。动脉生成是指由于动脉阻塞,血流再分配使侧支动脉血流量增加,从而引起血管重塑形成有功能的大的侧支动脉的过程[11]。在脑主要的供血动脉阻塞后,软脑膜吻合支是恢复脑血流最重要的侧支路径[8]。结扎一侧颈总动脉后,血液通过软脑膜吻合支和Willis动脉环进行再分配,ACA区血流量大于MCA区,两者之间形成了一个压力梯度[9],从而增大了血流剪切力,而血流剪切力的改变是目前脑动脉生成公认的启动因素[12]。本实验数据显示动脉结扎组软脑膜吻合支管径和管壁厚度较假手术组明显增加,提示CCAO后剪切力的增加诱发了动脉生成。同时,pMCAO术后动脉结扎组较假手术组皮质血流量大表明脑血管储备能力(cerebrovascular reserve capacity,CVRC)提高,CVRC的恢复依赖于侧支血管的生长[13]。因此,CVRC的提高从侧面反映了软脑膜吻合支与Willis动脉环管径增加。动脉结扎组较假手术组梗死体积小及神经行为学评分低可能与软脑膜吻合支和Willis动脉环的管径增加有关。血管管径和管壁厚度增加表明慢性脑低灌注诱发了脑动脉生成,CVRC的提高和梗死体积的减小都表现出脑动脉生成应用于此类疾病临床治疗的潜力。
尽管如此,临床上尚未发现能良好控制剪切力的方法,试图通过改变血管剪切力促进缺血区动脉生成无疑是不切实际的。而人和动物的脑血管上有丰富的交感神经支配,交感神经纤维与平滑肌之间有典型的“神经肌接头”特征,这表明在结构上交感神经与脑血管之间存在密切联系。本实验数据显示:与对照组相比,联合组软脑膜吻合支和Willis动脉环管径较动脉结扎组增加的程度小,管壁增厚的程度小,提示去交感神经支配后脑动脉生成的某个环节受损。联合组血流量增加和梗死体积减小的幅度都小于动脉结扎组,也从侧面表明去交感神经支配后脑血管的管径增加程度减小。而血管的管径和厚度与动脉生成过程中平滑肌细胞的增殖密切相关,后者是小动脉成熟为有功能的侧枝动脉的重要环节。已有研究表明交感神经对平滑肌细胞有营养作用,其作用的发挥可能与其递质去甲肾上腺素和神经肽Y相关[14]。研究表明去甲肾上腺素α1受体拮抗剂(酚妥拉明或哌唑嗪)可抑制大鼠SMC的增殖[15]。此外,神经肽Y在大脑的交感神经中表达丰富,除可促进内皮细胞粘附、迁移和增殖外,还可促进SMC增殖[16]。因此我们推测交感神经也许影响了动脉生成过程中平滑肌细胞的增殖,其机制可能与其递质密切相关,这为我们探索如何调控脑动脉生成及后期临床应用提供了新的思路。
综上所述,本研究证明了慢性脑低灌注可以诱发脑动脉生成,而失交感神经支配会损害脑动脉生成,其具体的分子机制有待于进一步探索。
| [1] | Ohtaki H, Fujimoto T, Sato T, et al. Progressive expression of vascular endothelial growth factor (VEGF) and angiogenesis after chronic ischemic hypoperfusion in rat[J]. Acta Neurochir Suppl, 2006, 96: 283-287. |
| [2] | Troidl K, Schaper W. Arteriogenesis versus angiogenesis in peripheral artery disease[J]. Diabetes Metab Res Rev, 2012, 28 Suppl 1: 27-29. |
| [3] | Luo M Y, Yang B L, Ye F, et al. Collateral vessel growth induced by femoral artery ligature is impaired by denervation[J]. Mol Cell Biochem, 2011, 354(1/2): 219-229. |
| [4] | Omura-Matsuoka E, Yagita Y, Sasaki T, et al. Hypertension impairs leptomeningeal collateral growth after common carotid artery occlusion: restoration by antihypertensive treatment[J]. J Neurosci Res, 2011, 89(1): 108-116. |
| [5] | Duelsner A, Gatzke N, Persson A B, et al. Induction of cerebral arteriogenesis in mice[J]. Methods Mol Biol, 2014, 1135: 121-125. |
| [6] | Savastano L E, Castro A E, Fitt M R, et al. A standardized surgical technique for rat superior cervical ganglionectomy[J]. J Neurosci Methods, 2010, 192(1): 22-33. |
| [7] | Li W, Prakash R, Kelly-Cobbs A I, et al. Adaptive cerebral neovascularization in a model of type 2 diabetes: relevance to focal cerebral ischemia[J]. Diabetes, 2010, 59(1): 228-235. |
| [8] | Sugiyama Y, Yagita Y, Oyama N, et al. Granulocyte colony- stimulating factor enhances arteriogenesis and ameliorates cerebral damage in a mouse model of ischemic stroke[J]. Stroke, 2011, 42(3): 770-775. |
| [9] | Todo K, Kitagawa K, Sasaki T, et al. Granulocyte-macrophage colony-stimulating factor enhances leptomeningeal collateral growth induced by common carotid artery occlusion[J]. Stroke, 2008, 39(6): 1875-1882. |
| [10] | 何敏, 韩江全, 李向荣. 改良法制作SD大鼠大脑中动脉栓塞永久模型[J]. 当代医学, 2008(18): 1-3. |
| [11] | Buschmann I, Schaper W. Arteriogenesis Versus Angiogenesis: Two Mechanisms of Vessel Growth[J]. News Physiol Sci, 1999, 14: 121-125. |
| [12] | Rolland P H, Bruzzese L. Manipulating arterial fluid-shear stress and arteriogenesis in the brain[J]. Eur J Vasc Endovasc Surg, 2011, 41(5): 597-598. |
| [13] | Duelsner A, Gatzke N, Glaser J, et al. Granulocyte colony-stimulating factor improves cerebrovascular reserve capacity by enhancing collateral growth in the circle of Willis[J]. Cerebrovasc Dis, 2012, 33(5): 419- 429. |
| [14] | Ruohonen S T, Abe K, Kero M, et al. Sympathetic nervous system-targeted neuropeptide Y overexpression in mice enhances neointimal formation in response to vascular injury[J]. Peptides, 2009, 30(4): 715-720. |
| [15] | Sherline P, Mascardo R. Catecholamines are mitogenic in 3T3 and bovine aortic endothelial cells[J]. J Clin Invest, 1984, 74(2): 483-487. |
| [16] | Hao L, Zou Z, Tian H, et al. Novel roles of perivascular nerves on neovascularization[J]. Neurol Sci, 2015, 36(3): 353-360. |



