肠黏膜屏障在维持肠道的完整性和机体稳态中发挥重要作用。多种病理过程如严重创伤、烧伤、败血症、失血性休克和慢性炎症疾病等,都能引起肠屏障破坏,导致肠道细菌移位入血,加重肠道损伤。同时肠道菌群破坏肠壁组织,并释放LPS向肠道周围组织和血液移位,进一步损伤紧密连接蛋白,LPS促进肠道细胞释放大量的炎性因子,加重肠黏膜屏障损伤,引起体内稳态失衡[1]。
甘露糖结合凝集素(mannose binding lectin,MBL)是一种模式识别分子,在固有免疫防御及维持机体稳态中起重要作用。它主要由肝脏产生,释放入血液循环后,其可以直接识别并结合病原微生物发挥调理素作用,同时也可以通过凝集素途径激活补体形成膜攻击复合物,清除病原微生物,维持机体的稳态[2, 3]。近来研究发现在肠上皮细胞有MBL特异性表达[2]。但对于MBL肠道特异性表达发挥的作用及机制并不清楚。有研究发现MBL基因缺陷小鼠在烧伤和细菌接种模型中,发展成脓毒血症的比例更高并有更高的死亡率[3]。在DSS诱导的急性结肠炎中,MBL/c1q基因缺陷小鼠的内毒素水平较野生小鼠明显增高,屏障通透性也增加,屏障功能受到破坏[4]。这些研究提示,MBL可能直接参与了肠屏障功能的调控。本实验拟通过shRNA质粒干扰MBL的表达,观察肠上皮细胞紧密连接蛋白的表达,探讨MBL对肠屏障功能的影响,为探讨其作用分子机制的研究奠定基础。
1 材料与方法 1.1 材料与试剂人结肠癌上皮Caco-2细胞株购自中国科学院细胞库,常规细胞培养箱购自日本Sanyo公司,胎牛血清MEM培养基购自美国 HyClone公司,胰蛋白酶购自美国BBI公司,Bax、Bcl-2抗体、聚偏二氟乙烯(PDVF)膜购自美国Millipore公司,垂直电泳仪和湿转电转仪购自美国Bio-Rad公司,RIPA裂解液、蛋白测定试剂盒和SDS-PAGE凝胶配置试剂盒均购自武汉博士德生物工程公司,凝胶成像分析系统购自美国KODAK公司,质粒序列来源于Sigma公司。
1.2 实验动物及分组14只6~8周龄雄性C57小鼠,体质量(21±2)g。按随机数字表法分为2组(n=7):假手术组、LPS组。处理前12 h禁食,自由饮水。LPS组经腹腔注射LPS溶液10 mg/kg[5];假手术组给予同等体积的0.9%氯化钠注射液。观察6 h后腹腔注射0.15 mL 0.1%的戊巴比妥钠麻醉后,腹正中线切开,暴露肠段并取其小肠组织。
1.3 实验方法 1.3.1 细胞培养Caco-2细胞用含10%胎牛血清、1%双抗、1%非必需氨基酸的MEM培养基中置于37 ℃、5% CO2饱和湿度的条件下培养,直至细胞融合80%,用0.2%含EDTA胰酶消化,Hanks液吹均匀后,将Caco-2细胞以1.0×106/孔接种至6孔板中并分对照组和LPS处理组,向LPS组中加入100 μg/mL的LPS处理Caco-2细胞,24 h后提取蛋白[6]。
1.3.2 细胞转染质粒Caco-2细胞以1.0×106接种于6孔板中,培养24 h后,分为3组:对照组、空转染组和MBL shRNA组,用Lipfectamine 2000进行质粒瞬转。
1.3.3 Western blot检测MBL、Occludin、Claudin-1蛋白表达水平提取不同处理过后的蛋白样,用蛋白测定试剂盒测定上清液蛋白水平。蛋白上样,恒压电泳,恒流湿转至PVDF膜(用甲醇浸泡),转膜后,用5% TBST脱脂奶粉室温封闭2 h,加入一抗4 ℃冰箱过夜。TBST洗膜,然后加入对应二抗,37 ℃温箱孵育1 h,TBST洗膜。加入ECL发光试剂显影,采集发光信号,经Kodak Molecular Imaging 软件行密度分析,实验重复3次。
1.3.4 免疫组化染色石蜡切片脱蜡,二甲苯、乙醇各浸泡10 min,PBS冲洗3次,阻断内源性过氧化物酶的活性,枸盐酸缓冲液,一抗室温下孵育2 h。DAB液显色,苏木精复染,自来水冲洗、蓝化,中性树胶封固,晾干后观察,实验重复3次以上。
1.3.5 实时荧光定量PCR分析MBL mRNA水平变化用TRIzol(Invitrogen)按试剂盒说明提取细胞总RNA,用逆转录试剂盒将RNA逆转录为cDNA。以合成的cDNA第1链为模板进行扩增(按SYBR Green试剂盒说明进行)。△Ct=Ct目的基因-Ctβ-actin,△△Ct= △Ct处理组-△Ct对照组。不同样本的目的基因表达的相对差异量=2-△△Ct,引物序列见表 1,实验重复3次以上。
| 引物名称 | 引物序列 | 产物长度 (bp) |
| mouseMBL | 上游:5′-GGACAGAGCAGAATTTGATACTAGCG-3′ 下游:5′-ACTCAGAGAGAAGAGCACCCAGTTTC-3′ | 100 |
| HumanMBL | 上游:5′-CCCTGTTTCCATCACTCCCTC-3′ 下游:5′ -GTGCCATCACGCCCATCTT -3′ | 160 |
| Occludin | 上游:5′-AGCAGCGGTGGTAACTTTGAGA-3′ 下游:5′-ACTCGCCGCCAGTTGTGTAG-3′ | 118 |
| Claudin-1 | 上游:5′-GGTACGAATTTGGTCAGGCTCTC-3′ 下游:5′-CTTGGTGTTGGGTAAGAGGTTGTT-3′ | 118 |
| β-actin | 上游:5′-CCACGAAACTACCTTCAACTCC-3′ 下游:5′-GTGATCTCCTTCTGCATCCTGT-3′ | 147 |
取出两组小肠组织,沿系膜细膜方向剖开肠管,轻轻冲洗肠管,在显微操作镜下剥离肠黏膜,并将其安装在调试好的尤斯灌流仪器上,测取电流值。实验重复3次[7]。
1.3.7 肠上皮细胞跨上皮电阻(transepithelial electrical resistance,TER)测定接种细胞后的Transwell小室,用MillicellERS-2电阻测定仪测定TER,待TER数值稳定后,用质粒瞬转48 h构建MBL基因干扰模型,分别检测处理前后的TER值。测得 TER值需减去空白对照(Transwell小室内未接种细胞)后记录为每组电阻值,结果以处理后的TER值占处理前的百分比表示。每组做1复孔,实验重复3次[8]。
1.4 统计学方法数据以x±s表示,采用SPSS 13.0统计软件进行单因素方差分析。
2 结果 2.1 小肠黏膜TER值变化和组织形态学改变腹腔注射LPS后,取下小肠黏膜安装到Ussing chambers上,待仪器运作平稳后开始记录仪器的电阻 值,假手术组与LPS处理组TER结果分别为(140.45± 4.78)、(80.32±5.43)。LPS处理后,小肠TER值较假手术组明显降低(P<0.01)。HE染色也显示假手术组肠绒毛形态完整性较好,LPS组肠绒毛完整性较差,部分出现绒毛断裂(图 1)。
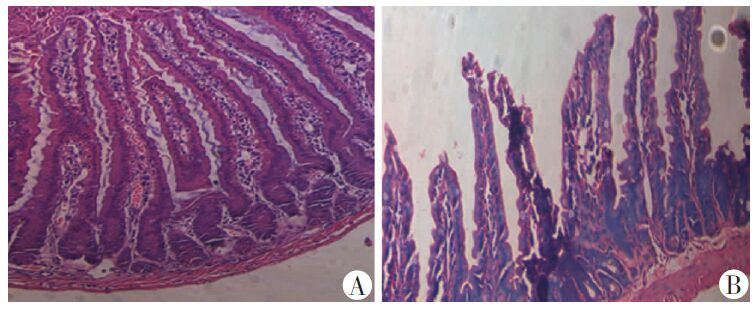
|
| A:假手术组;B:LPS组 图 1 两组小鼠小肠组织形态学观察 (HE ×200) |
假手术组中肠绒毛表达少量MBL,LPS组中肠上皮和隐窝上皮表达MBL明显增高(图 2)。Real-time PCR结果显示LPS处理组MBL的mRNA相对表达量(12.67±4.85)比假手术组明显升高(P<0.01)。
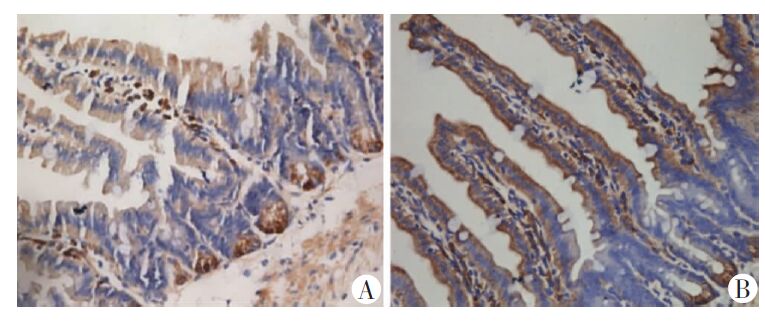
|
| A:假手术组;B:LPS组 图 2 两组免疫组化小鼠小肠组织MBL表达情况 (SABC ×200) |
在体外,100 μg/mL的LPS处理Caco-2细胞24 h后,Real-Time PCR检测结果显示,LPS组MBL的mRNA相对表达量(2.24±0.67)比对照组高(P<0.05)。Western blot结果显示,LPS组MBL蛋白相对表达量(2.46±0.89)显著高于对照组(P<0.05,图 3)。

|
| 1:对照组;2:LPS组 图 3 Western blot检测两组单层肠上皮细胞MBL的蛋白表达 |
应用MBL-shRNA质粒瞬时转染Caco-2细胞48 h后,Western blot(图 4)和Real-Time PCR法测量MBL表达,结果显示,MBL shRNA组蛋白水平(0.34±0.09)和mRNA水平(0.42±0.12)均较空转染组明显降低,差异有统计学意义(P<0.05)。

|
| 1:空转染组;2:MBL shRNA组 图 4 Western blot检查两组单层上皮细胞MBL的蛋白表达 |
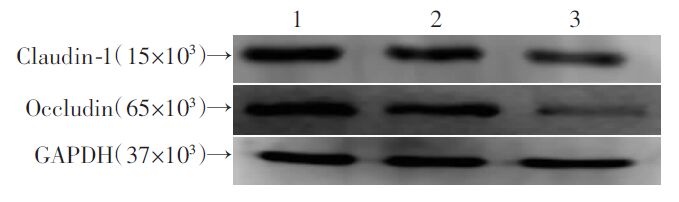
|
| 1:对照组;2:空转染组;3:MBL shRNA组 图 5Western blot 检测紧密连接蛋白Claudin-1和Occludin的蛋白表达 |
| 组别 | 蛋白表达水平 | mRNA相对表达水平 | ||
| Occludin | Claudin-1 | Occludin | Claudin-1 | |
| 对照组 | 0.88±0.14 | 0.88±0.08 | 1 | 1 |
| 空转染组 | 0.94±0.22 | 0.88±0.07 | 0. 84±0.11 | 0.90±0.08 |
| MBL shRNA组 | 0.43±0.10a | 0.53±0.11a | 0.43±0.08a | 0.45±0.10a |
| F值 | 8.719 | 16.539 | 36.38 | 47.08 |
| P值 | 0.017 | 0.004 | <0.001 | <0.001 |
| a:P<0.05,与对照组及空转染组比较 | ||||
对照组、空转染组和MBL shRNA组的TER分别为(133.67±9.07)、(120.67±6.66)、(80.33±7.64),MBL shRNA组明显低于其余2组,差异有统计学意义(P<0.05)。
3 讨论肠黏膜屏障是由生物屏障、免疫屏障和机械屏障组成,肠上皮构成的机械屏障是重要屏障之一。单层肠上皮细胞之间由紧密连接蛋白连接,可以防止病原微生物、抗原和毒素入血。然而在许多病理情况下,如严重感染、休克、急慢性炎症疾病等,可造成肠上皮细胞凋亡脱落,导致屏障功能衰竭。肠道炎症损伤,诱导肠上皮细胞损伤及凋亡,加重了屏障功能衰竭[1, 9]。
众所周知,MBL在机体固有免疫防御中起到重要作用——通过凝集素途径活化激活补体,同时还起到调理素的作用。MBL主要由肝脏产生和分泌,分为血清MBL(分泌进入血液循环)和胞内MBL,同时MBL在肺、睾丸、肾、胸腺和小肠内也有表达,被认为起到相应的免疫防御功能[2, 3, 4]。文献[4]研究显示MBL/C1q基因缺陷型小鼠在DSS诱导急性结肠炎模型中,肠屏障功能受损更严重,血清内毒素水平较高。近年来在肠道围绕MBL的补体功能研究报道较多,而对MBL自身与肠上皮细胞之间关系尚少见报道。为了深入研究MBL对肠屏障功能的影响,我们构建了MBL干扰质粒,观察肠上皮细胞屏障功能的变化。
本实验发现,在LPS刺激下,肠上皮细胞高表达MBL。为了排除体内复杂的免疫反应干扰,我们选用Caco-2细胞作为研究肠上皮屏障功能的模型。我们成功转染MBL shRNA后,发现MBL表达下调,上皮细胞间紧密连接蛋白mRNA及蛋白表达均明显受到抑制。TER检测显示MBL shRNA组屏障通透性增加,肠道屏障功能损伤程度更大。表明MBL可能参与调控紧密连接蛋白的表达,改善肠黏膜的通透性,从而起到保护肠道屏障的作用。但是MBL如何发挥功能尚不清楚。目前研究报道内肽酶meprin可以裂解紧密连接蛋白,增加屏障的通透性,从而破坏肠黏膜屏障[10]。而MBL可以直接与内肽酶meprin结合,作为内肽酶的天然抑制剂,起到减少蛋白质水解和基质降解[11]。本实验发现干扰MBL基因表达后,紧密连接蛋白的表达下调。因此,我们考虑MBL可能是通过抑制内肽酶功能,从而保护肠黏膜屏障。Nonaka等[12]研究发现,胞内MBL可能作为蛋白从内质网到高尔基体的转运载体,控制蛋白分子的形成。Wang等[13]报道,通过筛查MAPK信号途径,发现MBL可以通过活化P38使其磷酸化增加,调控细胞的增殖及凋亡。上述通路均可以以不同形式发挥调节紧密连接蛋白表达,影响屏障功能,但MBL调节紧密连接蛋白表达的具体机制尚需进一步研究。
综上所述,干扰MBL基因后紧密连接蛋白表达下调,屏障功能受损,考虑MBL可能通过调节紧密连接蛋白的表达,参与保护肠屏障功能的作用。该研究为MBL基因缺陷的患者在急性炎症时期肠道保护提供了可能的靶点及理论依据。
| [1] | Lei Q, Qiang F, Chao D, et al. Amelioration of hypoxia and LPS-induced intestinal epithelial barrier dysfunction by emodin through the suppression of the NF-κB and HIF-1α signaling pathways[J]. Int J Mol Med, 2014, 34(6): 1629-1639. |
| [2] | Ip W K, Takahashi K, Ezekowitz R A, et al. Mannose-binding lectin and innate immunity[J]. Immunol Rev, 2009, 230(1): 9-21. |
| [3] | Takahashi K. Mannose-binding lectin and the balance between immune protection and complication [J]. Expert Rev Anti Infect Ther, 2011, 9(12): 1179-1790. |
| [4] | Schepp-Berglind J, Atkinson C, Elvington M, et al. Complement-dependent injury and protection in a murine model of acute dextran sulfate sodium-induced colitis[J]. J Immunol, 2012, 188(12): 6309-6318. |
| [5] | Cai Y, Wang W, Liang H, et al. Keratinocyte growth factor improves epithelial structure and function in a mouse model of intestinal ischemia/reperfusion[J]. PLoS One, 2012, 7(9): e44772. |
| [6] | Xiao W D, Chen W, Sun L H, et al. The protective effect of enteric glial cells on intestinal epithelial barrier function is enhanced by inhibiting inducible nitric oxide synthase activity under lipopolysaccharide stimulation[J]. Mol Cell Neurosci, 2011, 46(2): 527-534. |
| [7] | Williams J M, Duckworth C A, Watson A J, et al. A mouse model of pathological small intestinal epithelial cell apoptosis and shedding induced by systemic administration of lipopolysaccharide[J]. Dis Model Mech, 2013, 6(6): 1388-1399. |
| [8] | 曹敏, 黄家君. 小檗碱减轻炎症反应时肠上皮屏障功能损 害的实验研究[J].第三军医大学学报, 2013, 35(5): 447-450. |
| [9] | 张晔, 徐竞, 刘建仓, 等. 血管扩张刺激磷蛋白调节失血性休克大鼠小肠屏障功能与闭锁连接蛋白1的关系[J].第三军医大学学报, 2008, 30(14): 1364-1366. |
| [10] | Bao J, Yura R E, Matters G L, et al. Meprin A impairs epithelial barrier function, enhances monocyte migration, and cleaves the tight junction protein occludin[J]. Am J Physiol Renal Physiol, 2013, 305(5): F714-F726. |
| [11] | Hirano M, Ma B Y, Kawasaki N, et al. Mannan-binding protein blocks the activation of metalloproteases meprin alpha and beta[J]. J Immunol, 2005, 175(5): 3177-3185. |
| [12] | Nonaka M, Ma B Y, Ohtani M, et al. Subcellular localization and physiological significance of intracellular mannan- binding protein[J]. J Biol Chem, 2007, 282(24): 17908-17920. |
| [13] | Wang Y, Chen A D, Lei Y M, et al. Mannose-binding lectin inhibits monocyte proliferation through transforming growth factor-beta1 and p38 signaling pathways[J]. PLoS One, 2013, 8(9): e72505. |



