铜作为抗菌材料在公元前2600年古埃及人所著的Edwin Smith纸草文稿中就有记载,并应用于饮水消毒及创面治疗[1]。即使到抗生素不断推陈出新的今天,各种铜配合物[2]或含Cu2+的织物[3, 4, 5]仍以抗菌谱广、耐药菌株少、毒性相对较小等诸多优势在抗菌、抗病毒、抗寄生虫等领域得到广泛应用[5]。此外,铜作为人体重要的必需微量元素,是铜蓝蛋白、细胞色素氧化酶、超氧化物歧化酶等众多酶系的辅基,参与了包括铁代谢、能量代谢、氧化还原等关键生理过程[6]。Hu[7]、罗堃等[8]及张金超等[9]先后报道了在微摩尔浓度水平Cu2+对人血管内皮细胞及小鼠成骨细胞的促增殖作用,然而对其机制的探索却鲜有涉及。与此同时,也存在大量关于高浓度Cu2+细胞毒性的报道[10, 11, 12, 13],研究者普遍认为过度刺激细胞内活性氧(reactive oxygen species,ROS)产生是Cu2+杀菌及细胞毒性效应的关键环节之一,由此引发蛋白变性、脂质过氧化、DNA及RNA损伤等一系列反应[13, 14]。众所周知,ROS不仅参与细胞的凋亡、坏死,还可作为重要的信号分子,参与细胞的信号转导,激活转录因子,影响基因的表达,从而促进细胞的增殖和分化[15]。因此,我们假设Cu2+与ROS在剂量-效应关系的双向性上是相互契合的。本研究拟观察不同浓度Cu2+对HaCaT细胞增殖和胞内ROS产生的影响,并进一步采用活性氧清除剂N-乙酰半胱氨酸(NAC)初步探索微摩尔浓度Cu2+促人角质形成细胞增殖的机制。
1 材料与方法 1.1 细胞培养本实验室保存的HaCaT细胞使用含10%灭活胎牛血清(SV30087.01,HyClone公司)、100 U/mL青霉素,100 μg/mL链霉素(SV30010,HyClone公司)的 DMEM培养基(SH30262.01,HyClone公司),置于37 ℃ 5% CO2细胞培养箱进行培养。在细胞融合至70%~80%时,用含0.02 mol/L EDTA的0.25%胰酶消化约5 min,加入少量上述培养基终止。经反复轻柔吹制成细胞悬液,1 000 r/min(200×g,r=14.5 cm)离心5 min,弃上清后加入适量培养基。采用血球计数板2次计数取均值后稀释为2.5×104/mL或5×104/mL的细胞悬液,接种不同规格的细胞培养平板分别用于后续实验。
1.2 CCK-8法检测细胞增殖HaCaT细胞按5 000个/孔(200 μL)接种于96孔板,每种Cu2+浓度实验组设3个重复孔,孵育5 h贴壁后,更换Cu2+[Cu(NO3)2·3H2O,AR/500 g,天津大茂]终浓度为0(阴性对照组)、10-8、10-7、10-6、10-5、10-4、10-3 mol/L的培养基。然后每24小时更换培养基1次,48 h后将CCK-8(CK04,Dojindo)与培养基按1 ∶10混合后加入96孔板,其中每孔110 μL(10 μL CCK-8+100 μL 培养基),37 ℃再孵育4 h,无细胞的培养基中加入CCK-8作为空白对照。用多功能酶标 仪(Varioskan flash,Thermo Scientific)检测波长450 nm 处的光密度值[D(450)]。细胞的相对增殖活性按如下公式计算。
相对细胞增殖百分率=[D(450)exp-D(450)blk]÷ [D(450)ctr-D(450)blk]×100%
其中,D(450)exp:各实验处理组(细胞+含Cu2+培养基),D(450)ctr:阴性对照组(细胞+无Cu2+培养基),D(450)blk:空白对照组(无Cu2+培养基)。
在活性氧清除剂的处理实验中,分别加入5 mmol/L N-乙酰半胱氨酸(NAC,S0077,Beyotime)单独或与10-6、10-5、10-4 mol/L Cu2+共培养48 h后按上述方法加入CCK-8进行检测,阴性对照和空白对照设置同前。细胞的相对增殖活性按上述公式计算。
1.3 DCFH-DA检测细胞内活性氧浓度HaCaT细胞按1×104/孔(200 μL)接种于96孔板,每种Cu2+浓度实验组设3个重复孔,培养24 h后,每孔加入含10 μmol/L DCFH-DA(S0033-1,Beyotime)的无血清DMEM培养基50 μL,并在37 ℃避光孵育60 min。然后弃除上清液,用PBS反复清洗3次。按实验设计各组分别加入Cu2+(终浓度分别为0、10-8、10-7、10-6、10-5、10-4、10-3 mol/L),活性氧阳性对照ROSup(S0033-2,Beyotime,终浓度50 μg/mL)处理HaCaT细胞。无细胞的培养基中加入DCFH-DA作为空白对照。分别在Cu2+加入后30、60 min用多功能酶标仪检测激发 波长488 nm、发射波长525 nm处的荧光强度值(F)。细胞相对荧光强度按如下公式计算。
相对荧光强度= [(Fexp-Fblk)÷(Fctr-Fblk)]×100%
其中,Fexp:各实验处理组(细胞+含Cu2+培养基),Fctr:阴性对照组(细胞+无Cu2+培养基),Fblk:空白对照组(无Cu2+培养基)。
在活性氧清除剂的处理实验中,DCFH-DA负荷方法同各Cu2+组,PBS反复清洗之后,加入5 mmol/L NAC单独或与Cu2+(终浓度为0、10-6、10-5、10-4 mol/L)共同处理HaCaT细胞,阴性对照、阳性对照和空白对照设置同前。分别在处理后30、60 min用多功能酶标仪检测激发波长488 nm、发射波长525 nm处的荧光强度值(F),并按上述公式计算细胞相对荧光强度。
1.4 细胞内活性氧与线粒体的共聚焦显微镜观测HaCaT细胞按1×104/孔(200 μL)接种于装有2 mL 培养基的15 mm共聚焦专用细胞培养皿(801002,NEST),培养24 h后,每孔加入含10 μmol/L DCFH-DA和500 nmol/L线粒体探针Mito Tracker Red CMXRos(M7512,Molecular Probes)的无血清DMEM培养基500 μL,并在37 ℃避光孵育60 min。PBS反复清洗之后,加入终浓度为5 mmol/L NAC单独或与Cu2+(终浓度为0、10-6、10-5 mol/L)共同处理HaCaT细胞60 min,激光共聚焦显微镜(LSM780,Carl Zeiss)采集激发波长488 nm处的绿色荧光(ROS)和激发波长579 nm处的红色荧光(线粒体)照片。设终浓度50 μg/mL ROSup处理组为阳性对照。
1.5 统计学处理计量数据用x±s表示,采用PASW Statistics 18.0.0统计软件,进行t检验或Pearson相关分析。
2 结果 2.1 微摩尔浓度Cu2+促进HaCaT细胞的增殖不同浓度的Cu2+对HaCaT细胞增殖的影响是完全不同的(图 1)。阴性对照组在48 h时D(450)值达到(2.908±0.450),与之相比,10-8、10-7 mol/L两组HaCaT细胞相对增殖率为101.09%、101.86%,并无明显变化(P>0.05);而10-6、10-5 mol/L组的相对增殖率分别达到了116.19%(P=0.027)、113.37%(P=0.036),均表现出明显的促增殖效应,但两组之间差异无统计学意义(P=0.684)。然而,当浓度上升至10-4 mol/L时,Cu2+即表现出明显的细胞增殖毒性,相对增殖率下降至12.20%(P=0.001);进一步上升至10-3 mol/L时,细胞在短时间内几乎完全死亡,D(450)值仅为(0.05±0.21),差异有统计学意义(P<0.01),基本接近于空白值。
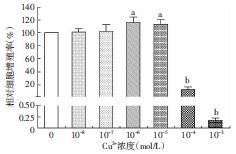
|
| a:P<0.05,b:P<0.01,与阴性对照组(Cu2+ 0 mol/L)比较 图 1 不同浓度Cu2+对HaCaT细胞增殖的影响 |
细胞内DCFH-DA的荧光强度间接反映了细胞产生ROS的浓度。与阴性对照组比较,加入ROSup 50 μg/mL 后在30、60 min时间点上相对荧光强度持续显著升高(P<0.01),表明HaCaT细胞对ROS阳性刺激剂的反应性良好;10-8、10-7 mol/L两组细胞内 ROS浓度仅在60 min时才明显升高至110.99%(P=0.016)及117.34%(P=0.016),而且在变化幅度上弱于10-6、10-5 、10-4 mol/L组。10-6、10-5、10-4 mol/L Cu2+处理细胞30 min后ROS产生分别迅速升高至127.47%(P=0.001)、124.28%(P=0.031)、125.60%(P=0.004),60 min时达到140.47%(P=0.002)、134.29%(P=0.007)、130.66%(P=0.007),不同时相点各组间比较差异均无统计学意义(P>0.05)。10-3 mol/L细胞内相对ROS浓度则明显下降至81.62%~84.96%,在各个时相点上均明显低于10-6、10-5、10-4 mol/L及ROSup组(P<0.01,图 2)。
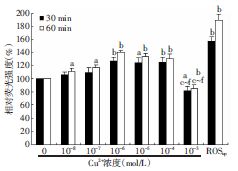
|
| a:P<0.05,b:P<0.01,与阴性对照组(Cu2+ 0 mol/L)比较;c:P<0.01,与Cu2+ 10-6 mol/L组比较;d:P<0.01,与Cu2+ 10-5 mol/L组比较;e:P<0.01,与Cu2+ 10-4 mol/L组比较;f:P<0.01,与阳性对照组(ROSup)比较 图 2 不同浓度Cu2+处理HaCaT细胞后胞内 DCFH-DA的相对荧光强度 |
加入活性氧清除剂NAC探索ROS在Cu2+促HaCaT细胞增殖效应中的作用。单独加入5 mmol/L NAC处理48 h对HaCaT细胞生长无明显影响;10-6、10-5 mol/L Cu2+两组的相对增殖率分别达119.89%和111.71%,显著高于阴性对照组(P=0.021,P=0.031)。与10-6、10-5 mol/L Cu2+两组相比,加入5 mmol/L NAC与10-6、10-5 mol/L Cu2+共同处理 HaCaT细胞后相对增殖率分别降至102.61%(P=0.021)和101.32%(P=0.027),促增殖作用消失,与阴性对照组无统计学差异(P>0.05)。然而,10-4 mol/L Cu2+处理48 h后细胞相对增殖率为18.96%,与5 mmol/L NAC共同作用下也仅为20.53%,均表现出明显的细胞增殖毒性(图 3)。
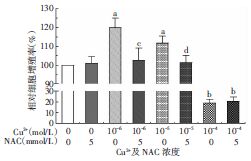
|
| a:P<0.05,b:P<0.01,与阴性对照组(Cu2+ 0 mol/L)比较;c:P<0.05,与Cu2+ 10-6 mol/L组比较;d:P<0.05,与Cu2+ 10-5 mol/L组比较 图 3 NAC对Cu2+促HaCaT细胞增殖效应的影响 |
加入5 mmol/L NAC后与Cu2+共同作用HaCaT细胞,观察其对细胞内ROS产生的影响。相对荧光强度的结果显示(图 4):与阴性对照组比较,单独加入NAC后,细胞内ROS产生在30、60 min时相点上显著降低至82.51%(P=0.002)、76.70%(P=0.011);单独加入10-6、10-5、10-4 mol/L Cu2+后,细胞内ROS迅速升高,在各时相点上的相对荧光强度显著增强(P<0.01)。与单用Cu2+组比较,加入5 mmol/L NAC后的10-6、10-5、10-4 mol/L Cu2+组细胞内ROS水平在各时相点上均显著降低(P<0.05),表明NAC对Cu2+刺激的HaCaT细胞ROS产生有明显的拮抗作用。共聚焦显微镜观察(图 5):在线粒体示踪剂Mito Tracker红色荧光基本一致的情况下,与阴性对照组相比,10-6、10-5 mol/L组DCFH-DA绿色荧光增强,ROSup组的绿色荧光最强,这与反映细胞内ROS产生的相对荧光强度数据表现一致。与单用Cu2+组比较,NAC处理60 min 后的各组HaCaT细胞内DCFH-DA绿色荧光下降明显,而线粒体Mito Tracker红色荧光无明显影响。各组ROS荧光定位均与线粒体定位基本重合,证实了ROS的产生主要来自于线粒体。
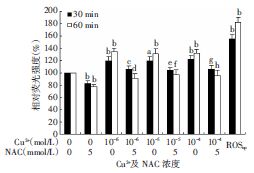
|
| a:P<0.05,b:P<0.01,与阴性对照组(Cu2+ 0 mol/L)比较;c:P<0.05,d:P<0.01,与Cu2+ 10-6 mol/L组比较;e:P<0.05,f:P<0.01,与Cu2+ 10-5 mol/L组比较;g:P<0.05,h:P<0.01,与Cu2+ 10-4 mol/L组比较 图 4 Cu2+及NAC处理HaCaT细胞30、60 min后胞内 DCFH-DA的相对荧光强度 |
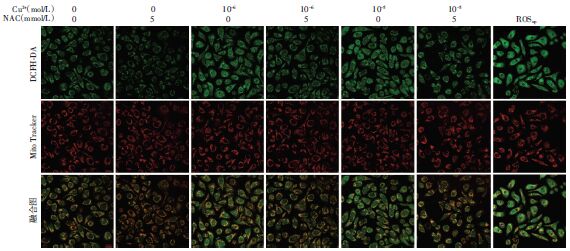
|
| 图 5 Cu2+及NAC处理HaCaT细胞60 min后胞内DCFH-DA的共聚焦显微镜观察 (×400) |
本研究不仅证实高浓度Cu2+细胞毒性,还观察到微摩尔浓度下Cu2+对人角质形成细胞增殖功能的影响,并且通过活性氧清除剂NAC的拮抗作用,明确了微摩尔浓度Cu2+的促人角质形成细胞增殖效应与其诱导ROS产生之间密切关系。
虽然刘志伟等[10]、廖明阳等[11]曾相继报道Cu2+在48 h 对人肠道上皮细胞(Caco-2)及人近端肾小管上皮细胞(HK-2)的IC50分别约为1×10-4 mol/L及5.89×10-4 mol/L,然而罗堃等[8]、张金超等[9]也发现Cu2+在5×10-6 mol/L作用72 h及1×10-6 mol/L作用48 h条件下,可分别使原代小鼠成骨细胞及人脐静脉血管内皮细胞(HUVEC)相对细胞增殖率提高至112%和118%。在用CCK-8检测HaCaT细胞增殖过程中,本研究也发现Cu2+存在剂量-效应关系的双向作用,即Cu2+处理HaCaT细胞48 h后,在细胞毒性浓度水平(≥10-4 mol/L)时,增殖抑制率达到或超过87.80%,而在微摩尔浓度水平时,10-6~10-5 mol/L表现出了13.37%~16.19%的促增殖效应,而10-8~10-7 mol/L则为无作用浓度。这一现象的发现有助于人们全面认识Cu2+在细胞增殖过程中作用,也激起了我们探索其促增殖作用机制的兴趣。
诸多研究证实Cu2+能够改变细胞的氧化还原状态,引起细胞内的ROS升高,且其细胞毒作用与之关系密切[12, 13, 16]。本研究也证实Cu2+对HaCaT细胞内ROS产生有明显的促进作用。所不同的是ROS产生并没有一直随着Cu2+浓度升高而增加。本实验结果显示:在毒性浓度10-4 mol/L水平Cu2+作用下,HaCaT细胞内ROS升高程度几乎与10-6~10-5 mol/L 水平相当,当Cu2+浓度进一步升高达到10-3 mol/L时,ROS反而出现了明显的下降。究其原因,我们考虑浓度过高的Cu2+可能与所有的蛋白质巯基结合,使蛋白质成分失活,细胞的膜结构迅速破坏,细胞死亡进而丧失产生ROS的能力。尽管刘志伟等[10]、Qian等[16]分别阐述了Cu2+对人肠道上皮细胞(Caco-2)、星形胶质细胞(CCF-STTG1)胞内ROS产生的影响,但是对于ROS与细胞增殖之间的剂量-效应关系却没有涉及。我们在实验中发现,在微摩尔浓度下,HaCaT细 胞的相对增殖率与细胞内ROS产生随Cu2+浓度升高而增强。这对于阐述ROS的量效关系是非常有意义的。
目前认为ROS是调节细胞生理过程的“双刃剑”:高浓度情况下,ROS参与了诸如缺血-再灌注损伤、癌变、动脉粥样硬化及衰老等多种病理过程;在低浓度时,ROS则在胞内信号转导方面发挥着重要的作用,是细胞增殖、分化的必要条件[15, 17, 18, 19]。微摩尔浓度Cu2+在引起胞内ROS升高10.99%~17.34%时并未影响细胞的正常增殖反应;而升高34.29%~40.47%时则表现出了明显的促增殖效应。这两个浓度范围的ROS可能即分别是维持细胞正常功能的“生理浓度”和发挥促增殖效应的浓度。为了探索ROS浓度水平与增殖之间的联系,我们在实验中引入了活性氧清除剂NAC来观察确认Cu2+产生的ROS在促进细胞增殖中的作用。NAC作为一种含巯基(-SH)的化合物,易透过细胞膜,脱去乙酰基,形成抗氧化剂谷胱甘肽(GSH)的前体物质L-半胱氨酸,已在临床治疗及实验研究中应用广泛[20]。加入5 mmol/L NAC处理细胞后,微摩尔浓度Cu2+对HaCaT细胞内ROS产生的诱导能力下降,同时也下调了其对细胞的促增殖活性。由此可见,活性氧清除剂NAC拮抗了微摩尔浓度Cu2+的促细胞增殖效应。因此,我们推测:微摩尔浓度Cu2+可能是通过促进ROS的适度上调来促进细胞的增殖。除此之外,其具体的分子机制以及是否存在其他的作用机制都尚待进一步进行研究。
此外,还有另一现象值得我们关注。在细胞毒浓度10-4 mol/L水平,Cu2+引起HaCaT细胞内ROS升高30.66%时细胞相对增殖率却下降至18.96%;加入5 mmol/L NAC处理细胞后,胞内ROS产生显著下降的同时细胞增殖水平却没有得到恢复,高浓度Cu2+的增殖毒性没有受到拮抗。该现象说明高浓度Cu2+的毒性机制除大量活性氧所致的氧化应激损伤外,Cu2+直接与巯基或DNA结合,直接引起蛋白质及核酸变性可能在其中扮演着更加重要的角色[5]。
综上所述,在不打破细胞内氧化还原平衡的前提下,微摩尔浓度Cu2+诱导了一定量的胞内ROS产生,促进了HaCaT细胞的增殖。活性氧清除剂NAC通过清除ROS,阻断了氧化还原体系的上调,拮抗了微摩尔浓度Cu2+的促细胞增殖作用,进一步佐证了我们对于微摩尔浓度Cu2+通过上调ROS产生发挥促增殖作用的推测。文献[19, 21]报道ROS可以激活的MAPK-ERK、PI3K-Akt等下游信号通路。这将有助于我们进一步研究微摩尔浓度Cu2+促增殖效应的信号转导分子机制。
| [1] | Grass G, Rensing C, Solioz M. Metallic copper as an antimicrobial surface[J]. Appl Environ Microbiol, 2011, 77(5): 1541-1547. |
| [2] | Grace M, Chand N, Bajpai B K. Copper Alginate-Cotton Cellulose (CACC) Fibers with Excellent Antibacterial Properties[J]. J Eng Fiber Fabr, 2009, 4(3): 24-35. |
| [3] | Monk A B, Kanmukhla V, Trinder K, et al. Potent bactericidal efficacy of copper oxide impregnated non-porous solid surfaces[J]. BMC Microbiol, 2014, 14: 57. |
| [4] | Borkow G, Gabbay J, Dardik R, et al. Molecular mechanisms of enhanced wound healing by copper oxide-impregnated dressings[J]. Wound Repair Regen, 2010, 18(2): 266-275. |
| [5] | Borkow G, Gabbay J. Copper as a biocidal tool[J]. Curr Med Chem, 2005, 12(18): 2163-2175. |
| [6] | Turski M L, Thiele D J. New roles for copper metabolism in cell proliferation, signaling, and disease[J]. J Biol Chem, 2009, 284(2): 717-721. |
| [7] | Hu G F. Copper stimulates proliferation of human endothelial cells under culture[J]. J Cell Biochem, 1998, 69(3): 326-335. |
| [8] | 罗堃, 范兆心, 冯喆, 等. 铜离子对血管内皮细胞增殖与分化的影响[J]. 中国修复重建外科杂志, 2009, 23(7): 832-835. |
| [9] | 张金超, 李亚平, 杨康宁, 等. Cu2+和Cu+对原代培养的小鼠成骨细胞增殖、分化和钙化的影响 [J]. 无机化学学报, 2010, 26(12): 2251-2258. |
| [10] | 刘志伟, 陈佳琳, 陈秉衡. 铜对人类肠道上皮Caco-2细胞的毒性研究[J]. 卫生研究, 2004, 33(3): 284-287. |
| [11] | 廖明阳, 刘华钢. 纳米铜的细胞毒性与溶出度分析[J]. 华西药学杂志, 2011, 26(1): 41-44. |
| [12] | Hosseini M J, Shaki F, Ghazi-Khansari M, et al. Toxicity of copper on isolated liver mitochondria: impairment at complexes I, II, and IV leads to increased ROS production[J]. Cell Biochem Biophys, 2014, 70(1): 367-381. |
| [13] | Shahid M, Pourrut B, Dumat C, et al. Heavy-metal-induced reactive oxygen species: phytotoxicity and physicochemical changes in plants[J]. Rev Environ Contam Toxicol, 2014, 232: 1-44. |
| [14] | Videla L A, Fernandez V, Tapia G, et al. Oxidative stress-mediated hepatotoxicity of iron and copper: role of Kupffer cells[J]. Biometals, 2003, 16(1): 103-111. |
| [15] | Rodrigo-Moreno A, Poschenrieder C, Shabala S. Transition metals: a double edge sward in ROS generation and signaling[J]. Plant Signal Behav, 2013, 8(3): e23425. |
| [16] | Qian Y, Zheng Y, Abraham L, et al. Differential profiles of copper-induced ROS generation in human neuroblastoma and astrocytoma cells[J]. Brain Res Mol Brain Res, 2005, 134(2): 323-332. |
| [17] | 杨晓姗, 林雅军, 魏洁, 等. 重组人p66Shc腺病毒抑制HeLa细胞增殖的机制研究[J]. 第三军医大学学报, 2014, 36(19): 1991-1995. |
| [18] | Sena L A, Chandel N S. Physiological roles of mitochondrial reactive oxygen species[J]. Mol Cell, 2012, 48(2): 158-167. |
| [19] | Sauer H, Wartenberg M, Hescheler J. Reactive oxygen species as intracellular messengers during cell growth and differentiation[J]. Cell Physiol Biochem, 2001, 11(4): 173-186. |
| [20] | Samuni Y, Goldstein S, Dean O M, et al. The chemistry and biological activities of N-acetylcysteine[J]. Biochim Biophys Acta, 2013, 1830(8): 4117-4129. |
| [21] | Bito T, Nishigori C. Impact of reactive oxygen species on keratinocyte signaling pathways[J]. J Dermatol Sci, 2012, 68(1): 3-8. |



