干燥综合征(Sjgren’s syndrome,SS)是一种主要侵犯外分泌腺体尤以唾液腺和泪腺为主的慢性自身免疫性疾病,主要表现为口干、眼干等症状,也可有多器官、多系统损害[1]。受累腺体中有大量淋巴细胞浸润,血清中多种自身抗体阳性[2]。流行病学研究表明女性患者多于男性,男女之比为1 ∶9,发病年龄多数为40~60岁。干眼是由于泪液的量或质或流体动力学异常引起的泪膜不稳定和(或)眼表损害,从而导致眼不适症状及视功能障碍的一类疾病[3]。流行病学调查显示[4],干眼的患病人群中女性发病率为22.8%,高于男性的14.9%。高龄和女性已被认为是干眼发生的主要危险因素,特别是围绝经期和绝经后的妇女[5]。
C57BL/6.NOD-Aec1Aec2小鼠是将NOD小鼠与C57BL/6J小鼠先相互杂交,再近交多代后得到纯合的、只含有NOD小鼠中可参与干燥综合征发病的Idd3和Idd5两个疾病易感基因位点的小鼠[6]。C57BL/6.NOD-Aec1Aec2 小鼠完全显现出NOD小鼠类似干燥综合征的表型,但无胰岛炎和自身免疫性(1型)糖尿病的表现[6]。该小鼠能够较好地模拟人干燥综合征慢性病程、逐渐恶化的特点,是研究干燥综合征发病机制的理想动物模型[7]。我们早期实验研究[8]也证明C57BL/6.NOD-Aec1Aec2干燥综合征模型小鼠可自发地产生干眼,且随着周龄增加,其干眼体征加重。但该小鼠的干眼是否存在性别差异,目前尚不清楚,因此本研究拟探讨此问题。 1 材料与方法 1.1 实验动物
C57BL/6.NOD-Aec1Aec2雌、雄性小鼠各45只(第三军医大学全军免疫研究所郭波教授提供),饲养于第三军医大学西南医院中心实验室SPF动物房(饲养温度:25~28 ℃;相对湿度:50%~70%;光照/黑暗时间:12 h/12 h;水和敷料均经高温消毒)。分别在2组小鼠出生后第4、8、12、16、20周龄5个时间点进行各项实验。 1.2 泪液分泌实验Ⅰ(schirmer test Ⅰ,SIt Ⅰ)
采用该方法检测2组小鼠在不同时间点眼部无表面麻醉时的泪液分泌量[9]。显微镊夹住酚红棉线(天津晶明新技术开发有限公司),置于小鼠双眼外眦部60 s后,测量酚红棉线湿润变红部分的长度作为泪液量的估计值(以毫米为单位)。每组每个时间点各检测10只眼睛,每只眼均测量3次,由2人读数后取平均值。 1.3 角膜荧光素染色及评分
使用微量加液器在无表面麻醉的C57BL/6.NOD-Aec1Aec2小鼠下方结膜囊内滴入1 μL 1%荧光素钠溶液(international medication systems,LTD),3 min后在裂隙灯显微镜下采用钴蓝光检查并照相记录[9]。将角膜划分为鼻上方、鼻下方、颞上方、颞下方4个象限,每个象限评分按照0分(无着色)、1分(点状着色)、2分(点片状着色)、3分(片状着色)进行,每个角膜评分为4个象限评分之和。每组每个时间点均测量10只眼睛并照相记录,由2人评分后取均值。 1.4 泪腺组织病理学观察及炎症细胞计数
在各个时间点均选C57BL/6.NOD-Aec1Aec2雌性及雄性小鼠各5只,麻醉处死。手术显微镜下取出双侧泪腺,磷酸盐缓冲液(pH 7.4)清洗后,迅速置于4%多聚甲醛缓冲液中,4 ℃固定,2 h后,换置于25%蔗糖,4 ℃脱水过夜。标本经液氮速冻后,在-20 ℃冰冻切片机切片处理(每张切片厚度10 μm)。泪腺切片经苏木精-伊红染色剂(南京建成科技有限公司)染色,光学显微镜(Olympus,日本)下观察泪腺组织形态及淋巴细胞浸润变化并计数,每个标本计算3张切片,取均值。 1.5 角膜扫描电镜观察
在各个时间点均选C57BL/6.NOD-Aec1Aec2雌性及雄性小鼠各5只,磷酸盐缓冲液(pH 7.4)轻轻冲洗小鼠角膜和结膜,眼科剪剪取眼球(不含眼睑)后,迅速置于2.5%戊二醛中,4 ℃固定。12 h后,眼球经梯度脱水、临界点干燥法干燥及镀银处理,扫描电子显微镜(S-3400N,日本Hitachi公司)下观察角膜上皮细胞及微绒毛的形态。 1.6 统计学方法
采用SPSS 13.0统计软件,结果以x ±s表示,用双因素方差分析分别比较C57BL/6.NOD-Aec1Aec2的 雌性与雄性小鼠在5个时间点的泪液分泌值、角膜荧光素染色评分及泪腺炎症细胞数目的差异。用LSD检验方法比较2组小鼠各个指标在相同时间点的差异。 2 结果 2.1 泪液分泌实验结果
自第8周龄起,C57BL/6.NOD-Aec1Aec2 雌、雄性小鼠泪液分泌值均随着周龄的增加而下降(P<0.05)。第16周龄时,C57BL/6.NOD-Aec1Aec2雌性小鼠较雄性小鼠的泪液分泌量少,差异有统计意义(P=0.035)。其余周龄雌、雄性小鼠之间的泪液分泌值无显著差异(P>0.05,表 1)。以上结果表明:随着周龄的增加,C57BL/6.NOD-Aec1Aec2雌、雄性小鼠泪液分泌值均逐渐减少,且在第16周龄时,其泪液分泌值出现性别差异,提示干眼的程度在干眼小鼠模型中存在性别的差异。
| 组别 | 4周 | 8周 | 12 周 | 16周 | 20周 |
| 雌性小鼠组 | 1.064±0.175 | 0.938±0.121b | 0.813±0.096c | 0.669±0.121ac | 0.692±0.164c |
| 雄性小鼠组 | 1.171±0.195 | 1.045±0.113b | 0.922±0.080c | 0.799±0.123c | 0.795±0.130c |
| 双因素方差分析:F=1.822,P>0.05,方差齐;不同时间点因素主效应有显著差异,即F=29.302,P<0.01;雌、雄分组因素主效应有显著差异,即F=16.719,P<0.01;雌、雄分组与不同时间点之间不存在交互效应,F=0.031,P>0.05;a:P<0.05,与雄性小鼠比较;b:P<0.05,c:P<0.01,与4周龄小鼠比较 | |||||
自第8周龄起,C57BL/6.NOD-Aec1Aec2雌、雄性小鼠角膜荧光素染色评分随周龄的增加而增加(P<0.05,表 2)。由图 1可见,随着周龄的增加,角膜荧光素染色阳性着色由点状(图 1A、F)、点片状(图 1B、G),再到片状(图 1C、H)逐渐加重,甚至伴有角膜水肿(图 1 D、I);第16周龄时,C57BL/6.NOD-Aec1Aec2雌性小鼠较雄性小鼠的角膜荧光素染色严重,差异有统计学意义(P=0.028),其余周龄雌、雄性小鼠之间的角膜荧光素染色评分无显著差异(P>0.05,表 2)。以上结果表明:随着周龄的增加,C57BL/6.NOD-Aec1Aec2雌、雄性小鼠角膜损伤程度均逐渐增加,且在第16周龄时,出现性别差异,雌性小鼠较雄性小鼠角膜损伤程度严重,提示干眼的程度在干眼小鼠模型中存在性别的差异。
 |
| A~E:依次为第4、8、12、16、20周龄雌性小鼠;F~J:依次为4、8、12、16、20周龄雄性小鼠 ↑:示荧光素染色阳性着染点图 1 C57BL/6.NOD-Aec1Aec2雌、雄性小鼠角膜荧光素染色观察 (×40) |
| 组别 | 4周 | 8周 | 12 周 | 16周 | 20周 |
| 雌性小鼠组 | 4.000±0.471 | 5.250±0.677b | 8.000±0.782b | 11.250±0.486ab | 10.750±0.589b |
| 雄性小鼠组 | 3.650±0.337 | 4.750±0.791b | 7.600±0.459b | 10.650±0.709b | 10.250±0.540b |
| 双因素方差分析:F=1.377,P>0.05,方差齐;不同时间点因素主效应有显著差异,即F=570.753,P<0.01;雌、雄分组因素主效应有显著差异,即F=15.496,P<0.01;雌、雄分组与不同时间点之间不存在交互效应,F=0.133,P>0.05;a:P<0.05,与雄性小鼠比较;b:P<0.01,与4周龄小鼠比较 | |||||
由图 2可见,第4、8周龄时,C57BL/6.NOD-Aec1Aec2雌、雄性小鼠泪腺的腺管、腺泡结构完整、排列规则;自第12周龄起,C57BL/6.NOD-Aec1Aec2雌、雄性小鼠泪腺的腺泡细胞出现空泡,腺管扩张及排列紊乱,淋巴细胞浸润增多;且第16、20周龄时,小鼠泪腺可见大量淋巴细胞浸润,伴随腺管及腺泡结构破坏。由表 3可见,C57BL/6.NOD-Aec1Aec2雌、雄性小鼠泪腺炎性细胞浸润均随着周龄的增加而加重(P<0.01),且第16周龄时,C57BL/6.NOD-Aec1Aec2雌性小鼠较雄性小鼠的泪腺炎性细胞浸润程度严重,差异有统计学意义(P=0.017),其余周龄雌、雄性小鼠之间的泪腺炎性细胞浸润程度保持相对稳定(P>0.05,表 3)。以上结果表明:随着周龄的增加,C57BL/6.NOD-Aec1Aec2雌、雄性小鼠泪腺的炎症浸润程度均逐渐增加,且在第16周龄时,出现性别差异,雌性小鼠较雄性小鼠的泪腺炎性细胞浸润程度严重,提示泪腺炎性细胞浸润的程度在干眼小鼠模型中存在性别的差异。
 |
| A~E:依次为第4、8、12、16、20周龄雌性小鼠;F~J:依次为4、8、12、16、20周龄雄性小鼠 ↑:示浸润的淋巴细胞及纤维化的腺管图 2 C57BL/6.NOD-Aec1Aec2雌、雄性小鼠泪腺淋巴细胞浸润观察 (HE ×400) |
| 组别 | 4周 | 8周 | 12 周 | 16周 | 20周 |
| 雌性小鼠组 | 154.500±40.879 | 303.500±64.704b | 541.500±117.473b | 979.167±19.600ab | 900.333±49.798b |
| 雄性小鼠组 | 153.833±45.323 | 258.667±31.117b | 475.167±97.874b | 870.500±118.269b | 827.833±94.639b |
| 双因素方差分析:F=1.721,P>0.05,方差齐;不同时间点因素主效应有显著差异,即F=242.729,P<0.01;雌、雄分组因素主效应有显著差异,即F=8.871,P<0.01;雌、雄分组与不同时间点之间不存在交互效应,F=0.814,P>0.05;a:P<0.05,与雄性小鼠比较;b:P<0.01,与4周龄小鼠比较 | |||||
由图 3可见,第4、8周龄C57BL/6.NOD-Aec1Aec2 雌、雄性小鼠角膜上皮组织可见六边形的上皮细胞及其中央凸起的细胞核,表面附有较多的、排列规则的微绒毛和细胞间紧密连接(图 3A、B、F、G)。随着周龄的 增加,角膜上皮细胞逐渐脱落,形态紊乱,微绒毛逐渐变短及稀疏,细胞连接减少(图 3C~E、H~J)。至第20周龄时,角膜上皮几乎完全脱落,可见表面披覆大量的上皮细胞残骸及深层的基质层胶原纤维(图 3E、J)。
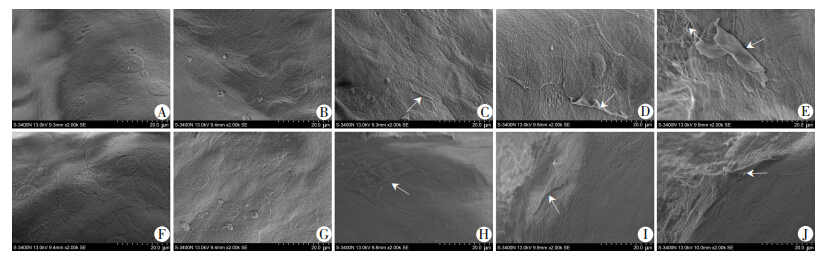 |
| A~E:依次为第4、8、12、16、20周龄雌性小鼠;F~J:依次为4、8、12、16、20周龄雄性小鼠 ↑:示坏死、脱落的上皮细胞图 3 C57BL/6.NOD-Aec1Aec2雌、雄性小鼠角膜上皮扫描电镜观察 |
干眼是一类常见的眼表疾病,严重影响人们的生活质量。泪膜是覆盖眼表前面的一层均匀液体薄膜,为眼表结构的重要组成部分。泪膜的稳定性对维持眼表的健康起着十分重要的作用。也有研究表明,干眼不只是单纯的泪膜功能不全,也是一种影响眼表和泪腺的炎症性疾病[10]。
性类固醇激素主要包括雄激素、雌激素、孕激素等,主要通过性激素受体介导作用。研究表明,眼组织中存在雄激素受体[11]、雌激素受体和孕激素受体[12]。研究还发现雄激素水平过低[13]或过高水平的雌激素[14]均可使泪液分泌减少,致使眼表干燥。而应用雄激素治疗可使泪腺中细胞内和细胞核上的雄激素受体数量明显增多,从而改善干眼症状[15]。文献[16]也报道干燥综合征小鼠模型的炎症浸润程度存在性别、损伤和组织有关的差异。
本研究通过泪液分泌实验、角膜荧光素染色评分及泪腺组织病理学观察等方法,发现C57BL/6.NOD-Aec1Aec2雌性和雄性小鼠随着观察周龄增加,其干眼体征均逐渐加重;在第16周龄时,该模型小鼠干眼体征最严重,且出现性别差异,包括:雌性小鼠较雄性小鼠的泪液分泌值少,角膜损伤及泪腺炎性细胞浸润程度更严重。因此,这些结果表明干眼程度在干眼小鼠模型中存在性别的差异,与广泛的临床实践中干眼女性患者远多于男性相符。
而至第20周龄时,2组小鼠干眼体征性别差异无统计学意义。考虑可能原因如下:该模型小鼠出现的干眼体征是不可逆的改变,至第20周龄时,雌、雄性小鼠均出现角膜上皮几乎完全脱落,暴露出的深层胶原纤维层不能被荧光素钠着染,泪腺组织中腺管及腺泡结构严重破坏,并出现纤维化,此时2组小鼠的干眼体征都已发展到严重、不可逆的阶段。而且激素水平和小鼠的生理周期(或者称生理状态)有关,不同的生理周期其激素水平不一样,并且波动很大,前期实验多次检测20周龄雌、雄性小鼠的E2数量级均为200~1 000 pmol/L,波动很大,差异不明显,故本实验没有观察到20周龄小鼠干眼表型的性别差异。本实验小鼠仍存在受外界环境影响导致性激素水平波动太大的可能,性激素在干眼综合征模型小鼠中的影响机制,我们将进一步研究。
综上所述,C57BL/6.NOD-Aec1Aec2雌性和雄性小鼠均发生干眼,其体征随观察周龄增加逐渐加重,而在第16周龄时,该雌性小鼠的干眼体征较雄性小鼠更严重,说明干眼的程度在C57BL/6.NOD-Aec1Aec2小鼠中存在性别差异,且雌性小鼠干眼体征更严重,为临床实践中女性干眼患者高于男性提供依据,也为进一步研究干眼发病机制和药物治疗奠定理论基础。
| [1] | Okuma A, Hoshino K, Ohba T, et al. Enhanced apoptosis by disruption of the STAT3-IκB-ζ signaling pathway in epithelial cells induces Sjgren’s syndrome-like autoimmune disease[J]. Immunity, 2013, 38(3): 450-460. |
| [2] | Venables P J. Sjgren’s syndrome[J]. Best Pract Res Clin Rheumatol, 2004, 18(3): 313-329. |
| [3] | 中华医学会眼科学分会角膜病学组. 干眼临床诊疗专家共识(2013年)[J]. 中华眼科杂志, 2013, 49(1): 73-75. |
| [4] | 刘丹, 郭纯刚, 李秀惠, 等. 性激素在干眼发病中作用的研究概述[J]. 中国中医眼科杂志, 2013, 23(4): 306-308. |
| [5] | Versura P, Giannaccare G, Campos E C. Sex-steroid imbalance in females and dry eye[J]. Curr Eye Res, 2015, 40(2): 162-175. |
| [6] | Cha S, Nagashima H, Brown V B, et al. Two NOD Idd-associated intervals contribute synergistically to the development of autoimmune exocrinopathy (Sjgren’s syndrome) on a healthy murine background[J]. Arthritis Rheum, 2002, 46(5): 1390-1398. |
| [7] | Nguyen C Q, Hu M H, Li Y, et al. Salivary gland tissue expression of interleukin-23 and interleukin-17 in Sjgren’s syndrome: findings in humans and mice[J]. Arthritis Rheum, 2008, 58(3): 734-743. |
| [8] | 谭莲, 谢汉平. C57BL/6.NOD-Aec1Aec2干燥综合征模型小鼠干眼特点的评价[J]. 中华实验眼科杂志, 2013, 31(4): 339-346. |
| [9] | Dursun D, Wang M, Monroy D, et al. A mouse model of keratoconjunctivitis sicca[J]. Invest Ophthalmol Vis Sci, 2002, 43(3): 632-638. |
| [10] | Narayanan S, Miller W L, McDermott A M. Conjunctival cytokine expression in symptomatic moderate dry eye subjects[J]. Invest Ophthalmol Vis Sci, 2006, 47(6): 2445-2450. |
| [11] | Rocha E M, Wickham L A, da-Silveira L A, et al. Identification of androgen receptor protein and 5alpha-reductase mRNA in human ocular tissues[J]. Br J Ophthalmol, 2000, 84(1): 76-84. |
| [12] | 李联祥, 金东岭, 高金生, 等. 人眼睑板腺和Zeis腺性激素受体定性定位的免疫组织化学研究[J]. 解剖学报, 2006, 37(1): 82-86. |
| [13] | Sullivan D A. Androgen deficiency & dry eye syndromes[J]. Arch Soc Esp Oftalmol, 2004, 79(2): 49-50. |
| [14] | Ono M, Rocha F J, Sullivan D A. Immunocytochemical location and hormonal control of androgen receptors in lacrimal tissues of the female MRL/Mp-lpr/lpr mouse model of Sjgren’s syndrome[J].Exp Eye Res, 1995, 61(6): 659-666. |
| [15] | Schaumberg D A, Buring J E, Sullivan D A, et al. Hormone replacement therapy and dry eye syndrome[J]. JAMA, 2001, 286(17): 2l14-2119. |
| [16] | Toda I, Sullivan B D, Rocha E M, et al. Impact of gender on exocrine gland inflammation in mouse models of Sjgren’s syndrome[J]. Exp Eye Res, 1999, 69(4): 355-366. |



