2400038 重庆,第三军医大学西南医院全军眼科中心,视觉损伤与再生修复重庆市重点实验室
2Center of Ophthalmology,Southwest Hospital,Third Military Medical University,Chongqing,400038,China
视网膜色素变性(retinitis pigmentosa,RP)、干性老年性黄斑变性(age-related macular degeneration,AMD)、Stargardt’s病等视网膜变性类疾病常常累及多种视网膜细胞,如感光细胞、视网膜色素上皮(retinal pigment epithelial,RPE)细胞等,引起其变性或死亡,进而导致患者视力减退甚至失明[1, 2]。目前为止尚无治疗此类疾病的有效措施,细胞移植被认为是最有前景的治疗手段,但其中合适种子细胞的选择这一关键问题仍未得到较好解决。
c-kit是原癌基因编码的Ⅰ型跨膜糖蛋白受体,同时也称作CD117,该蛋白具有酪氨酸激酶活性,其配体为干细胞因子(stem cell factor,SCF)。c-kit基因表达产物及SCF是人类多种组织细胞生长发育的重要调控因素。现已证明,c-kit/SCF信号通路在造血细胞、黑色素细胞、眼睫状上皮细胞等的生长、增殖、分化中起到关键作用[3]。另外、文献[4, 5]报道器官来源的c-kit+干细胞具有自我更新,克隆形成和多分化潜能,在体移植表现出器官特异性。
SSEA已经证实存在于ESCs 及内细胞群细胞表面,可作为未分化细胞的表面标志。在人类主要包括SSEA-3、SSEA-4,但SSEA-3在体外培养早期阶段即迅速消失,SSEA-4则表达较长时间[6]。
Sasai等[7, 8]在体外相继利用mESC、hESCs三维培养形成类似于小鼠及人正常发育中的视泡样(optic vesicle,OV)及视杯样(optic cup,OC)结构,为眼发育及眼部疾病治疗研究提供了极好的模型。由于hESCs具有向各个胚层分化的潜能,hESCs来源三维培养组织可能包含各胚层细胞,且不同批次三维培养组织分化程度亦存在差异,因此我们通过流式细胞仪筛除其中 SSEA-4+的未分化细胞[9],以减少其成瘤性风险。Koso[10]曾报道小鼠视网膜发育中c-kit、SSEA-1的时空变化规律,但有关人类视网膜发育中c-kit、SSEA-4的表达规律及作用的研究尚少见报道,本研究通过对三维培养不同阶段组织中c-kit、SSEA-4抗原进行免疫荧光鉴定及流式细胞仪检测,从而明确其时空变化规律,同时为眼治疗种子细胞合适时间窗的选择奠定理论基础。
1 材料与方法 1.1 细胞系hESCs即H1细胞系为协和医学院黄粤教授提供,采用无饲养层贴壁培养体系。
1.2 培养基及主要试剂H1细胞系所用培养基为mTeSR(Stem Cell);三维培养分化培养基为:G-MEM基础培养基(Gibco)+20%血清替代物(KSR,Gibco)+0.1 mmol/L非必需氨基酸(Sigma)+1 mmol/L丙酮酸盐(Sigma)+0.1 mmol/L 2-疏基乙醇(Sigma);三维培养长期培养基:D/F12- glutamax培养基(Gibco)+10%胎牛血清(FBS,Gibco)+1% N2(Gibco)+ 0.5 μmol/L视黄酸(Sigma)+1%青链霉素(PS,HyClone)。
其他主要试剂:Y27632、Acctuase、CS10、IWR-1、c-kit 抗体均购自Sigma 公司,H1细胞所需基础D/F12购自Gibco公司,H1包被Matrigel、growth-factor-reducedMatrigel、流式SSEA-4抗体均购自BD公司,TrypLE Express购自Invitrogen公司,DnaseⅠ购自stem cell公司,CHIR99021购自R&D公司,SAG购自Enzo Life Sciences公司;SSEA-4、Pax6、Mitf、Rax、Crx抗体购自Abcam公司,流式APC Mouse IgG1同型对照抗体、APC抗人c-kit抗体均购自Biolegend公司。
1.3 方法 1.3.1 H1细胞系的培养传代或复苏时,将Matrigel用D/F12 1 ∶100稀释,于37 ℃提前包被孔板至少30 min,第0天培养基中添加10 μmol/L Y27632,然后置于37 ℃、5%CO2细胞培养箱中,每天换液,待密度约80%时可进行传代、冻存或三维诱导分化。传 代、冻存时Acctuase 37 ℃消化约3 min,200×g、20 ℃离心3 min,弃上清重悬,以(4.2~5.2)×104/cm2传代,冻存体系多为(5~8)×105/(500 μL CS10+10 μmol/L Y27632)。
1.3.2 三维培养方案去除培养基,DMEM/F12 迅速洗2遍,添加Tryple Express、0.05 mg/mL DNase I、 10 μmol/L Y-27632,37 ℃消化3 min。1 mL加样器轻轻吹打克隆球,使其从孔板底部脱落并成单细胞状态,移入15 mL离心管,加入3 mL分化培养基终止消化。200×g、20 ℃离心3 min,弃上清,加入3 mL分化培养基重悬后细胞计数。按每孔1.5×104/100 μL种 于V底96孔板(Sumitomo Bakelite),同时添加20 μmol/L Y-27632,然后置于37 ℃、 5%CO2细胞培养箱中,其他具体培养细节参照Nakano等[8]发表的相关文献。
1.3.3 免疫荧光鉴定取三维培养不同时间的组织,用PBS迅速漂洗2遍,4%多聚甲醛4 ℃固定24 h,依次经过脱水、透明、浸蜡、包埋,采用常规石蜡切片法制片,厚约5 μm。二甲苯脱蜡15 min×2次,酒精梯度水化各10 min,柠檬酸盐溶液抗原修复,PBS漂洗5 min×3次;pax6、mitf、Rax等胞内表达抗原经0.25% Triton室温穿透10 min,PBS漂洗5 min×3次,5%山羊血清37 ℃封闭0.5 h,c-kit、SSEA-4为胞膜表达抗原无需穿透直接封闭,然后添加一抗4 ℃过夜;37 ℃复温1 h,PBS漂洗5 min×3次,加入对应荧光标记二抗,37 ℃孵育1 h,PBS漂洗5 min×3次;DAPI染细胞核,再PBS漂洗5 min×3次;最后加入防荧光淬灭液封片,晾干后行激光共聚焦照相。
1.3.4 流式细胞仪检测三维培养组织经PBS洗2遍,添加Acctuase后转移至圆皿,解剖显微镜下用1 mL空针将其剥离成小块,之后转移至37 ℃消化,每5 min吹打1次,大部分组织消化成单细胞后,等量PBS终止消化,40 μm细胞筛网(BD)过滤后细胞计数,1 100 r/min离心4 min,弃上清后PBS重悬至细胞密度为1×106/100 μL,并分为空白、同型对照、7-AAD、c-kit、SSEA-4及样本组(c-kit、SSEA-4抗体双标)。4 ℃孵育30 min,每5 min震荡1次,之后PBS漂洗2遍,1 100 r/min离心4 min,弃上清后PBS重悬细胞至500 μL,流式细胞仪检测c-kit+、SSEA-4+及c-kit+/SSEA-4-率。各时间点数据重复3次。
1.4 统计学方法数据经过SPSS 13.0软件处理,采用one way ANOVA分析方法进行检测,结果以x±s表示。
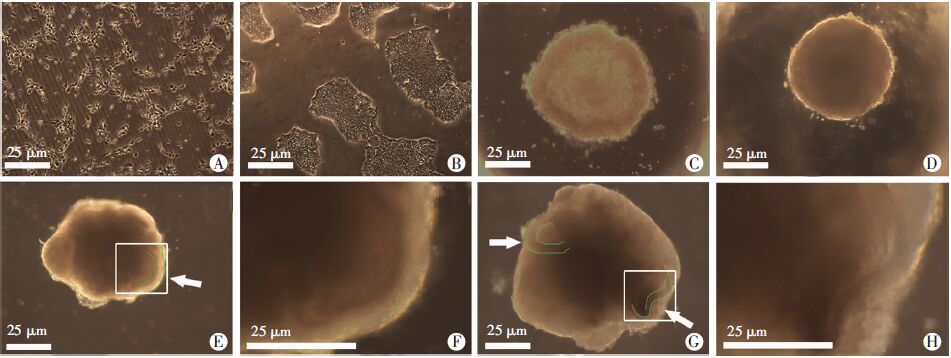
2 结果 2.1 H1细胞及三维培养组织形态学观察H1细胞因受Y-27632影响第1天胞体呈长梭形,
去除后胞体缩回呈集落样生长,第4~5天相邻集落逐
渐融合(图 1A、B)。三维培养第1天可见细胞沉积于
底部,但细胞结合较松散,且周边可见少量散细胞(图 1C)。第6~11天可见细胞逐渐形成结构致密、形态规则的拟胚体(embryoidbodies,EBs)(图 1D),此期为EBs期。第12~18天约50%的EB可形成折光性较强类OV样结构,这标志着三维培养进入OV期(图 1E、F)。继续培养至第19~24天,约20% OV可形成由外侧RPE上皮和内侧NR上皮组成的双层杯 凹状结构,类似眼睛正常发育过程中的OC(图 1G、H)。
|
| A:H1细胞传代第1天呈联网状生长,胞体长梭形;B:H1细胞第4天呈集落样生长,部分相邻集落融合;C、D、E、G: 分别为三维培养聚集期细胞团、EB、OV、OC;F、H:分别为E、G白框所示OV、OC局部放大图像 图 1 倒置显微镜观察H1细胞及三维培养组织不同阶段变化 |
三维培养第14天可见大部分细胞呈现Rax+的OV状结构,提示hESCs已定向分化为眼前体细胞。至第30天则形成具有内层Pax6+、外层Mitf+的典型双层杯状结构,提示已成功诱导分化出具有内NR层及外 RPE层的类OC状结构。至第90天,可见部分Crx+细胞,提示OC可进一步分化为感光前体细胞。见图 2。

|
| A~C:三维培养第30天OC Mitf、Pax6抗体染色,虚线示OC样结构;D、E:三维培养第14、30天OV Rax抗体染色,虚线示OV样结构;F:三维培养第90天OC Crx抗体染色 图 2 三维培养组织免疫荧光鉴定结果 |
免疫荧光鉴定结果显示三维培养第7~90天,c-kit+率均处于较低水平,但相比之下,第14、21天 c-kit+ 率仍较高。与c-kit不同,SSEA-4+细胞比例则在第7~49天逐渐下降,之后一直维持于较低水平。在空间分布方面,各时间点c-kit+细胞均主要存在于NR上皮层,SSEA-4则早期均匀表达于整个组织,随诱导分化时间延长,其中间区域表达量逐渐减少,后期主要集中于周边部组织。见图 3。

|
| 箭头示c-kit+细胞 图 3 三维培养组织不同时间c-kit、SSEA-4免疫荧光鉴定结果 |
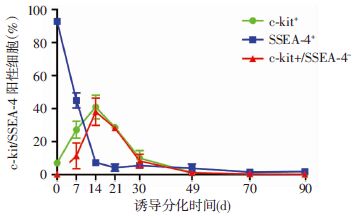
三维培养第0~90天,流式细胞仪检测结果显示:c-kit+率呈先增高后下降趋势,第0天约为10%,之后逐渐上升并在第14天达高峰值40%,其与第0、7天相比,差异具有统计学意义(P<0.01)。后又持续下降至第49天的1%,并至第90天一直维持于该低水平,与第14天的40%相比统计学差异显著(P<0.01),但第49、70、90天c-kit+率差异无统计学意义。c-kit+/SSEA-4-率表现出与c-kit+率一致的趋势,即 第14天达高峰值约35%,与第0天相比具有统计学差异(P<0.01)。至第49天下降为约1%,并一直维持至第90天,同样第49、70、90天差异无统计学意义。但SSEA-4+率则从第0天的90%一直下降至第49天的1%并维持至第90天,第0、7、14天SSEA-4+率两两相比差异具有统计学意义(P<0.01),第14、21、30、49、70、90天SSEA-4+率两两相比无统计学差异(图 4、5)。

|
| 图 4 三维培养组织各时间c-kit、SSEA-4表达率流式细胞仪检测结果 |
|
| 图 5 三维培养组织各时间点c-kit+、SSEA-4+、c-kit+/SSEA-4-率表达变化 (x±s,n=3) |
器官来源c-kit+干细胞具有自我更新,克隆形成和多分化潜能。肺脏及肾脏来源c-kit+干细胞均可跨胚层分化,并形成血管细胞,在体移植后均表现出器官特异性。Das等[3]发现c-kit信号与人脉络膜睫状体上皮(ciliary epithelium,CE)来源神经干细胞(neural stem cell,NSC)的增殖、分化等有关。Koso等[10]认为c-kit、SSEA-1可作为小鼠视网膜祖细胞的相关标志物,并且证实c-kit与小鼠视网膜发育密切相关。但人类视网膜发育中相关指标表达规律及作用的研究尚少见报道,三维培养hESCs来源OV样、OC样组织可体外模拟人类眼睛及视网膜发育过程,本研究通过研究该模型中c-kit、SSEA-4的时空表达特性,间接阐述人类视网膜发育中的相关机制,并为寻找合适的人视网膜祖细胞提供理论依据。
实验结果显示,三维培养诱导分化中,约50%EBs进入OV期,随诱导分化时间延长,Rax+OV状结构可逐渐形成典型双层杯凹状结构,即具有Mitf+外侧RPE层及Pax6+内侧NR层的OC状结构,这些均与Nakano[8]的报道基本一致。
另外可见c-kit主要表达于OV状、OC状组织的NR样结构中,呈先升高后下降趋势,并在第14天达高峰值40%;SSEA-4早期高表达于整个组织,后逐渐下降并低水平维持于周边部。这与Koso[10]的结果相一致,即从胚胎第14天(E14)至出生后第13天(P13),小鼠视网膜中c-kit在P1达高峰,SSEA-1则主要表达于不成熟的视网膜祖细胞并逐渐下降。但本实验中,各时间点免疫荧光鉴定c-kit+率低于流式检测结果,推测原因可能为:(1)免疫荧光鉴定抗体与流式抗体类型不同,因此二者结果存在一定差异;(2)单个EB可获得约40张切片,且其中OV或OC样结构分布不均匀,因此单张切片染色结果代替整体存在一定偏倚和误差。尽管如此,但二者中c-kit表达趋势仍一致,即随诱导分化时间延长,都呈先升高后下降趋势。
本实验三维培养OV期EBs强表达Rax抗体,提示其启动向眼前体发育的机制。在神经系统的发育中,c-kit信号对神经嵴祖细胞的生长、迁徙、增殖、分化起到重要作用[11]。Das[3]也曾报道c-kit信号通过影响Notch1信号通路的表达,在人CE-NSC的分化中发挥作用。本研究结果显示在诱导分化第14天c-kit表达增高,提示EBs向OV样组织分化阶段伴随c-kit基因的激活及表达,然而其具体机制仍待进一步研究。
同时,随三维诱导分化时间延长,大部分hESCs向OV样及OC样组织定向分化,未分化细胞逐渐减少,因此SSEA-4表达率逐渐降低,与之前文献[10]报道一致。这些均说明hESCs来源三维培养组织早期大部分细胞处于未分化阶段,后在多种诱导因子作用下才向OV样、OC样结构定向分化发育。
我们还发现c-kit+/SSEA-4-细胞比例与c-kit+率变化趋势一致,即第14天时达峰值约35%,之后一直下降。但此时由于三维培养组织仍处于OV期,即类似人眼前体期[12],针对视网膜变性类疾病,OC期的视网膜祖细胞是更适合移植的种子细胞来源,并猜测OC样组织来源c-kit+/SSEA-4-细胞可能为器官特异性祖细胞,在眼内微环境诱导下可分化为感光、RPE及神经节细胞等多种视网膜细胞,但这些都需要后续实验进一步研究证实。
| [1] | Bharti K, Rao M, Hull S C, et al. Developing cellular therapies for retinal degenerative diseases[J]. Invest Ophthalmol Vis Sci, 2014, 55(2): 1191-1202. |
| [2] | Davidson K C, Guymer R H, Pera M F, et al. Human pluripotent stem cell strategies for age-related macular degeneration[J]. Optom Vis Sci, 2014, 91(8): 887-893. |
| [3] | Das A V, James J, Zhao X, et al. Identification of c-Kit receptor as a regulator of adult neural stem cells in the mammalian eye: interactions with Notch signaling[J]. Dev Biol, 2004, 273(1): 87- 105. |
| [4] | Kajstura J, Rota M, Hall S R, et al. Evidence for human lung stem cells[J]. N Engl J Med, 2011, 364(19): 1795-1806. |
| [5] | Rangel E B, Gomes S A, Dulce R A, et al. C-kit(+) cells isolated from developing kidneys are a novel population of stem cells with regenerative potential[J]. Stem Cells, 2013, 31(8): 1644-1656. |
| [6] | He H, Nagamura-Inoue T, Tsunoda H, et al. Stage-specific embryonic antigen 4 in Wharton's jelly-derived mesenchymal stem cells is not a marker for proliferation and multipotency[J]. Tissue Eng Part A, 2014, 20(7/8): 1314-1324. |
| [7] | Eiraku M, Takata N, Ishibashi H, et al. Self-organizing optic-cup morphogenesis in three-dimensional culture[J]. Nature, 2011, 472(7341): 51-56. |
| [8] | Nakano T, Ando S, Takata N, et al. Self-formation of optic cups and storable stratified neural retina from human ESCs[J]. Cell Stem Cell, 2012, 10(6): 771-785. |
| [9] | Ramirez J M, Gerbal-Chaloin S, Milhavet O, et al. Brief report: benchmarking human pluripotent stem cell markers during differentiation into the three germ layers unveils a striking heterogeneity: all markers are not equal[J]. Stem Cells, 2011, 29(9): 1469-1474. |
| [10] | Koso H, Satoh S, Watanabe S. c-kit marks late retinal progenitor cells and regulates their differentiation in developing mouse retina[J]. Dev Biol, 2007, 301(1): 141-154. |
| [11] | Xu Q, Wang S, Jiang X, et al. Hypoxia-induced astrocytes promote the migration of neural progenitor cells via vascular endothelial factor, stem cell factor, stromal-derived factor-1alpha and monocyte chemoattractant protein-1 upregulation in vitro[J]. Clin Exp Pharmacol Physiol, 2007, 34(7): 624-631. |
| [12] | Heavner W, Pevny L. Eye development and retinogenesis[J]. Cold Spring Harb Perspect Biol, 2012, 4(12): a008391. |



