2. 400013 重庆,重庆市人民医院病理科;
3. 400037 重庆,第三军医大学新桥医院泌尿外一科
2. Department of Pathology, Chongqing People’s Hospital, Chongqing, 400013;
3. Department of Urology, Xinqiao Hospital, Third Military Medical University, Chongqing, 400037, China
目前,我国慢性肾脏疾病已成为非常严重的公共卫生问题,且其发病率呈逐渐上升趋势[1]。血液透析和肾移植依然是治疗肾衰竭的主要方法。血液透析能够移除体内代谢废物,维持内环境的稳定,但其仅是作为延长患者生存的一种技术手段,并不能恢复患者的肾脏功能。肾移植术较血液透析可大大改善肾衰竭患者的生活质量,随着手术技术日趋成熟,存活率较以前 大大提高,但术后要长期服用抗排斥药物,需要大量费用,有时会因急性或慢性排斥反应而造成移植肾功能丧失,而且供肾来源有限,无法满足临床患者的大量需求。
脱细胞基质材料是通过理化方法去除生物体原组织中的实质细胞制备的一种特殊的天然生物材料。由于其是由机体本身多种生物大分子组成的维网络状结构,较其他支架材料免疫排斥性小,具有完整的三维空间结构和脉管系统,对于调节细胞在材料上的黏附、生长和增殖具有重要作用[2, 3]。脱细胞外基质材料是目前组织工程研究的热点,本研究尝试制备犬肾脏脱细胞基质的凝胶形式,并检测肾脏脱细胞基质凝胶与肾小管上皮细胞的生物相容性,探讨将其应用于组织工程重建肾脏的可能性。
1 材料与方法 1.1 材料10~12 kg成年雄性比格犬(四川都江堰市养麝研究所提供);冷冻研磨机(美国SPEX公司);0.2 mm的针头式过滤器(美国Fisher Scientific公司);糖胺聚糖(GAGs)测定试剂盒(英国Biocolor公司);DNA提取试剂盒(德国Qiagen公司);MTS试剂盒(美国Promga公司)胃蛋白酶(美国Fisher Scientific公司);SDS(美国Sigma公司);Triton(美国Sigma公司)。
1.2 方法 1.2.1 肾脏脱细胞化10~12 kg成年雄性比格犬 10只,无菌条件下取犬肾脏,切成3 cm×2 cm×0.5 cm 的薄片,分为实验组和对照组,对照组不行脱细胞处理过程,直接进行相关检测,实验组行脱细胞处理,大体过程如下,加入蒸馏水+10 kIU/mL的抑肽酶,于4 ℃ 48 h不断搅拌,然后在1% 的Triton于4 ℃恒定搅拌下24 h,1% 的SDS于4 ℃恒定搅拌下24 h,50 IU/mL的DNA酶Ⅰ、1 IU/mL的RNA酶A在4 ℃,不断搅拌24 h,PBS洗涤、冷藏、冻干并通过12 kGy 60Co照射灭菌,并于-20 ℃直至使用密封,HE染色及DAPI染色观察脱细胞效果及相应组织结构。
1.2.2 制备凝胶参考其他组织脱细胞凝胶制备方法[4, 5, 6, 7],将肾脏脱细胞样品于-80 ℃冷冻过夜,然 后采用冷冻研磨机,48 h研磨成粉末,1 g粉末和100 mg 胃蛋白酶混合在100 mL的0.01 mol/L HCl中,室温搅拌48 h,将混合物在4 ℃下转移至50 mL管中,并在3 000 r/min下离心15 min。在收集上清液,并通过0.2 mm的针头式过滤器过滤,-80 ℃储存备用,准备 凝胶化前,将溶液在4 ℃下加入10×PBS和0.1 nmol/L NaOH 将pH值调制至7.4,并放置于37 ℃下孵育30 min 成凝胶。
1.2.3 HE染色样本10%甲醛灌注固定,脱水、透明、浸蜡、包埋、切片、脱蜡,HE 染色后光镜下观察。
1.2.4 DAPI染色样本10%甲醛灌注固定,脱水、透明、浸蜡、包埋、切片、脱蜡,经DAPI染色后荧光显微镜下观察。
1.2.5 扫描电镜样本2.5%戊二醛固定,脱水、干燥、真空喷镀后扫描电镜下观察。
1.2.6 DNA定量采用DNA提取试剂盒,从25 mg 样品中提取DNA,波长260 nm处测定DNA含量。
1.2.7 GAGs检测加1.0 mL的Blyscan染料溶液到待测样本中,充分混匀,待不溶物出现,离心,弃上清,加入1.0 mL的染料释放剂,充分混匀,溶解5 min以上,使染料充分释放,用分光光度计于波长656 nm处测定。
1.2.8 细胞培养将1×104的人肾小管上皮细胞 株(HK-2细胞)与100 μL凝胶混合,加入24孔板37 ℃ 下孵育30 min,然后加DMEM/F12(1 ∶1)+10%FBS在37 ℃,5% CO2条件下进行培养,未加凝胶组作为对照,每2天换液1次,MTS法测定细胞增殖,分别在1、3、5、7、9、11 d收集细胞,MTS试剂与细胞37 ℃避光孵育1 h,将上清液加入100 μL至96孔板,使用分光光度计在波长490 nm处测定光密度值[D(490)]。
1.3 统计学分析采用SPSS 18.0统计软件,数据以 x±s表示,两两比较行t检验。
2 结果 2.1 形态学观察HE染色结果对照组可见肾小球、肾小管等组织结构清楚,细胞核清晰可见;实验组可见仅留下细胞外基质,肾小球及肾小管内均未发现细胞残留。DAPI染色观察结果对照组可见细胞核充满视野;实验组仅见微弱的荧光,提示无明显细胞核残留(图1)。脱细胞基质经处理后可形成白色半透明的凝胶状;扫描电镜观察结果提示脱细胞基质凝胶呈网状、多孔结构,适合细胞长入(图2)。
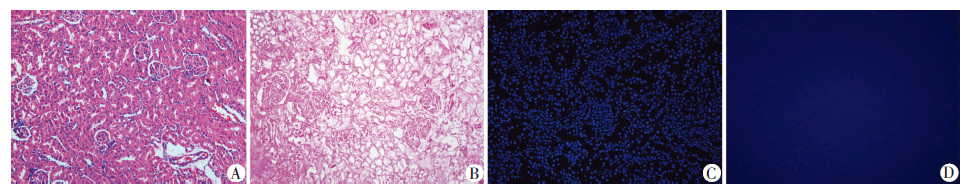 |
| A、C:对照组;B、D:实验组;A、B:HE染色;C、D:DAPI染色图 1 犬肾脏脱细胞处理与对照组的组织形态学检测结果 (×100) |
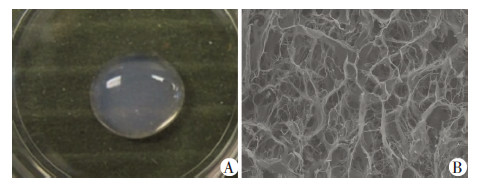 |
| A:大体观察;B:扫描电镜(×100)图 2 犬肾脏脱细胞基质凝胶组织形态学检测结果 |
经脱细胞处理后,实验组GAGs含量为(15.83±1.53)μg/mg,对照组为(28.51±1.04)μg/mg;实验组DNA含量为(4.38±1.47)ng/mg,对照组为(71.76±4.38)ng/mg,两组比较差异有统计学意义(P<0.01)。
2.3 细胞相容性结果显示,培养瓶的2D培养和肾脱细胞基质凝胶的3D培养的HK-2细胞存在生物学特性的差异。在2D培养条件中,HK-2细胞呈单层铺路石样生长,并且在1周内达到融合;在细胞外基质凝胶的3D培养条件中,HK-2细胞呈簇生长,堆积成球形。MTS测定表明,HK-2细胞在肾脏脱细胞基质凝胶中开始增殖缓慢,第3天进入增殖期,增殖期较长,而在2D培养条件下,细胞进入增殖期较快,第7天达到高峰,然后进入平台期(图3)。
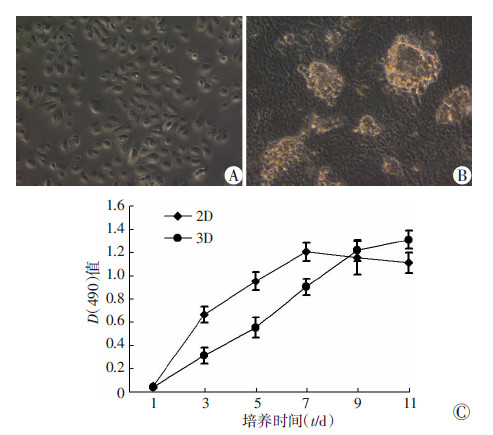 |
| A:2D培养(×100);B:凝胶3D培养(×100);C:生长曲线图 3 犬肾脏脱细胞基质凝胶对HK-2细胞培养 |
近年来,随着生命科学和工程学技术的提高,组织工程学已经在皮肤、软骨、血管、神经、小肠、膀胱、心脏瓣膜等组织和器官进行了深入的研究。目前国际上,组织工程皮肤和软骨实现了规模化生产和上市销售,组织工程研发的一些产品已进入临床研究阶段,其相关技术手段也为肾脏组织工程的研究提供了可能[8, 9]。肾脏结构是复杂的空间立体结构,如何选择合适的支架材料模拟体内正常的生长环境来诱导种子细胞形成肾脏组织,对于肾脏组织工程具有重要的意义。
水凝胶材料是组织工程材料的重要组成部分,具有网状的空间结构,能保持一定的形状,性质柔软,富含水分,利于细胞生长所需的氧气和营养物质的传递和运输。按照其来源可分为天然水凝胶和合成水凝胶两大类。天然水凝胶包括透明质酸明胶、海藻酸盐、壳聚糖、胶原蛋白等,天然水凝胶的生物相容性及细胞亲和力较好,缺点是材料的力学性能往往欠佳;合成水凝胶包括聚丙烯酸及其衍生物、聚氧化乙烯及其衍 生共聚物、聚乙烯醇、聚磷腈和多肽等,其力学性质和加工性能比天然水凝胶有优势,但其生物相容性和细胞亲和力不如天然水凝胶。由于水凝胶具有良好的理化性质和生物相容性,已被广泛应用于组织工程领域中[10]。
细胞外基质是细胞外间质中的大分子物质,构成细胞生命活动的微环境,主要含有胶原蛋白、弹性蛋白、糖胺聚糖等。研究表明,细胞外基质影响细胞分化、增殖、黏附、形态发生和表型表达等一系列生物学过程[2]。其中GAGs在肾脏细胞外基质中扮演重要角色,其本身所带电荷能影响肾脏细胞外环境的信号传导通路,并参与构成肾小球基底膜结构,对肾脏的滤过功能有重要作用。本研究制备的肾脏脱细胞基质凝胶富含GAGs,虽然较正常组有所减少,但差异并无统计学意义,表明本方法能较好地保留GAGs。
目前脱细胞基质的研究较多,涉及各种器官和组织,以小肠黏膜脱细胞基质和膀胱脱细胞基质为热点,有些已应用于临床,但脱细胞基质制备成凝胶形式的研究较少[6]。在肾脏脱细胞基质的研究中,整体器官脱细胞是近期的焦点[11, 12],肾脏脱细胞基质凝胶的研究尚少见报道。本研究尝试将肾脏脱细胞基质制成凝胶形式,保留器官组织结构的细胞外基质结构,利用其器官本身的再生微环境,并检测其生物相容性,利用其凝胶可注射的生物学特性,并打算后续的实验中,利用注射的微创方法在动物模型上进一步验证。本课题组在后续研究中打算采用比格犬肾脏再生动物模型来验证制备的材料。
本研究成功制备出肾脏脱细胞基质凝胶,并利用肾小管上皮细胞初步验证了其生物相容性,实验结果表明经脱细胞处理的肾脏组织具有网状多孔的空间结构,保留了细胞外重要的结构分子GAGs,在肾脏脱细胞基质凝胶中的HK-2细胞呈球形生长。但该凝胶具体成分构成、力学性质,是否含有相关细胞因子,能否进行相关修饰改造,以及应用于动物实验等有待进一步研究。
| [1] | Zhang L, Wang F, Wang L, et al. Prevalence of chronic kidney disease in China: a cross-sectional survey[J]. Lancet, 2012, 379(9818): 815-822. |
| [2] | Brown B N, Badylak S F. Extracellular matrix as an inductive scaffold for functional tissue reconstruction[J]. Transl Res, 2014, 163(4): 268-285. |
| [3] | Faulk D M, Johnson S A, Zhang L, et al. Role of the extracellular matrix in whole organ engineering[J]. J Cell Physiol, 2014, 229(8): 984-989. |
| [4] | DeQuach J A, Lin J E, Cam C, et al. Injectable skeletal muscle matrix hydrogel promotes neovascularization and muscle cell infiltration in a hindlimb ischemia model[J]. Eur Cell Mater, 2012, 23: 400-412. |
| [5] | Freytes D O, Martin J, Velankar S S, et al. Preparation and rheological characterization of a gel form of the porcine urinary bladder matrix[J]. Biomaterials, 2008, 29(11): 1630-1637. |
| [6] | Sawkins M J, Bowen W, Dhadda P, et al. Hydrogels derived from demineralized and decellularized bone extracellular matrix[J]. Acta Biomater, 2013, 9(8): 7865-7873. |
| [7] | Skardal A, Smith L, Bharadwaj S, et al. Tissue specific synthetic ECM hydrogels for 3-D in vitro maintenance of hepatocyte function[J]. Biomaterials, 2012, 33(18): 4565-4575. |
| [8] | Weber M, Gonzalez-de-Torre I, Moreira R, et al. Multiple-step injection molding for fibrin-based tissue-engineered heart valves[J]. Tissue Eng Part C Methods, 2015, 21(8): 832-840. |
| [9] | Harrison R H, St-Pierre J P, Stevens M M. Tissue engineering and regenerative medicine: a year in review[J]. Tissue Eng Part B Rev, 2014, 20: 1-16. |
| [10] | Buwalda S J, Boere K W, Dijkstra P J, et al. Hydrogels in a historical perspective: from simple networks to smart materials[J]. Journal of Control Release , 2014, 190: 254-273. |
| [11] | Arenas-Herrera J E, Ko I K, Atala A, et al. Decellularization for whole organ bioengineering[J]. Biomed Mater, 2013, 8(1): 014106. |
| [12] | Orlando G, Farney A C, Iskandar S S, et al. Production and implantation of renal extracellular matrix scaffolds from porcine kidneys as a platform for renal bioengineering investigations[J]. Ann Surg, 2012, 256(2): 363-370. |



