2全军消化病研究所
2Institute of Gastroenterology, Southwest Hospital, Third Military Medical University, Chongqing, 400038, China
胆汁淤积(cholestasis)是指胆汁的生成和/或胆汁内溶质排除障碍,一些正常从胆汁中排出的物质,如胆酸、胆红素和胆固醇在血液内不断堆积,导致肝细胞的损伤而致一系列的临床症候群[1, 2],其典型特点为碱性磷酸酶的升高,随着病情的不断发展会出现肝纤维化、肝硬化最终导致肝功能衰竭[3]。近年来研究发现肝细胞膜上分布着一群与胆酸转运相关的重要的转运蛋白系统,维持着肝细胞胆酸正常的摄取和排泌功能,这些转运蛋白主要包括MRPs、OATPs、NTCP、BSEP等[4, 5, 6]。它们的异常表达可导致家族性遗传性胆汁淤积、妊娠性胆汁淤积、内毒素性胆汁淤积、Dubin-Johnson综合征、药物性肝损伤等,严重危害人类的健康。然而除梗阻性胆汁淤积可采取外科手术外,绝大多数胆汁淤积的临床治疗缺乏有效的药物。川西獐牙菜为龙胆科獐牙菜属植物,性寒味苦,大多具有清热利胆、除湿,平肝风、舒肝健胃、强心养血、解毒等作用,为我国珍贵的传统藏药,始载于藏医药书《四部医典》[7, 8],是我国治疗胆汁淤积的传统用药,但其治疗胆汁淤积的具体分子机制并未引起国内外同行的重视,临床鲜有研究。多药耐药相关蛋白3 (multidrug resistance-associated protein 3,Mrp3)和Mrp4均为位于肝细胞基底侧模的胆汁酸转运蛋白。我们及国外同行前期在动物实验和人体标本研究发现,Mrp3、Mrp4分子在胆汁淤积中对保护肝细胞起到了关键作用。在胆汁淤积的大鼠模型、梗阻性黄疸及Dubin-Johnson综合征患者的肝脏组织标本中,均发现了MRP3/Mrp3蛋白的高表达[9, 10]。而Mrp4基因敲除的大鼠胆汁淤积的模型中发现其肝损伤的程度明显严重于野生型大鼠胆汁淤积模型[11]。结合我们前期实验结果及受熊脱氧胆酸对胆汁淤积治疗的分子机制的启发,在本研究中,我们对川西獐牙菜进行提纯并用其醇提物干预大鼠模型,通过RT-qPCR、Western blot检测大鼠肝脏细胞膜转运蛋白Mrp4、Mrp3及相关核受体在mRNA和蛋白水平的表达变化,并通过免疫荧光反应在细胞水平明确Mrp3、Mrp4的变化,从而初步确定川西獐牙菜治疗胆汁淤积的分子机制,为临床治疗胆汁淤积提供新的线索并为保护祖国传统医学做贡献。
1 材料与方法 1.1 主要材料14只雄性SD大鼠,6~7周龄,体质量200~220 g,购自第三军医大学大坪医院野战外科研究所实验动物中心。川西獐牙菜醇提物由重庆市中药研究所提供,为75%乙醇提取后的浸膏,有效终浓度为50%,使用时用灭菌的生理盐水溶解。RIPA Lysis Buffer购自Sigma公司;蛋白酶抑制剂、磷酸酶抑制剂购自Roche公司;BCA蛋白定量试剂盒、Supersingnal West Femto maximum sensitivity substrate Kit购自Pierce Biotechnology公司;TRIzol购自Invitrogen公司;逆转录试剂盒、蛋白标准品购自Fermentus公司;PCR试剂盒购自TaKaRa公司;Mrp3、Mrp4、Nrf2、Lrh-1抗体购自Abcam公司;GAPDH购自Epitomics公司;山羊抗兔、兔抗山羊二抗购自Pierce公司。引物设计、合成、测序有上海吉凯基因化学技术有限公司提供。
1.2 方法 1.2.1 大鼠模型的建立及处理14只成年雄性SD大鼠,购买后在实验使用之前正常饲养1周。使用预先贴标签的方式,分为2组,具体参考文献[12]报道的方法。实验分为:①正常对照组:0.9%的生理盐水连续灌喂7 d,每天1次;②川西獐牙菜醇提物组:川西獐牙菜醇提物100 mg/kg溶于0.9%的生理盐水,连续灌喂7 d,每天1次。7 d后处死大鼠,收集血清、肝脏组织、肾脏组织,-80 ℃保存,备用。
1.2.2 免疫荧光反应将新鲜肝组织用OCT包埋后制作成6~8 μm冰冻切片。冰丙酮固定30 min。PBS漂洗3次,0.4%Triton X-100/0.01 mol/L PBS浸泡30 min。PBS漂洗3次,加山羊血清封闭30 min。PBS漂洗后,加入Mrp3 1 ∶100、Mrp4 1 ∶150抗体染片,4 ℃过夜。后加入FITC标记的相对应的荧光二抗,37 ℃ 孵育60 min。中性树胶封片后镜检。
1.2.3 蛋白免疫印迹参照文献[13]报道的方法提取大鼠肝脏蛋白,BCA法进行蛋白定量,进行5%的浓缩胶和10%的分离胶SDS-PAGE电泳,每孔上样量 为80 μg总蛋白。浓缩胶60 V电泳1 h,分离胶100 V电泳2 h,常规湿法转膜80 min,含5%脱脂奶粉的TBST室温封闭2 h,加一抗(Mrp4 1 ∶1 000,Mrp3 1 ∶1 000,Nrf2 1 ∶2 500,GAPDH 1 ∶50 000),4 ℃孵育过夜,用TBST洗去一抗后加入相应的二抗(1 ∶50 000),室温孵育1 h。ECL化学发光,凝胶成像系统显影。
1.2.4 RT-qPCR参照文献[14]报道的方法提取肝脏组织RNA。将其逆转录为cDNA后进行RT-qPCR扩增。PCR反应体系:25 μL体系中上游和下游引物各1 μL(10 μmol/L)、模板cDNA 1 μg、2×Taq polymerase 12.5 μL、ddH2O 9.5 μL,反应条件:94 ℃ 5 min,94 ℃ 30 s、55 ℃ 30 s、72 ℃ 2 min 30个循环,72 ℃ 10 min。引物序列如表 1。
| 大鼠基因 | 引物 | 序列(5′→3′) | 长度(bp) |
| Mrp3 | 上游 | CGGCGACACAGACTAAAGAGACT | 139 |
| 下游 | GCATACAGGAGGCAGATAAACAGC | ||
| Mrp4 | 上游 | AGAAGCCGCTGCCCTCACTG | 296 |
| 下游 | AATGCCTTCGGAACGGACTTGAC | ||
| Nrf2 | 上游 | CTTTTGGCGAGACATTCCC | 151 |
| 下游 | GACTGGGCTCTCGATGTGAC | ||
| Lrh-1 | 上游 | ATGGGAAGGAAGGGACAATC | 166 |
| 下游 | CAAACCTGAAGGGAACGGAGGC | ||
| GAPDH | 上游 | ACAGCAACAGGGTGGTGGAC | 252 |
| 下游 | TTTGAGGGTGCAGAGAACTT |
应用SPSS 17.0软件进行统计学分析。线性回归分析,计量资料采用x±s表示。
2 结果 2.1 川西獐牙菜醇提物上调正常大鼠肝细胞膜表面胆汁酸转运蛋白Mrp4、Mrp3的表达川西獐牙菜醇提物连续灌喂大鼠7 d,取肝脏组织标本,提取肝脏组织样本RNA和蛋白,检测Mrp4、Mrp3在mRNA和蛋白水平的表达变化,结果发现:在mRNA水平,与正常对照组相较,Mrp4、Mrp3表达明显增高,统计学分析显示:Mrp4表达增高2.1倍,Mrp3表达增高1.7倍,结果显著,具有统计学意义(图 1);在蛋白水平,川西獐牙菜组Mrp4、Mrp3表达亦增高,其中Mrp4表达增高2.5倍,Mrp3表达增高3.0倍,结果显著,具有统计学意义(图 2)。石蜡包埋后做免疫荧光反应,结果发现:川西獐牙菜醇提物组其样本Mrp4、Mrp3的表达明显强于正常对照组(图 3)。以上结果表明:川西獐牙菜醇提物能够刺激肝细胞表面膜转运蛋白Mrp4、Mrp3使其表达增高。
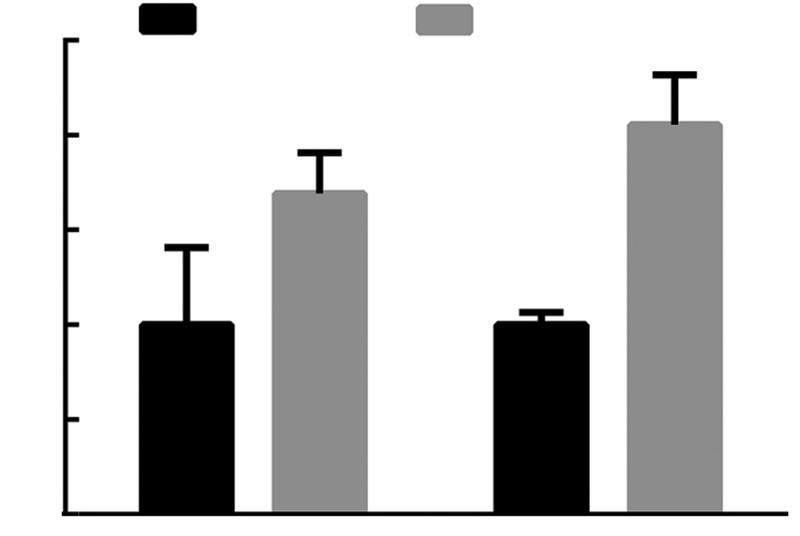 |
| a:P<0.05,b: P<0.01,与正常对照组比较图 1 川西獐牙菜醇提物刺激正常大鼠后Mrp4、Mrp3在mRNA水平的表达情况 |
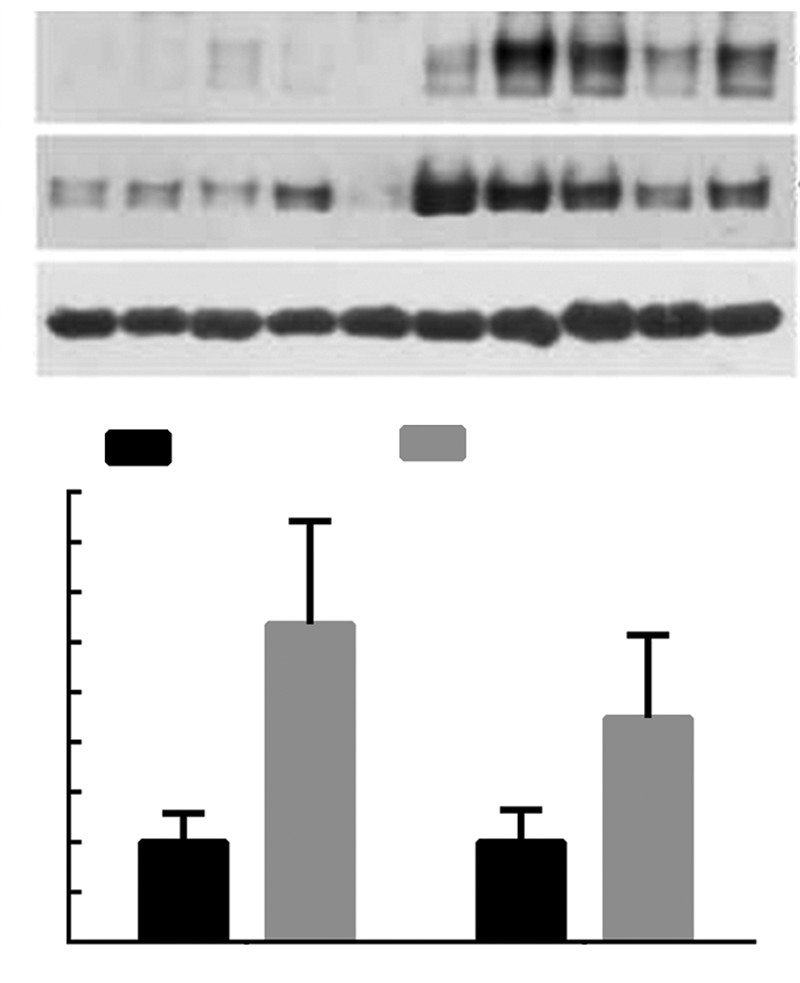 |
| A: Western blot检测结果;B: 半定量分析结果 a:P<0.05,b:P<0.01,与正常对照组比较图 2 Western blot检测川西獐牙菜醇提物刺激正常大鼠后Mrp4、Mrp3蛋白水平的表达 |
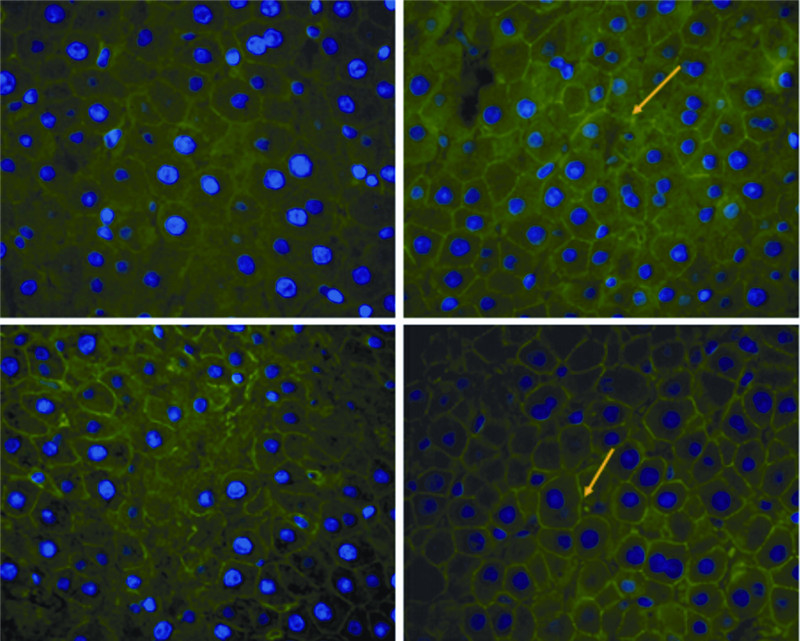 |
| 黄色箭头示Mrp3、Mrp4表达图 3 免疫荧光观察川西獐牙菜醇提物刺激肝细胞表面膜转运蛋白Mrp4、Mrp3的表达(×400) |
RT-qPCR检测结果显示:与正常对照组相比,川西獐牙菜醇提物组Nrf2和Lrh-1表达显著增高,其中Nrf2表达增高1.8倍,Lrh-1表达增高1.4倍(图 4);同时,蛋白免疫印迹实验证实:在蛋白水平,与正常对照组相比,川西獐牙菜醇提物组Nrf2表达增高2.3倍,Lrh-1表达增高1.3倍,结果显著,具有统计学意义(图 5)。
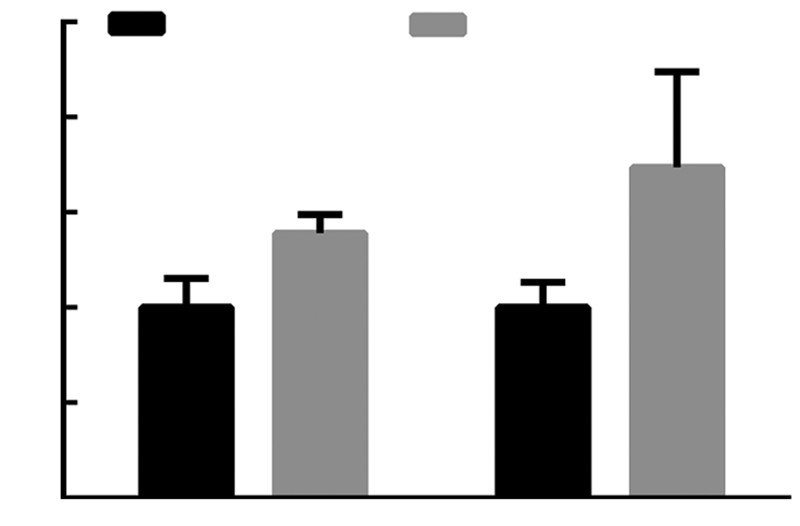 |
| a:P<0.05,与正常对照组比较图 4 RT-qPCR检测川西獐牙菜醇提物刺激正常大鼠后Lrh-1、Nrf2 的mRNA水平表达 |
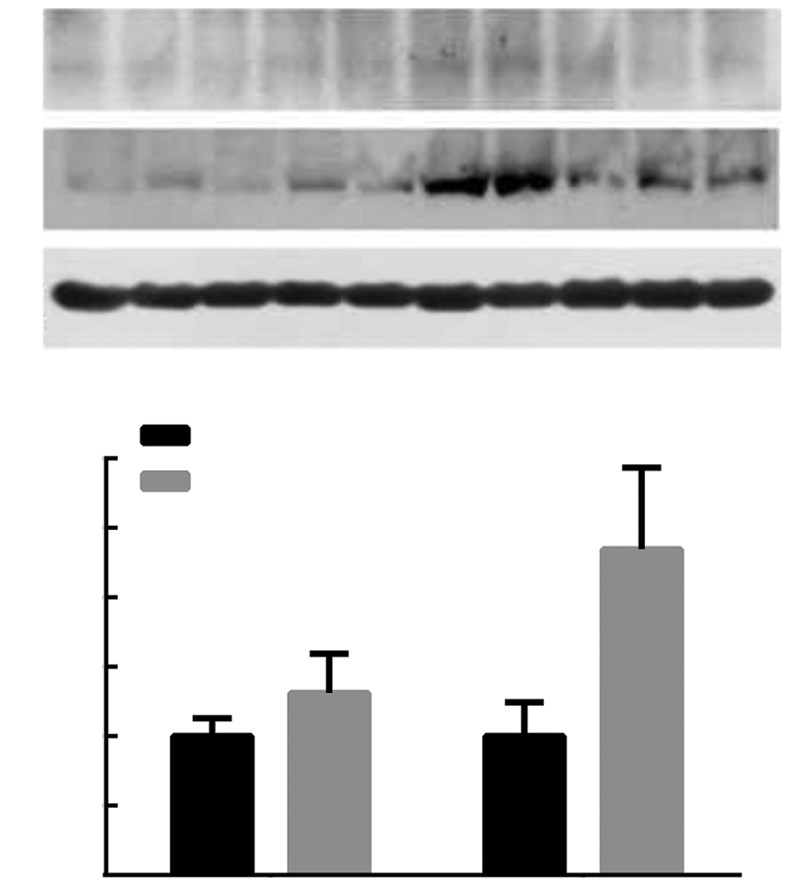 |
| A: Western blot检测结果;B:半定量分析结果 a:P<0.05,b:P<0.01,与正常对照组比较图 5 Western blot检测川西獐牙菜醇提物刺激正常大鼠后Lrh-1、Nrf2蛋白水平的表达 |
无论在蛋白水平还是mRNA水平,川西獐牙菜醇提物均能刺激肝细胞膜表面胆汁酸转运蛋白Mrp4、Mrp3核受体Lrh-1、转录因子Nrf2,使其表达增高。经 线性回归分析发现:川西獐牙菜醇提物刺激Nrf2表达 上调与Mrp4表达增高呈正相关(r2=0.694,P=0.019),而与Mrp3无关(r2=0.048,P=0.636)。
3 讨论胆汁淤积是多种疾病所引起的常见临床综合征,直接导致肝细胞损伤、肝功能衰竭[15]。但其临床治疗缺乏有效的药物,唯一应用于临床并得到广泛认可的UDCA副作用大且个体差异显著,INT747、GW4064等FXR的激动剂尚处于临床试验阶段,因此,寻找治疗胆汁淤积的特效药物成为临床亟待解决的问题。川西獐牙菜是我国的传统藏药,长年生长于海拔3 800~5 000 m 的高寒地区,全草入药,具有清热、利胆退黄之功效[16],能够促进肝细胞再生、降低谷丙转氨酶的功效,且无毒副作用,用药范围广,疗效显著,具有极大地开发利用价值。其主要成分有龙胆苦苷、獐牙菜苦苷、芒果苷、齐墩果酸、当药醇苷[17]等,由于受到产地、加工方法、用药途径的影响,使得其药理机制非常复杂。目前,临床对其“利胆退黄”的分子机制并不清楚,这就很大程度地限制了胆汁淤积治疗的用药。因此,研究川西獐牙菜治疗胆汁淤积的分子机制十分重要,所以,我们首先对其醇提物进行研究,在动物水平寻找其减轻胆汁淤积的具体分子机制,同时也为进一步研究其单体成分,寻找更加单一有效地治疗胆汁淤积的药物作用靶点提供依据。
目前,关于胆汁淤积发病机制的研究有很多,绝大部分研究认为:肝细胞表面胆汁酸转运蛋白的异常表达是引起胆汁淤积的主要分子发生机制[4, 5, 6]。Mrp4广泛分布在机体的各个组织器官,包括脑、肝脏、胰腺、肾脏、红细胞等细胞表面等[18],属于MRPs家族,是不依赖ATP的有机阴离子转运体。与Mrp3相似,在胆汁淤积时Mrp4表达的上调被看作是肝细胞对阻塞性胆汁淤积的适应性反应,以保护肝细胞自身不受胆汁酸毒性的损害,使更多的胆汁酸分泌入血液。受UDCA、INT747及GW4064等药物治疗胆汁淤积的机制的启发,我们认为,川西獐牙菜的“利胆退黄”作用也与肝细胞表面胆汁酸转运蛋白密切相关且离不开转录因子、核受体的调节。因此,本研究对川西獐牙菜进行醇提,将川西獐牙菜醇提物连续灌喂大鼠7 d后,取其肝脏组织进行研究,发现:不论在mRNA水平还是蛋白水平,川西獐牙菜醇提物灌喂大鼠后,其肝细胞表面Mrp4、Mrp3及转录因子Nrf2、核受体Lrh-1表达均增高,经过线性回归分析发现,转录因子Nrf2的表达上调与胆汁酸转运蛋白Mrp4增高呈正相关。由此,我们初步确定:川西獐牙菜能够通过转录因子Nrf2调控胆汁酸转运蛋白Mrp4从而对肝脏产生影响。以期为后续研究川西獐牙菜在胆汁淤积时的作用和功能奠定基础,同时也对保护祖国传统医药及自主知识产权做出贡献。
| [1] | Pauli-Magnus C, Meier P J. Hepatocellular transporters and cholestasis[J]. J Clin Gastroenterol, 2005, 39(4 Suppl 2): S103-S110. |
| [2] | Padda M S, Sanchez M, Akhtar A J, et al. Drug-induced cholestasis[J]. Hepatology, 2011, 53(4): 1377-1387. |
| [3] | Wagner M, Zollner G, Trauner M. Nuclear receptors in liver disease[J]. Hepatology, 2011, 53(3): 1023-1034. |
| [4] | Traauner M, Boyer J L. Cholestatic syndromes[J]. Curr Opin Gastroenterol, 2002, 18(3): 314-329. |
| [5] | Chiang J Y. Bile acids: regulation of synthesis[J]. J Lipid Res, 2009, 50(10): 1955-1966. |
| [6] | Claudel T, Zollner G, Wagner M, et al. Role of nuclear receptors for bile acid metabolism, bile secretion, cholestasis, and gallstone disease[J]. Biochim Biophys Acta, 2011, 1812(8): 867-878. |
| [7] | 徐敏. 藏药川西獐牙菜抗小鼠免疫性肝损伤的研究[J]. 西北农林科技大学学报: 自然科学版, 2013, 41(5): 32-36. |
| [8] | 游海青. 川西獐牙菜对小鼠肝损伤的治疗作用[J]. 家庭医药: 医药论坛, 2010, 2(9): 617-619, 616. |
| [9] | 刘畅, 李绍雪, 高宇, 等. 川西獐牙菜醇提物上调HepG2细胞膜转运蛋白MRP3、核转录因子SP1及核受体CPF、PXR表达[J]. 第三军医大学学报, 2014, 36(10): 1008-1011. |
| [10] | Chai J, He Y, Cai S Y, et al. Elevated hepatic multidrug resistance-associated protein 3/ATP-binding cassette subfamily C 3 expression in human obstructive cholestasis is mediated through tumor necrosis factor alpha and c-Jun NH2-terminal kinase/stress-activated protein kinase-signaling pathway[J]. Hepatology, 2012, 55(5): 1485-1494. |
| [11] | Chai J1, Luo D, Wu X, et al. Changes of organic anion transporter MRP4 and related nuclear receptors in human obstructive cholestasis[J]. J Gastrointest Surg, 2011, 15(6): 996-1004. |
| [12] | 张樑君, 李绍雪, 封欣婵, 等. 川西獐牙菜单体齐墩果酸对胆道结扎所致大鼠胆汁淤积性肝损伤的保护作用[J]. 第三军医大学学报, 2015,37(8): 778-781. |
| [13] | 封欣婵, 柴进, 程英, 等. Radixin定点突变过表达对HepG2细胞膜转运蛋白Bsep的影响[J]. 第三军医大学学报, 2014, 36(10): 1002-1007. |
| [14] | 何孝崇, 柴进, 何宇, 等. 阻塞性肝胆汁淤积下转录因子NR5A2和SP1、胆酸转运蛋白MRP3与肝脏损伤的相关性[J]. 第三军医大学学报, 2012, 34(24): 2474-2478. |
| [15] | Sampath J, Adachi M, Hatse S, et al. Role of MRP4 and MRP5 in biology and chemotherapy[J]. AAPS PharmSci, 2002, 4(3): E14. |
| [16] | 高宇, 柴进, 李绍雪, 等. 川西獐牙菜醇提物对内毒素所致的大鼠胆汁淤积性肝损伤的保护作用[J]. 第三军医大学学报, 2014, 36(8): 769-773. |
| [17] | 杨慧玲, 刘建全. 9种"藏茵陈"原植物中的7种有效化学成分研究[J]. 中草药, 2005, 36(8): 1233-1237. |
| [18] | Aleksunes L M, Klaassen C D. Coordinated regulation of hepatic phase Ⅰ and Ⅱ drug-metabolizing genes and transporters using AhR-, CAR-, PXR-, PPARα-, and Nrf2-null mice[J]. Drug Metab Dispos, 2012, 40(7): 1366-1379. |



