2. 400038 重庆,第三军医大学西南医院骨科
2. Department of Orthopedics, Southwest Hospital, Third Military Medical University, Chongqing, 400038, China
种子细胞的成骨活性在一定程度上决定骨修复能力。间充质干细胞(mesenchymal stem cells,MSCs),具有多向分化潜能[1],是目前骨组织工程(tissue engineering bone,TEB)理想种子细胞。MSCs来源多种多样[2],较为常见的是骨髓、脐带、脂肪。但存在以下问题:随着年龄的老化,干细胞数目显著降低、增殖分化能力大幅度衰退;取材有创,供区有限,不易于大规模获取以及异体移植引起免疫反应等。虽然骨髓及脂肪来源的MSCs可以自体移植,但是在TEB的构建过程中,所需种子细胞的数量较大(约为4×106/cm3),且骨科手术植骨量巨大,那么所需种子细胞量也非常大。所以选择合适的、可大量获取的种子细胞已经成为TEB产业化的瓶颈问题。
脐带中许多部位可以分离出人脐带间充质干细胞(human umbilical cord mesenchymal stem cells,hUC-MSCs),从脐带血中分离MSCs目前还存在着很多争论[3, 4]。文献[5, 6]报道从脐带组织中分离出MSCs的成功率几乎达到100%,根据提取方法和提取部位不同,可分离出来不同部位MSCs[7, 8, 9, 10, 11]。这些细胞主要表现出类似于骨髓来源的MSCs,并且展现自己独有的特点:都表达间充质干细胞的表面标记,表达更原始的表面分子如胚胎转录因子Nanog、Oct-4和Sox-2等[12, 13],并且表达人类白细胞抗原DR的水平较骨髓源MSCs低,它们的倍增时间,和维持干性的时间明显较骨髓源MSCs要高[14],获取的细胞出现成纤维样集落频率要远高于骨髓源MSCs[6, 8]。
目前用来分离hUC-MSCs主要有酶消化法和组织块培养法。酶消化法有应用胶原酶的基础上应用或不用胰蛋白酶和玻璃酸酶[13, 15]。但是酶消化法有致命的缺点即损伤细胞,破坏细胞的表面标记和功能[16, 17]。为了避免酶消化法的弊端,开始研究脐带组织块培养方法[18, 19]。这种方法较酶消化法操作统一、简单可控、成功率高、可重复,并且获取数量较多,但组织块培养法培养时间较长,且因组织块无法牢固贴壁而至大部分不能分离出细胞,使其分离率较低,且标本容易污染。为提高组织块利用率及原代MSCs的数量,本研究设计组织块培养皿帮助Wharton’s jelly贴壁的新分离方法,旨在为骨组织工程获取大量种子细胞奠定基础。
1 材料与方法 1.1 脐带横断面组织结构脐带来源于济南军区总医院妇产科,经济南军区总医院伦理委员会批准,所有提供脐带者签署知情同意书。无菌切取足月剖宫产脐带组织15 cm,然后锐性分离成5 cm长两段,0.5 cm左右长3段。将5 cm长的脐带放置到4℃的无菌DMEM/F12培养基中,备分离细胞用;将0.5 cm左右脐带放置到4%的多聚甲醛固定液中固定24 h以上,行横断面的HE染色。
1.2 脐带组织的处理与组织块接种分离过程保持无菌操作,取培养基中5 cm长的脐带组织,20 mL针管及PBS溶液反复冲洗管腔及血管,直到冲洗液清澈。眼科剪纵行剖开脐带,有齿镊将血管、尿管、管周及内外膜组织钝性撕掉,小血管借助于双目镜(图1)。剩余组织为Wharton’s jelly,5 cm长 脐带大约2 500 mg。将Wharton’s jelly 剪碎到1 mm×1 mm×2 mm大小的组织块,PBS反复冲洗,450×g,4 ℃,离心10 min,丢弃离心管下面的红细胞等杂质细胞,然后加入PBS溶液过200钼,进一步去除脐带血中细胞,重复3次。将组织块间距1 cm左右接种到组织块培养皿中,90 mm培养皿接种50块(图1)。滴加少许培养液(DMEM/F12,10%的胎牛血清,100 U/mL青链霉素)保持组织块湿润后,将培养皿放置到37 ℃,5% CO2的孵箱中孵育4 h。4 h后培养皿中加入8 mL普通培养基。采用普通培养皿(购自美国Corning公司),接种密度同组织块培养皿,采用孵箱静置2 h后,再反置2 h加培养基。两组均采用2 d换液1次,观察漂浮组织块的个数及组织块培养成功数(组织块周边有细胞游出),10 d传代时对细胞进行计数。
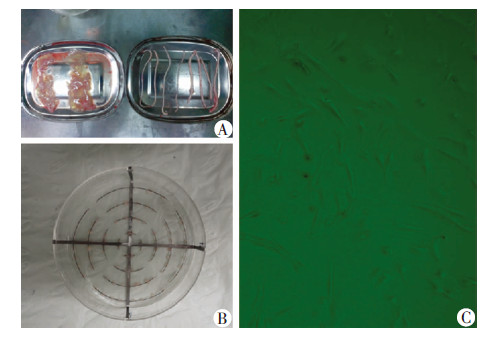 |
| A:Wharton’s jelly分离;B:组织块培养皿及组织块的接种;C:分离的原代hUC-MSCs(×40) 图 1 脐带间充质干细胞的分离 |
将组织块培养皿获取的细胞进行传代培养,用P3细胞制成细胞悬液,细胞计数后用适当的培养液重悬细胞,浓度为1×107个/mL。分装为100 μL,采用直接标记的一抗,分别加入CD44、CD73、CD90、CD105、CD34、CD45/FITC抗体(1 μg/106细胞)冰上孵育10 min,上机检测(抗体购自美国Sigma公司)。
1.4 分离细胞多向分化能力鉴定hUC-MSCs有着向间质细胞进行多向分化的潜能,为鉴定证明收获的细胞,对P3进行成骨、成软骨、成脂诱导分化,取P3细胞按照5 000/cm2接种到6孔培养皿中,按照HyClone公司三系诱导液说明书进行更换液体,21 d后4%多聚甲醛固定培养皿中的细胞,行茜素红、油红O、甲苯胺蓝染色。
1.5 构建组织工程骨的黏附率骨松质来源于济南军区总医院,经济南军区总医院伦理委员会批准,选取无疾病的捐献者股骨下端,经脱脂、脱蛋白及脱钙处理即脱钙骨基质(demineralized bone matrix,DBM),无菌辐照消毒。使用前DMEM/F12培养基反复浸泡骨块,直到浸泡液不变色。取出后放置到6孔培养板中,保持无菌状态使其稍干燥,将 获取的hUC-MSCs制成1×107个/mL细胞悬液,100 μL 正面接种到10 mm×10 mm×5 mm骨块上,37 ℃,5% CO2的孵箱中静置2 h,翻转后同量接种及静置2 h。转移到新6孔培养板中,添加培养基。消化原培养板中细胞并计数,计算细胞上架率(X)。
X=(接种前细胞-剩余细胞)/接种前细胞。
1.6 hUC-MSCs体外构建组织工程骨的检测构建的组织工程骨体外培养5、8 d后,行激光共聚焦显微镜观察,简单步骤如下:用PBS液漂洗体后4%多聚甲醛固定,加入罗丹明(Rhodamine)标记的鬼笔环肽(Phalloidin)工作液(1 ∶10),室温下反应中60 min,DAPI染色20 min,脱脂牛奶封片,植入少量PBS液体中,上机观察。取同样培养5、8 d的TEB,提取蛋白并检测TEB中蛋白水平:将2块DBM+hUC-MSCs约1 cm3大小的TEB剪刀锐性剪碎,加液氮及10 mg 聚乙烯比咯烷酮(PVP)研磨,加入1.5 mL的提取液在-20 ℃条件下过夜,4 ℃ 8 000 r/min,离心弃上清,加入相等体积的冰浴丙酮,含0.07%的β-硫基乙醇,摇匀后离心,真空干燥沉淀备用,上样前加入裂解液,室温放置30 min,使蛋白充分溶解于液体中,然后离心,15 ℃ 8 000 r/min。Brandford进行定量蛋白质,测定其光密度值,计算出浓度。
1.7 统计学处理采用SPSS 13.0统计软件,计数资料以 x±s表示,两组之间比较采用student’s t检验。
2 结果 2.1 脐带组织中MSCs分布通过HE染色我们可以大体了解脐带的组织结构,在脐带的横断面中(图2A),首先外周一圈是脐带的 外膜,与外膜相连的是Wharton’s jelly,在Wharton’s jelly中分布着主要的3根大血管,即脐带的动静脉,还散在一些小血管。在Wharton’s jelly中(图2B),可以观察到组织较为松散。
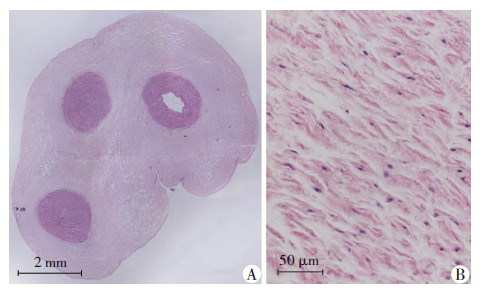 |
| A:脐带组织的横截面;B:放大后的Wharton’s jelly图 2 HE染色观察脐带组织的结构 |
记录每次换液时组织块漂浮数,在培养12 d时实验组无组织块漂浮,而对照组共有13块组织漂浮。2组细胞游出的组织块有统计学差异[(86.0±2.7)% vs(44 ±4)%,P<0.01]。在12 d将组织块移开进行细胞传代,实验组与对照组原代细胞数有统计学差异[(24.7×104 ± 3.6×104)vs(5.1×104±1.0×104),P<0.01]。
2.3 hUC-MSCs的鉴定及多向分化潜能P3细胞阳性表达CD44+、CD73+、CD90+、CD105+,阴性表达CD34+、CD45+,经鉴定获取细胞为hUC-MSCs(图3)。细胞诱导21 d后分别行茜素红、油红O、甲苯胺蓝染色,结果显示获取的细胞被诱导后,可分化为成骨细胞、脂肪细胞、软骨细胞,证明其具有多向分化潜能(图4)。
 |
| A:CD73;B:CD90;C:CD105;D:CD44;E:CD34;F:CD45图 3 脐带间充质干细胞的鉴定 |
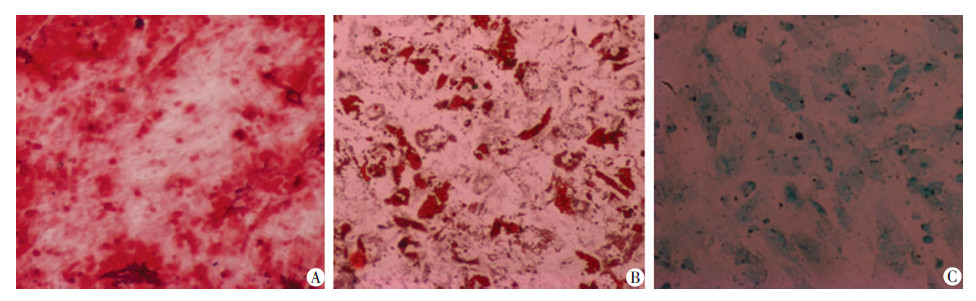 |
| 图 4 诱导后茜素红(A)、油红O(B)、甲苯胺蓝(C)染色证明hUC-MSCs具有多向分化潜能 (×100) |
构建后的组织工程骨移出后,将剩余培养板中的细胞计数,应用公式计算细胞在DBM上的黏附率为(81.3±4.7)%。在荧光显微镜下可以观察到红色代 表细胞骨架,分布在DBM表面,蓝染的细胞核镶嵌在红色的细胞骨架中,呈不规则扁平状,胞质舒展,并随时间而增殖(图5)。以上实验结果表明TEB构建成功,细胞与DBM相容性好,大量增殖,爬满支架材料的表面。
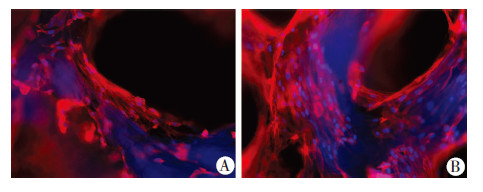 |
| A:培养5 d;B:培养8 d图 5 激光共聚焦显微镜观察脐带间充质干细胞构建的组织工程骨结构 (DAPI ×100) |
2块DBM骨体积为1 cm3,经过蛋白提取液提取,最后形成200 μL提取液,经过Brandford检测后其浓度,总蛋白的浓度随着培养时间的增加而逐步升高(图6)。
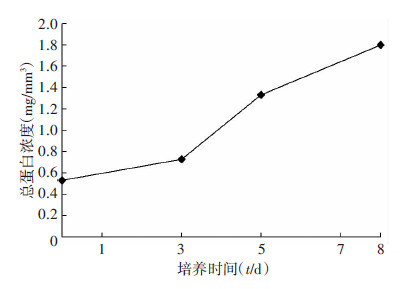 |
| 图 6 组织工程骨总蛋白含量 |
从脐带Wharton’s jelly中分离UC-MSCs是一个复杂的过程,目前有许多方案被证明可以快速分离出大量的细胞。主要有酶消化、组织块培养两种不同的方法,最近,文献[19]报道建议用0.2%的胶原酶在37 ℃消化16~20 h是一种非常简单和有效的方法。但是一些研究也发现酶消化法可以影响细胞的表征和功能,于是进行组织块培养法的研究,不是通过酶消化而是通过MSCs的塑料吸附性使其迁移到培养皿中[16, 18]。Hua等[20]最近比较3种组织块及3种酶消化中原代细胞培养时间、细胞数量、细胞形态、免疫表型、及分化潜能,其结论是组织块法均优于酶消化法。
在TEB中能够及时获取大量高质量种子细胞是关键也是难点,既需要取材广泛,又需要简易高效,并且培养过程能够规模化及质控化。这正是目前组织块法从脐带组织分离细胞所不具备的。首先在脐带横截面的HE染色中,可以观察到脐带组织中分布着各种各样的组织,有动静脉、尿管、内膜、羊膜及周围的Wharton’s jelly。文献[9]报道UC-MSCs分布在Wharton’s jelly中,内皮细胞分布在血管内膜,所以需要将细胞间连接较致密的外膜、羊膜、动静脉、尿管撕掉。这样做一是便于细胞游出,二是可以去除杂质细胞如内皮细胞、肌细胞等。
要保证组织块顺利的、尽早的游离出细胞,使其牢固贴壁至关重要[21],间充质干细胞有塑料吸附性[22, 23],所以牢固贴壁后的吸附力则可能成为其游出的动力。而普通培养方法则贴壁比较困难,培养液的冲击力、浮力,操作及观察时的晃动都影响其贴壁,导致普通培养法有13块漂浮[17, 24]。而本研究的组织块培养皿采用重力的作用促使所有的组织块贴壁,卡槽的形式克服移动、换液时组织块的漂浮。组织块培养皿牢固的贴壁保证细胞顺利的游出,在实验组有86%的组织块培养出细胞,而对照组仅为44%,在10 d传代时,实验组收获的细胞数大约为对照组4.6倍。为尽可能的获取间充质干细胞,我们对组织块进行反复的培养,采用组织块培养皿只要整体移动培养支架即可,不仅收获更多细胞,而且可以简化操作步骤,减少标本污染发生率。从第2次培养开始,细胞游出时间缩短到5 d左右,可能是由于细胞已经游离到组织块四周的原因。本实验证明hUC-MSCs表达MSCs的经典表面分子且具有多向分化潜能。
在体外构建的TEB中,通过5 d及8 d培养观察发现细胞生长良好,胞浆舒展,组织相容性好,总蛋白随着时间的增长而增长,说明细胞在DBM支架材料上进行增殖。组织工程骨有着良好的骨修复效果,很多文献均有报道。TEB的生物活性在一定程度上决定着骨组织的修复效果,以细胞为中心构建的组织工程骨取决于细胞的活性,即细胞的增殖、分化能力。文献[25]证明脐带MSCs接种7 d后增殖能力明显强于牙髓来源的MSCs。并且细胞倍增时间是22.23 h,而牙 髓来源的是27.51 h。与BMSCs相比,Abu-Kasim等[26] 发现WJ-MSCs在早期的几代增长速度明显要快,倍增时间分别是24 h和40 h,脐带和牙髓的增长速度明显快于骨髓和脂肪来源的;并且脐带来源的MSCs比骨髓来源的更容易形成集落,而一般认为集落形成主要是依靠细胞的数量[27]。最近的一项研究表明脐带和脂肪来源的MSCs在体外长期扩增时,脐带来源的MSCs有着很高的分离率并且保持一个稳定的高增殖能力,而脂肪来源的分化能力下降,并且早期的几代就检测到细胞凋亡标记[28]。所以以脐带间充质干细胞为中心构建的组织工程的效果是值得期待的。
组织块培养皿可以简化、规范操作过程,提高组织块的利用率,获取大量细胞(提高15~20倍),根据ISCT标准鉴定,是我们所需要的hUC-MSCs。这在一定程度上缓解种子细胞的来源问题,为TEB的产业化奠定基础。虽然这种培养系统为TEB的大规模构建提供了更多的期待,但是多次培养后的细胞体内安全性问题需要进一步研究。
| [1] | Bianco P, Cao X, Frenette P S, et al. The meaning, the sense and the significance: translating the science of mesenchymal stem cells into medicine [J]. Nat Med, 2013, 19(1): 35-42. |
| [2] | Chamberlain G, Fox J, Ashton B, et al. Concise review: mesenchymal stem cells: their phenotype, differentiation capacity, immunological features, and potential for homing[J]. Stem Cells, 2007, 25(11): 2739-2749. |
| [3] | Lee O K, Kuo T K, Chen W M, et al. Isolation of multipotent mesenchymal stem cells from umbilical cord blood[J]. Blood, 2004, 103(5): 1669-1675. |
| [4] | Mareschi K, Biasin E, Piacibello W, et al. Isolation of human mesenchymal stem cells: bone marrow versus umbilical cord blood[J]. Haematologica, 2001, 86(10): 1099-1100. |
| [5] | Zeddou M, Briquet A, Relic B, et al. The umbilical cord matrix is a better source of mesenchymal stem cells (MSC) than the umbilical cord blood[J]. Cell Biol Int, 2010, 34(7): 693-701. |
| [6] | Fong C Y, Subramanian A, Biswas A, et al. Derivation efficiency, cell proliferation, freeze-thaw survival, stem-cell properties and differentiation of human Wharton’s jelly stem cells[J]. Reprod Biomed Online, 2010, 21(3): 391-401. |
| [7] | Karahuseyinoglu S, Cinar O, Kilic E, et al. Biology of stem cells in human umbilical cord stroma: in situ and in vitro surveys[J]. Stem Cells, 2007, 25(2): 319-331. |
| [8] | Sarugaser R, Lickorish D, Baksh D, et al. Human umbilical cord perivascular (HUCPV) cells: a source of mesenchymal progenitors[J]. Stem Cells, 2005, 23(2): 220-229. |
| [9] | Fong C Y, Richards M, Manasi N, et al. Comparative growth behaviour and characterization of stem cells from human Wharton’s jelly[J]. Reprod Biomed Online, 2007, 15(6): 708-718. |
| [10] | Kita K, Gauglitz G G, Phan T T, et al. Isolation and characterization of mesenchymal stem cells from the sub-amniotic human umbilical cord lining membrane[J]. Stem Cells Dev, 2010, 19(4): 491-502. |
| [11] | Gonzalez R, Griparic L, Umana M, et al. An efficient approach to isolation and characterization of pre- and postnatal umbilical cord lining stem cells for clinical applications[J]. Cell Transplant, 2010, 19(11): 1439-1449. |
| [12] | Montanucci P, Basta G, Pescara T, et al. New simple and rapid method for purification of mesenchymal stem cells from the human umbilical cord Wharton jelly[J]. Tissue Eng Part A, 2011, 17(21/22): 2651-2661. |
| [13] | Tong C K, Vellasamy S, Tan B C, et al. Generation of mesenchymal stem cell from human umbilical cord tissue using a combination enzymatic and mechanical disassociation method[J]. Cell Biol Int, 2011, 35(3): 221-226. |
| [14] | Lu L L, Liu Y J, Yang S G, et al. Isolation and characterization of human umbilical cord mesenchymal stem cells with hematopoiesis-supportive function and other potentials[J]. Haematologica, 2006, 91(8): 1017-1026. |
| [15] | Wang H S, Hung S C, Peng S T, et al. Mesenchymal stem cells in the Wharton’s jelly of the human umbilical cord[J]. Stem Cells, 2004, 22(7): 1330-1337. |
| [16] | Majore I, Moretti P, Stahl F, et al. Growth and differentiation properties of mesenchymal stromal cell populations derived from whole human umbilical cord[J]. Stem Cell Rev, 2011, 7(1): 17-31. |
| [17] | Ishige I, Nagamura-Inoue T, Honda M J, et al. Comparison of mesenchymal stem cells derived from arterial, venous, and Wharton’s jelly explants of human umbilical cord[J]. Int J Hematol, 2009, 90(2): 261-269. |
| [18] | Xu Y, Meng H, Li C, et al. Umbilical cord-derived mesenchymal stem cells isolated by a novel explantation technique can differentiate into functional endothelial cells and promote revascularization[J]. Stem Cells Dev, 2010, 19(10): 1511-1522. |
| [19] | Petsa A, Gargani S, Felesakis A, et al. Effectiveness of protocol for the isolation of Wharton’s Jelly stem cells in large-scale applications[J]. In Vitro Cell Dev Biol Anim, 2009, 45(10): 573-576. |
| [20] | Hua J, Gong J, Meng H, et al. Comparison of different methods for the isolation of mesenchymal stem cells from umbilical cord matrix: proliferation and multilineage differentiation as compared to mesenchymal stem cells from umbilical cord blood and bone marrow[J]. Cell Biol Int, 2014, 38(2): 198-210. |
| [21] | Pincock S. Anthony Atala: at the cutting edge of regenerative surgery[J]. Lancet, 2011, 378(9800): 1371. |
| [22] | Lushaj E B, Anstadt E, Haworth R, et al. Mesenchymal stromal cells are present in the heart and promote growth of adult stem cells in vitro[J]. Cytotherapy, 2011, 13(4): 400-406. |
| [23] | De-Bruyn C, Najar M, Raicevic G, et al. A rapid, simple, and reproducible method for the isolation of mesenchymal stromal cells from Wharton’s jelly without enzymatic treatment[J]. Stem Cells Dev, 2011, 20(3): 547-557. |
| [24] | Azari O, Babaei H, Derakhshanfar A, et al. Effects of transplanted mesenchymal stem cells isolated from Wharton’s jelly of caprine umbilical cord on cutaneous wound healing; histopathological evaluation[J]. Vet Res Commun, 2011, 35(4): 211-222. |
| [25] | Yu S, Long J, Yu J, et al. Analysis of differentiation potentials and gene expression profiles of mesenchymal stem cells derived from periodontal ligament and Wharton’s jelly of the umbilical cord[J]. Cells Tissues Organs, 2013, 197(3): 209-223. |
| [26] | Abu-Kasim N H, Govindasamy V, Gnanasegaran N, et al. Unique molecular signatures influencing the biological function and fate of post-natal stem cells isolated from different sources[J]. J Tissue Eng Regen Med, 2012, doi: 10.1002/term.1663. [Epub ahead of print]. |
| [27] | Troyer D L, Weiss M L. Wharton’s jelly-derived cells are a primitive stromal cell population[J]. Stem Cells, 2008, 26(3): 591-599. |
| [28] | Christodoulou I, Kolisis F N, Papaevangeliou D, et al. Comparative Evaluation of Human Mesenchymal Stem Cells of Fetal (Wharton’s Jelly) and Adult (Adipose Tissue) Origin during Prolonged In Vitro Expansion: Considerations for Cytotherapy[J]. Stem Cells Intm, 2013, 2013: 246134. |



