日本学者与我们的前期研究显示,糖皮质激素能有效阻止乙型肝炎病毒(hepatitis B virus,HBV)相关急性肝衰竭的发生,但其确切机制尚未阐明[1,2]。免疫和炎症反应介导的肝细胞损伤与肝细胞保护是决定肝细胞存活与死亡的两个关键环节。由此推测,抑制过强的免疫应答与炎症反应和增强肝细胞保护功能是阻止肝细胞死亡与HBV相关肝衰竭发生的2个关键环节,同时也可能是糖皮质激素阻止急性肝衰竭发生的关键机制。然而,同样能抑制过强免疫应答与炎症反应的环孢素A不仅不能有效阻止急性肝衰竭的发生,反而具有明显的肝细胞毒性,提示不能完全用抑制免疫应答与炎症反应的机制来解释糖皮质激素在阻止急性肝衰竭发生中的作用[3,4]。由此,我们认为糖皮质激素阻止急性肝衰竭发生的机制,除与其能抑制免疫应答与炎症反应有关外,可能更关键的是与其能增强肝细胞保护功能有关。
由多药耐药基因1(multi-drug resistance gene 1,MDR1)编码的P-糖蛋白(P-glycoprotein,P-gp)具有重要的组织细胞保护功能,并可能在保护肝细胞、阻止肝细胞死亡中起重要作用。地塞米松(dexamethasone,Dex)和氢化可的松可通过诱导豚鼠脑微血管内皮细胞表达P-gp,增强血脑屏障功能[5],地塞米松也能诱导大鼠原代肝细胞增强表达P-gp[6],布地奈德能诱导结肠腺癌细胞增强表达P-gp[7],胎盘滋养细胞的糖皮质激素受体α可能参与调控P-gp转录[8],因而推测地塞米松能通过诱导人肝细胞P-gp表达、增强肝细胞保护作用。然而,地塞米松诱导肝细胞表达P-gp的机制尚未阐明。已有研究显示,地塞米松能激活耳毛细胞的磷酸肌醇-3激酶(phosphatidylinositol 3 kinase,PI3K)信号途径增强表达[9],而在小鼠淋巴瘤细胞、鼠白血病细胞株、人胃癌细胞、人白血病多药耐药细胞株中,激活PI3K/Akt的通路能增强P-gp的表达[10,11,12,13],因而推测地塞米松能通过PI3K/Akt信号途径诱导人肝细胞表达P-gp。本研究拟采用人正常肝细胞株L02作为模型,体外观察地塞米松能否上调L02细胞的P-gp 表达水平,并初步探讨PI3K/Akt细胞信号通路在此过程中的作用。 1 材料与方法 1.1 主要试剂及耗材
地塞米松(购自中国大连美仑生物);PI3K/Akt酶抑制剂LY294002(购自美国Abcam公司);RPMI1640培养基、0.25%胰蛋白酶(购自美国Gibco公司);新生牛血清(购自中国兰州民海);针对人P-gp的单克隆抗体(EPR10364,购自美国Abcam公司);针对人Akt的 单克隆抗体(C67E7,购自美国Cell Signaling Technology,CST公司);GAPDH抗体、辣根过氧化物酶标记山羊抗兔IgG、辣根过氧化物酶标记山羊抗小鼠IgG(购自中国江苏碧云天生物技术研究所);RIPA 裂解液、PMSF(购自中国南京凯基生物);PVDF膜(购自美国Millipore); BCA蛋白定量分析试剂盒、ECL化学发光显色试剂盒(购自美国Thermo公司)。 1.2 细胞株及细胞培养
人正常肝细胞L02细胞株购自上海细胞所,培养于含10%新生牛血清的RPMI1640培养基中,培养条件为37 ℃,饱和湿度,5% CO2孵箱内,L02细胞呈长多边形,贴壁生长2~3 d后用0.25%胰蛋白酶消化传代,实验时所用细胞均处于对数生长期。 1.3 细胞处理
收集呈对数生长期的L02细胞,用0.25%胰蛋白酶消化处理,制成单细胞悬液,取5×105的L02细胞悬液接种于6孔板内,每孔2 mL,于37 ℃,5% CO2孵箱中培养24 h、待细胞完全贴壁后再进行以下研究。
地塞米松诱导L02细胞P-gp及Akt表达:在每孔中分别加入不同浓度的地塞米松(0、5、10、20 μmol/L) 刺激L02细胞,各设3个复孔,于37 ℃,5% CO2孵箱中继续培养24 h。
PI3K/Akt酶抑制剂LY294002对L02细胞基础P-gp 表达的影响:分别加入不同浓度的LY294002(5、 10、20 μmol/L)刺激L02细胞,各设3个复孔,于37 ℃,5% CO2孵箱中继续培养24 h。
PI3K/Akt酶抑制剂LY294002对地塞米松诱导L02细胞P-gp 表达的影响:筛选最适浓度,单独及联合加入10 μmol/L 地塞米松,20 μmol/L LY294002刺激L02细胞,各设3个复孔,于37 ℃,5%CO2孵箱中继续培养24 h。 1.4 Western blot检测L02细胞P-gp与PI3K/Akt表达水平
L02细胞按5×105/孔接种于6孔板中,提取蛋白时用冷PBS洗2次,将200 μL/孔的RIPA强裂解液与PMSF的混合液加入板中,4 ℃ 12 000×g离心5 min,收集上清液,即为所提细胞总蛋白,用酶标仪测定蛋白浓度,加入蛋白上样缓冲液,按照15 μg/孔进行SDS-PAGE凝胶
电泳,60 V电泳3 h,然后将蛋白转到PVDF膜上,用5%脱脂奶粉封闭2 h,TBS洗膜后按照分组加入兔源性单克隆P-gp一抗、Akt一抗及鼠源性单克隆GAPDH一抗,4 ℃孵育过夜,孵育16 h后TBST洗膜2次,5%脱脂奶粉封闭20 min,分别加入山羊抗兔及山羊抗小鼠辣根过氧化物酶标记的二抗,室温孵育75 min,TBST洗膜4次,每次20 min,吸干PVDF膜上液体后加入ECL发光液,使用Image Lab软件于Bio-Rad ChemiDocTM XRS上显影。P-gp及Akt表达水平以目的蛋白印迹条带与内参GAPDH灰度值比值为相对表达量,与对照组以百分比形式作图,结果数值用Image J 1.46r软件分析。 1.5 统计学方法
所有计量资料数据以 ±s表示,组间比较行单因素方差分析及t检验,P-gp及Akt基础表达水平之间的相关性采用多次重复实验后两变量灰度值比值的Pearson相关分析,使用SPSS 18.0进行统计分析,所有图形使用GraphPad Prism 5绘制。 2 结果 2.1 地塞米松对L02细胞P-gp表达水平的影响
不同浓度的地塞米松(5、10、20 μmol/L)处理L02细胞24 h后,提取的细胞总蛋白中P-gp表达水平较对照组升高,其中当地塞米松浓度为10 μmol/L时P-gp 表达水平较对照组显著增加60.8%(P<0.05,图 1),其余各组无统计学差异(P>0.05)。
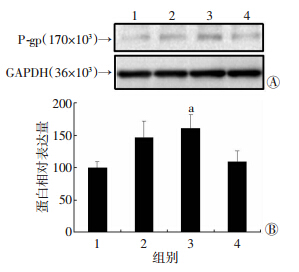 |
| 1:对照组;2:Dex 5 μmol/L组;3:Dex 10 μmol/L组;4:Dex 20 μmol/L组 A:Western blot检测结果;B:半定量分析结果 a: P<0.05,与对照组比较 图 1 Western blot检测不同浓度地塞米松对L02细胞 P-gp表达水平的影响 |
地塞米松浓度为10 μmol/L时Akt的表达水平较对照组显著增加约(25.0±9.5)%(P<0.05,图 2)。
 |
| 1:对照组;2:Dex 10 μmol/L组 A:Western blot检测结果;B:半定量分析结果 a: P<0.05,与对照组比较 图 2 Western blot检测10 μmol/L地塞米松对L02细胞 Akt表达水平的影响 |
L02细胞Akt表达水平越高者,其P-gp表达水平也越高,两者之间呈显著正相关(Pearson系数=0.87,P<0.01)。 2.4 PI3K/Akt在调控L02细胞基础性P-gp表达中的作用
不同浓度PI3K/Akt酶抑制剂LY294002(5、10、20 μmol/L)处理24 h后的L02细胞P-gp表达水平均低于未处理的L02细胞(对照组),且LY294002浓度越高者,其P-gp表达水平则越低。20 μmol/L 酶抑制剂LY294002处理组L02细胞P-gp表达水平与对照组相比显著降低33.8%(P<0.05,图 3A、B)。
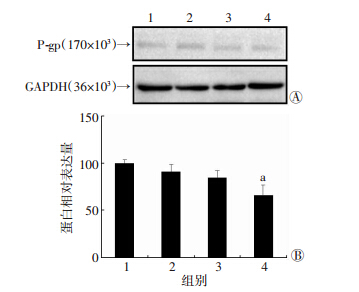 |
| 1:对照组;2:LY294002 5 μmol/L组;3:LY294002 10 μmol/L 组;4:LY294002 20 μmol/L组 A:Western blot检测结果;B:半定量分析结果 a: P<0.05,与对照组比较 图 3 Western blot检测不同浓度LY294002对L02细胞 P-gp表达水平的影响 |
地塞米松单独处理组和地塞米松与LY294002联合处理组L02细胞P-gp表达水平分别是对照组的163.5%和130.1%,两者间相差显著(P=0.031 3)。地塞米松单独处理组较对照组的P-gp表达水平显著增高63.5%(图 4A),地塞米松与LY294002联合处理组较对照组P-gp表达水平显著增加30.1%(图 4B)。
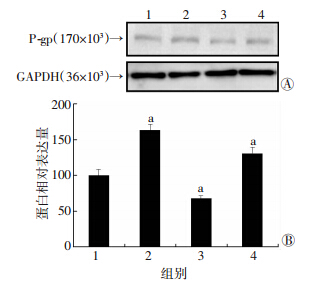 |
| 1:对照组;2:Dex 10 μmol/L组;3:LY294002 20 μmol/L组;4:Dex 10 μmol/L+LY294002 20 μmol/L组 A:Western blot检测结果;B:半定量分析结果 a: P<0.05,与对照组比较图 4 WesternWestern blot检测单独及联用10 μmol/L地塞米松和 20 μmol/L LY294002对L02细胞P-gp表达水平的影响 |
P-gp是一种重要的多药转运蛋白,由1 280个氨基酸组成,在正常人肝细胞、肠上皮细胞等组织细胞中均有不同程度表达。P-gp能将外源性或有害化学物质及内生性有毒代谢产物泵出肝细胞外,减少其在肝细胞内的堆积,从而阻止肝细胞损伤与死亡。另外,P-gp 能直接抑制半胱氨酸-天冬氨酸蛋白酶(Caspase) 8与Caspase 3的激活,阻止Caspase依赖的细胞凋亡。小鼠敲除MDR基因(缺乏P-gp)后出现肝细胞损伤变性、汇管区炎性细胞浸润,并容易发展为肝硬化与肝癌。因此,上调肝细胞P-gp表达有助于增强肝脏抗损伤和处理毒性物质的能力,并有可能在阻止急性肝衰竭的发生与发展中起重要作用。L02细胞是来源于中科院上海生化细胞所的正常人肝细胞株,具有正常人肝细胞的类似形态与功能。本研究结果显示,L02细胞基础P-gp表达水平较低,可用作研究P-gp表达调控机制的细胞模型。Iqbal等[5]发现地塞米松及氢化可的松能诱导豚鼠脑血管内皮细胞增强表达P-gp;Chieli等[6]发现地塞米松能够诱导大鼠原代肝细胞增强表达P-gp;本研究结果也显示地塞米松能诱导人正常肝细胞L02细胞增强表达P-gp,提示糖皮质激素有可能通过上调肝细胞P-gp表达途径增强肝细胞的保护功能。
国外已有研究发现糖皮质激素参与调控细胞P-gp表达的可能信号通路,Shi等[14]发现地塞米松能诱导鼠肝细胞孕烷X受体(pregnane X receptor,PXR)增强表达;而Rigalli等[15]发现安体舒通能通过激活PXR诱导HepG2细胞增强表达P-gp;Zhang等[16]发现地塞米松可通过PXR诱导人视网膜色素上皮细胞增强表达P-gp;另外,Haake等[9]发现地塞米松能激活听耳毛细胞的PI3K/Akt和蛋白激酶C(protein kinase C,PKC)/核因子-κB(nuclear factor-κB,NF-κB)信号途径增强表达以对抗TNF-α介导的细胞凋亡,而Liu等[17]发现胰岛素能通过激活PKC/NF-κB信号途径诱导鼠脑微血管内皮细胞增强表达P-gp;文献[18,19,20]研究发现地塞米松能激活鼠胰岛细胞与神经细胞、人血管内皮细胞PI3K/Akt信号通路;而Mao等[12]发现他莫昔芬能通过抑制PI3K/Akt信号通路抑制胃癌细胞P-gp 的表达;Kuo等[21]发现乙酰氨基芴能通过激活PI3K/Akt和NF-κB信号途径增强肝癌细胞P-gp的表达。因此我们推测PI3K/Akt、PKC/NF-κB及PXR信号通路可能在糖皮质激素诱导不同细胞P-gp增强表达中起重要作用。但糖皮质激素能否通过上述细胞信号通路诱导人正常肝细胞增强表达P-gp目前尚少见报道。本研究探讨PI3K/Akt信号通路在激素诱导人正常肝细胞L02细胞P-gp增强表达的作用,结果显示地塞米松也能诱导L02细胞增强表达总Akt,提示糖皮质激素也能激活正常人肝细胞株L02细胞PI3K/Akt信号途径。本研究结果还显示,L02细胞中P-gp表达水平与总Akt表达水平呈显著正相关,提示地塞米松上调L02细胞P-gp表达可能与其激活PI3K/Akt信号途径有关。
PI3K/Akt酶抑制剂LY294002为PI3K特异性抑制剂,抑制了Akt的磷酸化,从而抑制了PI3K/Akt信号通路的活化。本研究发现PI3K/Akt酶抑制剂LY294002能降低L02细胞基础性P-gp表达水平、且呈现剂量依赖性,提示PI3K/Akt信号途径参与L02细胞P-gp表达的调控。本研究结果还显示,PI3K/Akt酶抑制剂LY294002联合地塞米松诱导组的L02细胞P-gp表达水平显著低于单用地塞米松诱导的L02细胞、但仍显著高于对照组,进一步证实地塞米松可能通过激活PI3K/Akt信号途径上调L02细胞P-gp表达。然而,PI3K/Akt酶抑制剂LY294002未能完全抑制L02细胞基础性与地塞米松诱导性的P-gp表达,提示还可能存在PI3K/Akt以外的信号途径参与调控L02细胞P-gp表达。有关磷酸化Akt与P-gp表达水平之间的关系及其他信号通路在糖皮质激素诱导人正常肝细胞L02细胞P-gp增强表达中的作用,有待进一步研究。
综上所述,地塞米松可能通过激活PI3K/Akt途径上调L02细胞P-gp表达,从而增强肝细胞的保护肝功能,为进一步阐明糖皮质激素阻止急性肝衰竭的发生机制提供了初步的实验依据。
| [1] | Fujiwara K, Yasui S, Yonemitsu Y, et al. Efficacy of combination therapy of antiviral and immunosuppressive drugs for the treatment of severe acute exacerbation of chronic hepatitis B[J]. J Gastroenterol, 2008, 43(9): 711-719. |
| [2] | Zhang X Q, Jiang L, You J P, et al. Efficacy of short-term dexamethasone therapy in acute-on-chronic pre-liver failure[J]. Hepatol Res, 2011, 41(1): 46-53. |
| [3] | Erdem S R, Emre-Aydingoz S, Atilla P, et al. Cyclosporine A-induced acute hepatotoxicity in guinea pigs is associated with endothelin-mediated decrease in local hepatic blood flow[J]. Life Sci, 2011, 88(17/18): 753-760. |
| [4] | Van-Summeren A, Renes J, Bouwman F G, et al. Proteomics investigations of drug-induced hepatotoxicity in HepG2 cells[J]. Toxicol Sci, 2011, 120(1): 109-122. |
| [5] | Iqbal M, Gibb W, Matthews S G. Corticosteroid regulation of P-glycoprotein in the developing blood-brain barrier[J]. Endocrinology, 2011, 152(3): 1067-1079. |
| [6] | Chieli E, Santoni-Rugiu E, Cervelli F, et al. Differential modulation of P-glycoprotein expression by dexamethasone and 3-methylcholanthrene in rat hepatocyte primary cultures[J]. Carcinogenesis, 1994, 15(2): 335-341. |
| [7] | Maier A, Zimmermann C, Beglinger C, et al. Effects of budesonide on P-glycoprotein expression in intestinal cell lines[J]. Br J Pharmacol, 2007, 150(3): 361-368. |
| [8] | Pavek P, Cerveny L, Svecova L, et al. Examination of Glucocorticoid receptor alpha-mediated transcriptional regulation of P-glycoprotein, CYP3A4, and CYP2C9 genes in placental trophoblast cell lines[J]. Placenta, 2007, 28(10): 1004-1011. |
| [9] | Haake S M, Dinh C T, Chen S, et al. Dexamethasone protects auditory hair cells against TNFalpha-initiated apoptosis via activation of PI3K/Akt and NFkappaB signaling[J]. Hear Res, 2009, 255(1/2): 22-32. |
| [10] | Barancik M, Bohacova V, Sedlak J, et al. LY294, 002, a specific inhibitor of PI3K/Akt kinase pathway, antagonizes P-glycoprotein-mediated multidrug resistance[J]. Eur J Pharm Sci, 2006, 29(5): 426- 434. |
| [11] | Garcia M G, Alaniz L D, Cordo-Russo R I, et al. PI3K/Akt inhibition modulates multidrug resistance and activates NF-kappaB in murine lymphoma cell lines[J]. Leuk Res, 2009, 33(2): 288-296. |
| [12] | Mao Z, Zhou J, Luan J, et al. Tamoxifen reduces P-gp-mediated multidrug resistance via inhibiting the PI3K/Akt signaling pathway in ER-negative human gastric cancer cells[J]. Biomed Pharmacother, 2014, 68(2): 179-183. |
| [13] | Ma H, Cheng L, Hao K, et al. Reversal effect of ST6GAL 1 on multidrug resistance in human leukemia by regulating the PI3K/Akt pathway and the expression of P-gp and MRP1[J]. PLoS One, 2014, 9(1): e85113. |
| [14] | Shi D, Yang D, Yan B. Dexamethasone transcriptionally increases the expression of the pregnane X receptor and synergistically enhances pyrethroid esfenvalerate in the induction of cytochrome P450 3A23[J]. Biochem Pharmacol, 2010, 80(8): 1274-1283. |
| [15] | Rigalli J P, Ruiz M L, Perdomo V G, et al. Pregnane X receptor mediates the induction of P-glycoprotein by spironolactone in HepG2 cells[J]. Toxicology, 2011, 285(1/2): 18-24. |
| [16] | Zhang Y, Lu M, Sun X, et al. Expression and activity of p-glycoprotein elevated by dexamethasone in cultured retinal pigment epithelium involve glucocorticoid receptor and pregnane X receptor[J]. Invest Ophthalmol Vis Sci, 2012, 53(7): 3508-3515. |
| [17] | Liu H, Yang H, Wang D, et al. Insulin regulates P-glycoprotein in rat brain microvessel endothelial cells via an insulin receptor-mediated PKC/NF-kappaB pathway but not a PI3K/Akt pathway[J]. Eur J Pharmacol, 2009, 602(2/3): 277-282. |
| [18] | Protzek A O, Costa-Junior J M, Rezende L F, et al. Augmented beta-Cell Function and Mass in Glucocorticoid-Treated Rodents Are Associated with Increased Islet Ir-beta/AKT/mTOR and Decreased AMPK/ACC and AS160 Signaling[J]. Int J Endocrinol, 2014, 2014: 983453. |
| [19] | Hafezi-Moghadam A, Simoncini T, Yang Z, et al. Acute cardiovascular protective effects of corticosteroids are mediated by non-transcriptional activation of endothelial nitric oxide synthase[J]. Nat Med, 2002, 8(5): 473- 479. |
| [20] | Feng Y, Lu S, Wang J, et al. Dexamethasone-induced neuroprotection in hypoxic-ischemic brain injury in newborn rats is partly mediated via Akt activation[J]. Brain Res, 2014, 1589C: 68-77. |
| [21] | Kuo M T, Liu Z, Wei Y, et al. Induction of human MDR1 gene expression by 2-acetylaminofluorene is mediated by effectors of the phosphoinositide 3-kinase pathway that activate NF-kappaB signaling[J]. Oncogene, 2002, 21(13): 1945-1954. |



