蛛网膜下腔出血(subarachnoid hemorrhage,SAH)具有发病急,致残、致死率高,早期救治困难等特点。对于SAH的研究,近年来有学者提出了SAH后早期脑损伤(early brain injury,EBI)[1-2]的概念,认为发生于SAH后72h内,主要包括全脑缺血、血脑屏障的破坏、脑水肿、免疫炎症和细胞凋亡等一系列的病理变化,对SAH患者的早期病死、病残负主要责任[3,4]。
液态氟碳全氟辛基溴(perfluorooctyl-bromide,PFOB)作为新一代的全氟碳化合物(perfluorocarbon,PFC),因其独特的不透射线、声学、磁学特性及安全、稳定等特点,被广泛用于超声、CT及MR造影剂的研究[5,6],同时PFOB具有极强的携氧能力、高度稳定性、良好的扩散性,低表面张力,低黏度,高密度以及高气体溶解度等特点[7,8],已广泛用于生物医学多个领域,但用于蛛网膜下腔出血方面尚未见报告。海马神经元对缺血缺氧具有高度选择敏感性,短暂性脑缺血缺氧发作即可导致该区域神经元细胞发生凋亡、坏死。所以海马成为缺血性脑损伤研究的一个典型脑区。因此,本实验选取海马组织为研究对象,给予SAH模型大鼠结合了高浓度氧的液态氟碳纳米粒干预,观察PFOB是否能对SAH后海马神经元起到保护作用。
1 材料与方法 1.1 实验试剂PFOB购自Alliance Pharmaceutical公司,于重庆医科大学超声影像学研究所制成粒径(90.2±8.3)nm乳化纳米粒;免疫组化试剂盒购自北京中杉金桥公司;TUNEL试剂盒购自Roche公司,DAB显色剂购自DAKO公司。Caspase-3抗体购自Abcam公司,β-actin内参购自上海生工公司。其余试剂由重庆医科大学附属第一医院实验中心提供。
1.2 动物及分组成年健康雄性SD大鼠90只,由重庆医科大学实验动物中心提供,体质量(300±5)g,分为3组,每组30只,分别为假手术组(SHAM)、蛛血组(SAH)及PFOB干预组(SAH+PFOB)。SAH组采用经视交叉前池注血法制作SAH模型,SHAM组同SAH组,但不注射动脉血液;PFOB干预组于造模成功后3 h通过尾 静脉注射溶解高浓度氧的PFOB纳米乳化剂(5 g/kg)。 造模后24 h,4%多聚甲醛心脏灌注取脑,完成海马CA1区透射电镜切片观察,免疫组化检测及TUNEL阳性细胞计数。其中SAH组及SAH+PFOB组又分为12、24、48、72 h 4个时相点,于各时相点提取海马组织,-80 ℃保存,提取蛋白行Western blot检测。
1.3 麻醉使用10%水合氯醛(300 mg/kg)腹腔注射麻醉,术中使用保温台维持体温,观察呼吸及心率变化。
1.4 PFOB乳化纳米粒制作经过前期工作积累,已经掌握稳定制备PFOB纳米粒方法。PFOB 纳米粒外观为均匀乳液状,室温下静置1 h以上不发生分层现象。能够在4 ℃冰箱中保持稳定状态1个月以上,肉眼与显微镜观察,在此期间其外观和形态均无明显改变。PFOB纳米粒细小而密集,形态规则、呈球形分布,纳米粒间无明显聚现象。PFOB纳米粒径(90.2±8.3)nm,粒径分布窄(图 1)。

|
| 图 1 扫描电镜下PFOB纳米粒(A)和PFOB纳米粒粒径分布(B) |
使用经视交叉前池注血法制作SAH模型。大鼠麻醉并固定,额部备皮、消毒额部,正中开颅,牙科钻头颅骨钻孔,采用立体定向仪在前囟前7.5 mm,倾斜矢状面30°进针,10 mm左右达到颅底。股动脉抽取动脉血0.2 mL,自制带侧孔针头缓慢注射,注血时间2 min,注射结束后骨蜡封闭颅骨骨孔。缝合额部、股部切口。术中维持肛温37 ℃。术后护理:麻醉未清醒前给予电热毯保暖,维持室温30 ℃。术后大鼠单笼饲养,注意保暖。假手术组除不注入动脉血外,余操作与SAH 模型大鼠相同。
1.6 脑水含量测定每组各选取5只大鼠,于术后24 h断头取出脑组织迅速称质量(采用干湿质量法),置烤箱烤干至恒重,计算脑含水量:脑组织含水量(%)=(湿质量-干质量)/湿质量×100%。
1.7 透射电镜观察4%戊二醛心脏灌注取脑,2.5%戊二醛固定、1%锇酸固定、丙酮梯度脱水、包埋、聚合、修复、切片、染色后透射电镜观察。
1.8 免疫组化取大鼠脑组织石蜡切片,经脱蜡、抗原修复、阻断内源性过氧化物酶、一抗结合、二抗结合、DAB显色、复染、盐酸酒精分化、返蓝、脱水、中性树胶封片后分析。
1.9 原位细胞凋亡检测技术(TUNEL)取大鼠脑组织石蜡切片,经脱蜡、抗原修复破膜、阻断内源性过氧化物酶活性、DAB显色、复染、盐酸酒精分化、返蓝、脱水、中性树胶封片后照相分析。细胞核中有棕黄色颗粒者为阳性细胞,光镜下凋亡细胞呈棕黄色,于高倍镜(×400)下随机观察 10个视野(来自不同切片),计数海马神经元凋亡细胞所占比值的平均数。
1.10 Western blot检测每组随机取5只大鼠。取脑,置于细胞裂解液中,低温匀浆,静置10 min后加入90 μL 100 g/L NP-40,剧烈震荡30 s,4 ℃ 13 000 r/min离心15 min,取上清,分装-80 ℃保存备用。蛋白定量后加入4倍体积样本缓冲液,95 ℃变性5 min。取30 μg样品在10% SDS聚丙烯酰胺凝胶上电泳后,电转至硝酸纤维素膜,根据分子量大小切取条带,取相应条带分别加入兔抗Caspase-3多抗(1 ∶250),4 ℃过夜,TBST冲洗后,分别与生物素标记的羊抗兔IgG抗血清(1 ∶150)室温下震荡孵育1.5 h,TBST洗涤后,与卵白素-辣根过氧化物酶复合物室温下孵育2 h,DAB显色。将特异蛋白条带用扫描仪进行扫描,以β-actin为内参照,应用图像分析系统测定条带灰度值。
1.11 统计学分析采用SPSS 19.0统计软件处理,采用单因素方差分析和相关分析。检验系数α=0.01。
2 结果 2.1 造模及干预后24 h各组大鼠脑含水量测定SAH较SHAM组脑含水量明显增加[(80.65±0.49) vs (76.32±0.52),P<0.01],SAH+PFOB组较 SAH组比较,脑含水量明显降低[(78.40±0.72) vs (80.65±0.49),P<0.01]。
2.2 透射电镜观察造模及PFOB干预后24 h,4%戊二醛灌注取脑,海马CA1区制成电镜超薄切片,透射电镜下观察。SAH组可见神经元皱缩、核浓缩深染、胞质深染;染色质边聚、核肿胀;毛细血管周围水肿明显。胶质细胞肿胀,溶解。SAH+PFOB组未见凋亡神经元及上述形态学改变,仅可见轻微神经元内质网扩张及线粒体轻微肿胀。SHAM组形态正常,未见上述改变(图 2)。

|
| 图 2 透射电镜观察各组大鼠海马CA1区形态学变化 |
造模及PFOB干预后24 h,4%多聚甲醛灌注取脑,组织切片,400倍光镜观察。SHAM组未见Caspase-3 蛋白表达,SAH组较SHAM组Caspase-3表达增加。SAH+PFOB组Caspase-3蛋白表达较SAH组显著减少 (图 3)。

|
| 图 3 免疫组化检测各组大鼠海马CA1区神经元Caspase-3表达 (×400) |
400倍光镜下观察海马CA1区神经元,每组5只。SHAM组见少量TUNEL阳性细胞表达,SAH组TUNEL阳性细胞率明显增加[(43.23±2.67) vs (6.33±0.72),P<0.01],SAH+PFOB组TUNEL阳性细胞表达较SAH组显著减少[(27.48±1.53) vs (43.23±2.67),P<0.01,图 4]。

|
| A: SHAM组;B: SAH组;C: SAH+PFOB组 |
| 图 4 TUNEL染色检测各组大鼠海马CA1区神经元凋亡 (×400) |
分别于造模及药物干预成功后按时间点提取各组大鼠海马蛋白,Western blot检测结果显示,SAH+PFOB组较SAH组Caspase-3蛋白表达在12、24、48、72 h 各时间点均可见明显降低(P<0.01,图 5)。
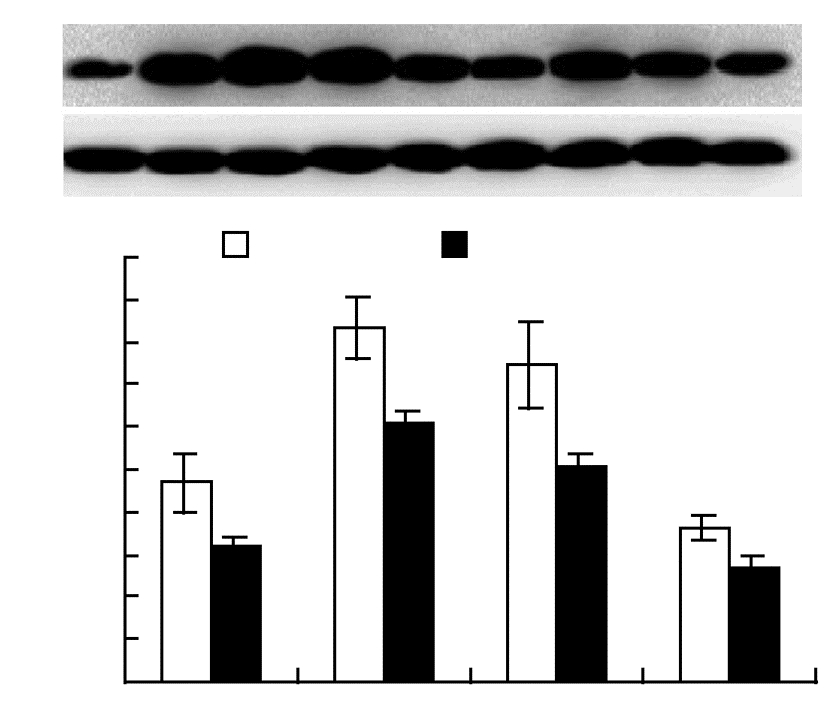
|
| A: Western blot检测结果 1:SHAM组;2~5:SAH组12、24、48、72 h;6~9: SAH+PFOB组12、24、48、72 h;B:半定量分析结果 a:P<0.01,与SAH组各对应时间点比较 |
| 图 5 Western blot检测各组大鼠海马Caspase-3蛋白的表达 |
SAH后72 h内早期脑损伤所引起全脑缺血、脑水肿、氧化应激反应和免疫炎性反应等会导致广泛性的细胞凋亡。而减轻细胞凋亡可在很大程度上减轻早期脑损伤[9]。Caspase-3是细胞凋亡过程中主要的效应因子之一,是由多种凋亡刺激信号传递过程的会聚点,已经作为研究凋亡的常用指标之一[10]。PFOB属于第3代的PFC,相比于1、2代PFOB具有更高的稳定性及携氧能力,粒径更小,分布均匀且不易变性。数据显示常温一个大气压下,每100毫升PFOB最多溶解氧气约66 mL[11],溶解二氧化碳约166 mL;同样条件下,每100 mL 血液只能溶解氧气约0.3 mL,血红蛋白结合的氧气约18.7 mL,远远超过血液携带的氧气。PFOB中的氧分子不必跨越红细胞膜,这就提高了细胞的浓度梯度,并使氧分子在靶灶处扩散更为容易。前期工作中通过改进微液化技术,成功制备了平均直径90 nm 左右的纳米级液态氟碳乳化剂。此纳米级的PFOB乳化剂微粒排列更接近毛细血管壁,更易通过血管壁及脑组织,也大大缩短了氧分子转运的路程。因此,PFOB纳米粒具有生物体内安全、稳定,极高携氧能力、良好穿透能力以及多模态显像能力,静脉注射快速作用于病灶等优良特性。
本研究表明,PFOB对蛛网膜下腔出血后早期脑损伤的保护作用明显,主要表现在:SAH+PFOB组较之SAH组,脑含水量明显降低,海马CA1区透射电镜观察结果示蛛血后的神经元凋亡、胶质细胞肿胀、毛细血管周围水肿等现象有所减轻。提示PFOB能改善大脑缺血缺氧状况,在细胞及亚细胞层面对神经元起到保护作用。Western blot检测结果显示:促凋亡因子Caspase-3在SAH早期各时间亚组均可见明显降低,同时通过凋亡最明显的SAH后24 h时相点的TUNEL法测凋亡细胞阳性率及免疫组化也可得到相同的结果,说明PFOB在分子层面实现了对神经元的保护作用。这初步说明了在大鼠蛛网膜下腔出血后早期脑损伤中,溶解高浓度氧的液态氟碳纳米粒,可以减轻神经元凋亡,保护神经元,在多个层面实现对蛛网膜下腔出血后早起脑损伤的保护。PFOB其发挥作用的具体机制尚不清楚,考虑可能从以下几个方面产生保护作用:氟碳对氧摄取-释放速率极快,颗粒小,氧分子浓度梯度大,能迅速给脑组织提供充足的氧;能迅速带走微循环中高浓度CO2,减轻酸中毒,缓解血管痉挛氟碳粘度低,能稀释红细胞及纤维蛋白原,降低血液粘度,改善脑血流;氟碳本身不含有血液有形成分,能减少氧自由基的产生及释放。
自Clark等[12]开创了PFC作为呼吸气体载体的生物医学研究以来,PFC已经用于血液替代品[13],液体通气治疗呼吸系统疾病[14],心血管系统方面的心肌梗死、冠脉成形术,CO中毒急救,靶向药物载体[15],新型造影剂[16]等多个领域。在神经外科领域,PFC具有增加脑血流,清除自由基[17]、预防出血性梗死、减少出血性脑梗死面积[18],动物脑卒中后的保护作用[19]、颅脑外伤后的意识恢复[20]、脊髓外伤后神经元的保护作用[21]等多个方面作用。但在蛛网膜下腔出血方面的作用还未见相关报道。目前对蛛网膜下腔出血的干预性研究中,主要通过脑室注药、腹腔注射、胃内灌注药物等方式实行干预,因受药物动力学及血脑屏障等的影响,其干预效果不稳定。本实验将氟碳化合物用于蛛网膜下腔出血的研究,通过尾静脉注射PFOB纳米乳化剂,利用其极高的携氧能力、良好的穿透能力、良好的扩散性,低表面张力、低黏度,高密度以及高气体溶解度等独特的物理特性,经血液循环到达目的区域。同时下一步实验中可能利用其多模显像能力在治疗SAH的同时对病情实时监控,应用前景较大。本项目所获实验数据,可推动PFOB纳米粒尽快应用于临床,为进一步治疗蛛网膜下腔出血提供新的思路。
| [1] | Broderick J P, Brott T G, Duldner J E, et al. Initial and recurrent bleeding are the major causes of death following subarachnoid hemorrhage[J]. Stroke, 1994, 25(7): 1342-1347. |
| [2] | Cahill J, Zhang J H. Subarachnoid hemorrhage: is it time for a new direction?[J]. Stroke, 2009, 40(3 Suppl): S86-S87. |
| [3] | Chen J, Chen G, Li J, et al. Melatonin attenuates inflammatory response-induced brain edema in early brain injury following a subarachnoid hemorrhage: a possible role for the regulation of pro-inflammatory cytokines[J]. J Pineal Res, 2014, 57(3): 340-347. |
| [4] | Sehba F A, Hou J, Pluta R M, et al. The importance of early brain injury after subarachnoid hemorrhage[J]. Prog Neurobiol, 2012, 97(1): 14-37. |
| [5] | 李奥, 王志刚. 液态氟碳纳米粒——一种多功能影像学造影剂[J]. 临床超声医学杂志, 2008, 10(12): 830-832. |
| [6] | 沈红霞, 郑元义, 王志刚. 包裹液态氟碳的高分子超声造影剂的研究进展[J]. 中国介入影像与治疗学, 2010, 7(6): 684-687. |
| [7] | Lacatusu D, Baican M, Crivoi F. Effects of perfluorocarbon emulsion in rheology[J]. Rev Med Chir Soc Med Nat Iasi, 2014, 118(1): 232-238. |
| [8] | Vasquez D M, Ortiz D, Alvarez O A, et al. Hemorheological implications of perfluorocarbon based oxygen carrier interaction with colloid plasma expanders and blood[J]. Biotechnol Prog, 2013, 29(3): 796-807. |
| [9] | Yuksel S, Tosun Y B, Cahill J, et al. Early brain injury following aneurysmal subarachnoid hemorrhage: emphasis on cellular apoptosis[J]. Turk Neurosurg, 2012, 22(5): 529-533. |
| [10] | Edebali N, Tekin I O, Acikgoz B, et al. Apoptosis and necrosis in the circumventricular organs after experimental subarachnoid hemorrhage as detected with annexin V and caspase 3 immunostaining[J]. Neurol Res, 2014, 36(12): 1114-1120. |
| [11] | Riess J G. Perfluorocarbon-based oxygen delivery[J]. Artif Cells Blood Substit Immobil Biotechnol, 2006, 34(6): 567-580. |
| [12] | Clark L C Jr, Gollan F. Survival of mammals breathing organic liquids equilibrated with oxygen at atmospheric pressure[J]. Science, 1966, 152(3730): 1755-1756. |
| [13] | Remy B, Deby-Dupont G, Lamy M. Red blood cell substitutes: fluorocarbon emulsions and haemoglobin solutions[J]. Br Med Bull, 1999, 55(1): 277-298. |
| [14] | Spitzer A R, Lipsky C L. Partial 1iquid ventilation with perflubron in premature infants with severe respiratory distress syndrome[J]. Clin Pediatr (Phila), 1997, 36(3): 181-182. |
| [15] | Lin C Y, Javadi M, Belnap D M, et al. Ultrasound sensitive eLiposomes containing doxorubicin for drug targeting therapy[J]. Nanomedicine, 2014, 10(1): 67-76. |
| [16] | Yu Y B. Fluorinated dendrimers as imaging agents for 19F MRI[J]. Wiley Interdiscip Rev Nanomed Nanobiotechnol, 2013, 5(6): 646-661. |
| [17] | Rosenblum W I. Fluorocarbon emulsions and cerebral microcirculation[J]. Fed Proc, 1975, 34(6): 1493-1498. |
| [18] | Yokota C, Kaji T, Kuge Y, et al. Temporal and topographic profiles of cyclooxygenase-2 expression during 24 h of focal brain ishemia in rats[J]. Neurosci Lett, 2004, 357(3): 219-222. |
| [19] | Woods S D, Skinner R D, Ricca A M, et al. Progress in dodecafluoropentane emulsion as a neuroprotective agent in a rabbit stroke model[J]. Mol Neurobiol, 2013, 48(2): 363-367. |
| [20] | Zhou Z, Sun D, Levasseur J E, et al. Perfluorocarbon emulsions improve cognitive recovery after lateral fluid percussion brain injury in rats[J]. Neurosurgery, 2008, 63(4): 799-806. |
| [21] | Yacoub A, Hajec M C, Stanger R, et al. Neuroprotective effects of perflurocarbon (oxycyte) after contusive spinal cord injury[J]. J Neurotrauma, 2014, 31(3): 256-267. |



