慢性缺氧是多种心脏疾病的共同病理生理过程。临床常见的包括紫绀型先天性心脏病、冠状动脉粥样硬化性心脏病、代偿性心肌肥厚、高原性心脏病等。慢性缺氧可引起心肌在组织、细胞、分子水平一系列的适应性代偿反应,对心肌产生一定的保护作用[1]。其中,心肌细胞的能量代谢调节是心肌慢性缺氧适应的重要部分,深入研究慢性缺氧过程中心肌细胞能量代谢调节分子机制对指导慢性缺氧性心脏病的临床治疗具有重要意义。
腺苷酸活化蛋白激酶(Adenosine 5-monophosphate-activated protein kinase,AMPK)是一种在真核细胞中广泛存在的丝氨酸/苏氨酸蛋白激酶,被认为是能量代谢调节的关键分子。但是,既往针对AMPK在心肌细胞中活性调节方式的研究报道甚少,AMPK活性调节的确切机制尚不清楚。神经前体细胞表达的发育下调基因4(neuronal precursor cell expressed developmentally downregulated 4,NEDD4)是肿瘤抑制因子磷酸酯酶与张力蛋白同源物(phosphatase and tensin homolog,PTEN)的泛素连接酶[2],其结构中的WW基序可以通过磷酸化丝氨酸/苏氨酸残基识别底物并相互作用[3]。Kalinichenko等[4]发现,NEDD4可识别AMPK样蛋白激酶(MAK-V)并参与其活性的调节。因此我们推测:在心肌细胞中NEDD4可能参与AMPK活性的调节。本研究将观察NEDD4在慢性缺氧心肌标本中的表达变化,采用siRNA干扰技术建立NEDD4低表达细胞模型,检测干扰NEDD4表达对心肌细胞慢性缺氧耐受的影响及AMPK活化水平的变化,旨在探讨NEDD4对AMPK活性的调控作用在心肌细胞慢性缺氧适应中的作用。 1 材料与方法 1.1 临床病例与分组
研究经第三军医大学新桥医院伦理委员会批准,在术前争得患儿家属同意并签署知情同意书。以入院后我科复查的心脏多普勒彩超为主要诊断标准,常温环境不吸氧1 h以上测四肢血压和血氧饱和度。纳入标准:非紫绀组,平均血氧饱和度>95%且四肢血氧饱和度差异≤2%,临床诊断为室间隔缺损合并右室流出道狭窄(VSD+RVOS),术中行室间隔缺损修补术加右室流出道疏通术;紫绀组,平均血氧饱和度<85%且四肢血氧饱和度差异≤2%,临床诊断为法洛四联症(TOF)或右室双出口(DORV),需要行右室流出道疏通术。排除标准:患儿合并其他心脏畸形、多次行心脏矫治手术及其他系统疾病。根据以上标准,入选2013年1月至2014年1月在本科行手术治疗的先心病患儿32例,入组患儿资料见表 1。
| 组别 | n | 女/男 | 年龄(月) | 临床诊断 | 血氧饱和度(%,x±s) | 血红蛋白(g/L,x±s) | 射血分数[(x±s) %] |
| 非紫绀组 | 14 | 8/6 | 25.4±3.8 | VSD+RVOS | 97.6±2.5 | 129.4±3.1 | 66.7±2.1 |
| 紫绀组 | 18 | 9/9 | 20.4±4.3 | TOF、DORV | 79.3±3.0a | 134.3±2.5 | 64.0±3.1 |
| a:P<0.05,与非紫绀组比较 (碧云天),SDS-PAGE蛋白上样 | |||||||
H9c2心肌细胞株(购自ATCC细胞库,并由本实验室冻存保育),DMEM高糖培养基(Gibco),胎牛血清(Gibco),双抗(HyClone),胰酶(Sigma),PBS(中杉金桥),RIPA裂解液(碧云天),DTT(碧云天),PMSF (碧云天),蛋白磷酸酶抑制剂(碧云天),BCA试剂盒缓冲液(5×,碧云天),SDS-PAGE凝胶(自配),BSA封闭液(碧云天),SDS-PAGE电泳液(自配),Western转膜液(自配),TBST缓冲液(自配),PVDF膜(Whatman),PageRuler预染蛋白(ThermoFisher),AMPKα抗体(兔抗人,CST),Phospho-AMPKα抗体(兔抗人,CST),NEDD4抗体(兔抗人,Millipore),β-actin抗体(兔抗人,博奥森),HRP标记的IgG(山羊抗兔,中杉金桥),Opti-MEM Medium(Invitrogen),Lipofectamine RNAiMAX Reagent(Invitrogen),Stealth RNAiTM Pre-designed siRNA(Invitrogen),Stealth RNAi Negative Control Duplexes(Invitrogen),BLOCK-iTTM Alexa Fluor Red Fluorescent Control(Invitrogen),Annexin V-FITC双染(BD)等。 1.3 方法 1.3.1 标本的采集
常规麻醉、胸骨正中切口开胸建立体外循环,取手术中切除的右室流出道心肌组织作为标本,将标本分为两部分,一部分立刻放入液氮中冻存,Western blot检测NEDD4表达,另一部分放入10%福尔马林固定,免疫组化检测NEDD4蛋白在心肌细胞中的分布。
1.3.2 免疫组化检测NEDD4在心肌细胞中的定位 心肌组织固定后用石蜡包埋,常规切片4 μm厚度,一抗为兔抗人NEDD4抗体,稀释浓度为1 ∶500,二抗为生物素标记的HRP山羊抗兔IgG抗体,具体步骤按照试剂盒说明书操作,显微镜观察NEDD4在心肌中的定位及其密度变化。
1.3.3 Western blot检测心肌组织NEDD4表达变化 在液氮中取出冻存的心肌组织,取100 mg研碎并溶解于SDS裂解液中制成匀浆,冰上裂解30 min后,离心(r=10 cm,12 000 r/min,30 min,4 ℃)后取上清液,运用BCA试剂盒检测蛋白质含量。各标本取等量蛋白质样品沸水浴5 min后,加入8% SDS-PAGE凝胶中进行电泳,湿转法将蛋白质转印至PVDF膜上,用5% BSA室温封闭1 h。加入一抗缓冲液(NEDD4抗体 1 ∶5 000),4 ℃摇床过夜,TBST漂洗5 min×3遍,以β-actin为内参,室温二抗(HRP标记的山羊抗兔IgG 1 ∶1 000)封闭1 h,TBST漂洗5 min×3遍,化学发光后显影,测定目的条带和内参条带的灰度值,将目的条带和内参条带的灰度值的比值作为目的蛋白的相对表达含量。
1.3.5 细胞培养与转染 用含有8%胎牛血清的高糖DMEM培养基培养H9c2心肌细胞于37 ℃、5% CO2培养箱中。将H9c2心肌细胞分为常氧组、慢性缺氧组和阳性对照组,慢性缺氧组再分为对照组、空白转染组和干扰转染组,采用Lipofectamine RNAiMAX Reagent转染siRNA至慢性缺氧组和阳性对照组心肌细胞中(其中阳性对照组转染的siRNA带有荧光片段,主要用于检测转染试剂的转染效率),具体步骤按说明书操作,转染后置入常氧箱(74% N2,5% CO2,21% O2)培养48 h,荧光显微镜观察阳性对照组心肌细胞检测转染效率,同时将缺氧组心肌细胞置入缺氧箱(94% N2,5% CO2,1% O2)继续培养72 h后收集细胞,Western blot检测NEDD4、p-AMPK表达量变化,流式细胞术检测心肌细胞损伤比例。
1.3.6 Western blot检测NEDD4、p-AMPK表达量变化 取出培养板后吸出培养液,用预冷的PBS漂洗3遍,加入RIPA裂解液,置冰上30 min后收集细胞裂解液,离心(r=10 cm,12 000 r/min,15 min,4 ℃)后取上清,BCA法测蛋白浓度,与SDS-PAGE蛋白上样缓冲液(5×)按4 ∶1比例混合,取等量蛋白质样品沸水浴5 min后上样,余下步骤同1.3.3。
1.3.7 流式细胞术检测 收集上述处理后的各组细胞,离心(r=10 cm,1 000 r/min,5 min)弃取培养液,加入预冷PBS和Annexin V-FITC检测液重新悬浮细胞,同时加入碘化丙啶染色液,轻轻摇匀,室温避光孵育20 min,随即进行流式细胞仪检测。
1.4 统计学方法
采用SPSS 13.0统计软件,数值均以x±s表示。多组比较行单因素方差分析法,两两比较行LDS法,两组比较行t检验。
2 结果
2.1 人心肌组织中NEDD4表达的检测
免疫组化特异性染色结果显示,NEDD4蛋白表达阳性染色呈棕褐色颗粒,发现NEDD4蛋白表达主要定位于心肌细胞胞质中;与非紫绀组相比,紫绀组先心病患儿心肌组织中NEDD4蛋白表达量显著降低(图 1)。
Western blot检测人心肌组织中NEDD4蛋白表达,其特异性条带见图 2。与非紫绀组相比,紫绀组先心病患儿心肌细胞中NEDD4蛋白表达水平显著降低 [NEDD4/β-actin条带灰度比值:非紫绀组(0.72±0.07),紫绀组(0.42±0.06),P<0.05]。
siRNA转染至H9c2心肌细胞的转染效率见图 3A,Western blot检测NEDD4蛋白表达特异性条带见图 3B。成功转染siRNA的H9c2心肌细胞(红色荧光细胞)约占总心肌细胞数(同一视野非荧光模式下观 察的细胞数)的95%;与常氧组[NEDD4/β-actin条带灰度比值(1.20±0.07),p-AMPK/AMPK条带灰度比值(0.08±0.01)]相比,对照组NEDD4[NEDD4/β-actin条带灰度比值(0.65±0.02)]表达降低、AMPK磷酸化水平[p-AMPK/AMPK条带灰度比值(0.22±0.02)]升高(P<0.05);与空白转染组[NEDD4/β-actin条带灰度比 值(0.70±0.03),p-AMPK/AMPK条带灰度比值(0.21± 0.01)]相比,干扰转染组NEDD4表达[NEDD4/β-actin 条带灰度比值(0.15±0.01)]降低、AMPK磷酸化水平[p-AMPK/AMPK条带灰度比值(0.88±0.04)]升高(P<0.05);对照组与空白转染组相比,NEDD4表达和AMPK磷酸化水平无统计学差异(P>0.05)。
流式细胞术结果见图 4,以损伤细胞比例(%)=Q2(晚凋细胞+坏死细胞)+Q3(早凋细胞)评价心肌细胞损伤水平。常氧组11.62%,对照组24.72%,空白转染组26.15%,干扰转染组12.58%。
慢性缺氧是很多心脏疾病共同的病理生理过程。心肌细胞长期面对缺氧刺激,会产生一系列的适应性代偿反应,其主要的分子机制包括ATP敏感性钾通道激活、活性氧增加、一氧化氮生成增加及蛋白激酶C、丝裂原活化蛋白激酶等蛋白激酶的活化等[5]。 另外,缺氧诱导因子-1稳定性的增加和促红细胞生成素水平的升高亦是心肌慢性缺氧适应的重要方面[6, 7, 8],但能量代谢调节仍是心肌细胞慢性缺氧适应的重要方面。
AMPK是能量代谢调节的关键分子,NEDD4作为可识别磷酸化丝氨酸/苏氨酸残基的泛素连接酶,可能通过调节AMPK活性参与能量代谢调控。我们观察到,NEDD4蛋白表达主要定位于心肌细胞胞质中,与非紫绀型先心病患儿相比,紫绀型先心病患儿心肌组织中NEDD4蛋白表达降低(图 2)。为进一步验证NEDD4表达下降在心肌慢性缺氧适应过程中的作用,我们转染siRNA至H9c2心肌细胞干扰NEDD4表达并进行缺氧刺激,流式细胞术检测细胞凋亡结果显示,与常氧组相比,缺氧组心肌细胞死亡比例显著增加;但干扰NEDD4表达后,缺氧所致心肌细胞损伤比例降低(图 4),Western blot检测结果显示,随着NEDD4表达水平的降低,p-AMPK水平显著增强,但AMPK表达水平无明显变化(图 3),这说明NEDD4对AMPK活性的调节可能是磷酸化依赖性的。因此,我们认为NEDD4表达降低可增强心肌细胞的缺氧耐受,其可能机制是NEDD4表达的下调增强了AMPK活化水平。
既往研究已经证实,慢性缺氧会导致机体三磷酸腺苷(ATP)合成减少,并影响其他的代谢过程[9, 10],活化的AMPK可通过调节糖类、脂质、蛋白质等大分子物质的代谢过程而增加心肌细胞能量的生成[11]。AMPK亦能通过促进PGC1α磷酸化途径增加慢性缺氧时心肌细胞线粒体生物合成[12, 13],导致线粒体绝对数量增加,提高对有限氧的利用效率,为维持心肌细胞的正常功能提供能量。在棕色脂肪组织AMPK受到Cidea介导的泛素化作用降解[14],Al-Hakim等[15]发现在HEK-293细胞中AMPK蛋白激酶NUAK1和MARK4受到去泛素化酶USP9X的调节,泛素化系统在AMPK的活性调节中的作用开始被人们逐步地重视。本研究证实了NEDD4对AMPK活性的调控作用。但在慢性缺氧心肌细胞中,NEDD4蛋白本身受到哪些因素的调节以及NEDD4调控AMPK活性的确切信号通路尚不完全清楚。进一步研究在慢性缺氧过程中NEDD4对细胞代谢调节的具体机制,可为改善慢性缺氧性心脏病的临床治疗提供新的策略。
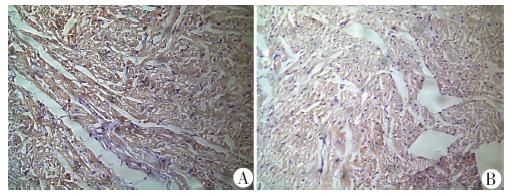
A:非紫绀组;B:紫绀组图 1 2组先心病患儿免疫组化检测NEDD4蛋白在慢性 缺氧心肌中表达 (SABC ×400) 
1~3:非紫绀组;4~6:紫绀组图 2 Western blot检测2组先心病患儿心肌组织中 NEDD4蛋白表达 
A:荧光显微镜观察成功转染的心肌细胞数占总细胞数的比例(×200);B:Western blot检测各组心肌细胞NEDD4、p-AMPK表达 1:常氧组;2:对照组;3:空白转染组;4:干扰转染组图 3 干扰NEDD4表达对AMPK磷酸化水平的影响 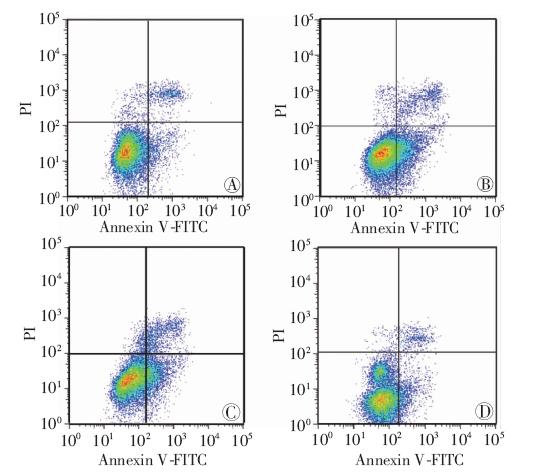
A:常氧组;B:对照组;C:空白转染组;D:干扰转染组图 4 流式细胞术检测干扰NEDD4表达后各组心肌细胞凋亡
| [1] | Essop M F. Cardiac metabolic adaptations in response to chronic hypoxia[J]. J Physiol, 2007, 584(Pt 3): 715- 726. |
| [2] | Wang X, Trotman L C, Koppie T, et al. NEDD4-1 is a proto-oncogenic ubiquitin ligase for PTEN[J]. Cell, 2007, 128(1): 129-139. |
| [3] | Lu P J, Zhou X Z, Shen M, et al. Function of WW domains as phosphoserine- or phosphothreonine-binding modules[J]. Science, 1999, 283(5406): 1325-1328. |
| [4] | Kalinichenko S V, Itoh K, Korobko E V, et al. Identification of Nedd4 E3 ubiquitin ligase as a binding partner and regulator of MAK-V protein kinase[J]. PLoS One, 2012, 7(6): e39505. |
| [5] | Kolar F, Ostadal B. Molecular mechanisms of cardiac protection by adaptation to chronic hypoxia[J]. Physiol Res, 2004, 53(Suppl 1): S3-S13. |
| [6] | 蹇朝, 马瑞彦, 王咏, 等. 缺氧诱导因子-1α在紫绀型先心病患儿心肌中的表达[J]. 第三军医大学学报, 2009, 31(12): 1189-1192. |
| [7] | El-Hasnaoui-Saadani R, Marchant D, Pichon A, et al. Epo deficiency alters cardiac adaptation to chronic hypoxia[J]. Respir Physiol Neurobiol, 2013, 186(2): 146-154. |
| [8] | Semenza G L.Oxygen sensing, hypoxia-inducible factors, and disease pathophysiology[J]. Annu Rev Pathol, 2014, 9: 47-71. |
| [9] | Najm H K, Wallen W J, Belanger M P, et al. Does the degree of cyanosis affect myocardial adenosine triphosphate levels and function in children undergoing surgical procedures for congenital heart disease?[J]. J Thorac Cardiovasc Surg, 2000, 119(3): 515-524. |
| [10] | Wittnich C, Torrance S M, Carlyle C E. Effects of hyperoxia on neonatal myocardial energy status and response to global ischemia[J]. Ann Thorac Surg, 2000, 70(6): 2125-2131. |
| [11] | Carling D, Mayer F V, Sanders M J, et al. AMP-activated protein kinase: nature's energy sensor[J]. Nat Chem Biol, 2011, 7(8): 512-518. |
| [12] | Iwabu M, Yamauchi T, Okada-Iwabu M, et al. Adiponectin and AdipoR1 regulate PGC-1alpha and mitochondria by Ca(2+) and AMPK/SIRT1[J]. Nature, 2010, 464(7293): 1313-1319. |
| [13] | Ventura-Clapier R, Garnier A, Veksler V. Transcriptional control of mitochondrial biogenesis: the central role of PGC-1alpha[J]. Cardiovasc Res, 2008, 79(2): 208-217. |
| [14] | Qi J, Gong J, Zhao T, et al. Downregulation of AMP-activated protein kinase by Cidea-mediated ubiquitination and degradation in brown adipose tissue[J]. EMBO J, 2008, 27(11): 1537-1548. |
| [15] | Al-Hakim A K, Zagorska A, Chapman L, et al. Control of AMPK-related kinases by USP9X and atypical Lys(29)/Lys(33)-linked polyubiquitin chains[J]. Biochem J, 2008, 411(2): 249-260. |



