自组装多肽作为一种人工合成的、结构类似于天然细胞外基质(ECM)的凝胶支架,可以在水溶液中自发组装成网状纳米纤维,并且在与盐离子相遇时迅速成形。纤维直径10~20 nm,孔径5~200 nm,水容量>99%。与传统支架材料相比,自组装多肽纳米纤维水凝胶具有结构稳定、有良好的生物相容性、可降解、无毒性及免疫原性等优点,成为新型组织工程支架材料研究方向之一[3, 4, 5]。自组装多肽RADA16-Ⅰ(AcN-RADARADARADARADA-CONH2)由天然氨基酸合成,其形成的水凝胶支架能够为细胞培养提供良好条件[6]。最近,多个有生物活性的肽序列(如RGD、SKP等)被用来修饰RADA16-Ⅰ构建功能化自组装多肽水凝胶支架。研究表明,这些功能化自组装多肽水凝胶支架较纯的RADA16-Ⅰ水凝胶支架促进了细胞的增殖和分化。Ⅰ型胶原是骨组织中的重要构成成分,是重要的骨支架来源,而其中的DGEA(Asp-Gly-Glu-Ala)序列能够与α2β1整合素受体作用,促进细胞粘附[7, 8]。细胞与材料的粘附是细胞在材料表面迁移、增殖和分化的前提。基于此,我们通过固相合成法[9]将DGEA结合到RADA16-Ⅰ的C端,合成功能化自组装多肽RADA16-DGEA (AcN-RADARADARADARADA-GG-DGEA-CONH2),以期获得一种有良好细胞粘附效果的支架材料。预实验表明DGEA肽不能自组装成纤维结构,也不能形成水凝胶;RADA16-DGEA能组装成短纳米纤维,但纤维间不相互搭载,并且不能形成水凝胶;将RADA16-DGEA和RADA16-Ⅰ等比混合制备成的DGEAmx可以形成纤维网状结构和水凝胶。本实验将MMCs接种至RADA16-Ⅰ和DGEAmx支架上培养,研究小鼠MSCs在支架材料上的粘附、增殖和分化情况,为其进一步作为骨组织工程支架的体内研究提供实验依据。
1 材料与方法 1.1 实验材料及主要试剂C57BL/6小鼠骨髓间充质干细胞(mesenchymal stem cells,MSCs)由第三军医大学国家-地方联合组织 工程实验室提供,多肽DGEA(相对分子质量431.25)、 RADA16-Ⅰ(相对分子质量1 712.76)和RADA16-DGEA(相对分子质量2 199.21)由上海强耀生物科技有限公司合成和纯化(纯度≥95%),C57BL/6小鼠骨髓间质干细胞完全培养基、C57BL/6小鼠骨髓间质干细胞成骨诱导分化培养基(广州赛业),0.25%胰蛋白酶(HyClone),14 mm圆形盖玻片(NEST),CCK-8检测试剂盒(Sigma),碱性磷酸酶检测试剂盒(建成,中国),逆转录试剂盒及荧光定量PCR试剂盒(Life technologies)。
1.2 实验仪器低速离心机(Thermo,德国),倒置显微镜(OLYMPUS,日本),超声波清洗机(Kejingda,中国),原子力显微镜(Asylum Research,美国),激光共聚焦荧光显微镜 (Nikon,日本),酶标仪(Varioskan Flash,美国)。
1.3 实验方法 1.3.1 制备自组装多肽溶液10 mg肽粉溶于 1 mL 超纯水中,混匀后用超声处理30 min去除粘性,得到1%质量体积比的母液。将RADA16-DGEA母液与RADA16-Ⅰ母液按体积比1 ∶1混合,得到1%DGEAmx母液。
1.3.2 原子力显微镜观察自组装纳米多肽的纤维结构将DGEA、RADA16-Ⅰ、RADA16-DGEA和DGEAmx的母液用超纯水稀释20倍,各取5 μL稀释液分别滴加到新剥开的云母片上,15 s后用100 μL超纯水冲洗3次,去除未粘附材料。待云母片上肽样品自然干燥后用原子力显微镜观察[10]。 操作模式为轻敲模式,扫描探针参数为矩形基座200 μm,针高10 μm,弹性系数8 N/m,Si尖端半径为10 nm,扫描区域为2 μm×2 μm,扫描频率是1.0 Hz。
1.3.3 MSCs接种到水凝胶上将1% RADA16-Ⅰ和DGEAmx母液分别与20%无菌蔗糖溶液等体积混合,配制成0.5%水凝胶工作液。将14 mm圆形盖玻片放置在24孔培养板孔内,100 μL工作液滴加在盖玻片上。缓慢向孔内加入1 mL完全培养基,将培养板 放于 37 ℃培养箱中静置40 min。凝胶成型后,更换2次培养基以平衡pH,间隔 30 min,每次更换2/3~3/4 体积的培养基。然后将培养板放置于 37 ℃培养箱中过夜。吸净孔内培养基后,将传至第3代的间充质干细胞悬液用完全培养基重悬成1×105个/mL细胞悬液,每孔加入500 μL。培养板置于37 ℃ 细胞培养箱中,第2天换液,此后每隔1 d 换液1 次。
1.3.4 倒置显微镜下细胞粘附情况在24孔板内放置盖玻片并用RADA16-Ⅰ和DGEAmx成胶。在盖玻片、RADA16-Ⅰ水凝胶、DGEAmx水凝胶上接种MSCs,分别在第10、30、60、90分钟吸净孔内培养基,PBS洗3 次去除未粘附细胞,并对材料上的贴壁细胞进行拍照。随机选取视野对贴壁细胞计数。
1.3.5 CCK-8法检测水凝胶上细胞的增殖情况在96孔培养板分别滴加50 μL RADA16-Ⅰ和DGEAmx工作液,成胶后分别在空白孔、RADA16-Ⅰ水凝胶、DGEAmx水凝胶上滴加100 μL密度为3×104个/mL 的第3代MSCs细胞悬液。在培养的第1、3、5、7天,每组中各取1个孔加入1 μL CCK-8 溶液,37 ℃孵育1 h,以酶标仪在450 nm波长处测光密度值[D(450)]。将各测试孔的D(450)减去调零孔D(450)。
1.3.6 激光共聚焦荧光显微镜观察MSCs在水凝胶表面的生长形态在24孔细胞培养板中放置盖玻片,分别用RADA16-Ⅰ和DGEAmx成胶,在空白孔、RADA16-Ⅰ 水凝胶、DGEAmx水凝胶上加入3×104个/孔 的第3代MSCs。分化培养14 d后,吸尽孔内液体,PBS清洗3次,4%多聚甲醛固定30 min,用PBS清洗3次,0.2%Triton X-100处理10min,PBS清洗3次,5%BSA封闭1 h,PBS清洗3次,加入罗丹明-鬼笔环肽(5 U/mL)溶液浸没样本,室温孵育30 min,PBS清洗3次,用10 μg/mL的DAPI染色5 min。PBS清洗3次,滴加抗荧光淬灭封片液封片。激光共聚焦荧光显微镜观察并拍照。
1.3.7 水凝胶对MSCs成骨分化的影响在6孔细胞培养板中分别用RADA16-Ⅰ和DGEAmx成胶,在空白孔、RADA16-Ⅰ水凝胶、DGEAmx水凝胶上加入3×104个/孔的第3代MSCs。分化培养3、7、14 d后,吸尽孔内液体,用PBS清洗3次,每孔加入100 μL细胞裂解液并反复吹打。镜下观察已无完整细胞结构,按ALP活性检测试剂盒说明检测ALP活性。空白管调零后在酶标仪520 nm波长测各孔光密度值D(520)。
将第3代MSCs按3×104个/孔的数量接种到 6孔培养板的空白孔、RADA16-Ⅰ水凝胶和DGEAmx水凝胶上,以成骨诱导分化培养基培养,每隔1 d换液1次。在第3、7、14天时将各组培养基去除后,PBS清洗3次,按TRIzol试剂说明书操作提取细胞总RNA,并按反转录试剂盒说明书以30 μL体系将1 μg各组RNA反转录为cDNA。随后按照TaKaRa SYBR Green一步法定量PCR试剂盒说明书操作,进行荧光定量PCR检测,体系为25 μL,95 ℃预温5 min,随后进行95 ℃ 5 s和60 ℃ 30 s共40个循环的扩增,最后72 ℃延伸2 min,并进行溶解曲线的测定。引物根据NCBI上Primer-BLAST设计并经过比对,引物序列及扩增片段长度大小为: ICAM-1正向引物:5′-AGCGGCTGACGTGTGCAGTAAT-3′,反向引物:5′-TCTGAGACCTCTGGC-TTCGTCA-3′,115 bp; OCN正向引物:5′-CGCTACCTGTATCAATGGCTGG-3′,反向引物:5′-CTCCTGAAAGCC-GATGTGGTCA-3′,123 bp;β-actin正向引物:5′-CACCATTGGCAATGAGCGGTTC-3′,反向引物:5′-AGGTCT-TTGCGGATGTCCACGT-3′,135 bp。结果以Ct值表示,β-actin为内参照,以2-ΔΔCt计算基因相对表达量。
1.4 统计学处理数据以x±s表示,采用SPSS 13.0统计软件对数据进行单因素方差分析。
2 结果 2.1 自组装水凝胶的鉴定原子力显微镜下观察DGEA、RADA16-Ⅰ、RADA16- DGEA和DGEAmx自组装的结构。如图 1所示,DGEA不能形成纤维结构,RADA16-DGEA自组装成短的纳米纤维且纤维之间不相互搭载,提示加入功能序列会影响到RADA16-Ⅰβ折叠结构形成,从而中断长纳米纤维的 自组装[10]。当一定量的RADA16-Ⅰ 加入RADA16- DGEA肽溶液,DGEAmx形成均匀的长纳米纤维。RADA16-Ⅰ 和DGEAmx纤维直径为(13.6±1.3)nm和(16.1±1.5)nm。纳米纤维交织形成网状结构,之间有较大空隙。
 |
| A:DGEA;B:RADA16-Ⅰ;C:RADA16-DGEA ;D:DGEAmx图 1 原子力显微镜观察不同材料的纳米级结构 |
将细胞计数所得数据除以盖玻片面积作为细胞密度(cell/cm2) ,细胞接种后第10、30、60和90分钟各组细胞的平均密度经统计学处理,在第10分钟时各组间无显著性差异(P>0.05);第30、60、90分钟时,3组间分别有显著性差异 (P<0.05,图 2)。
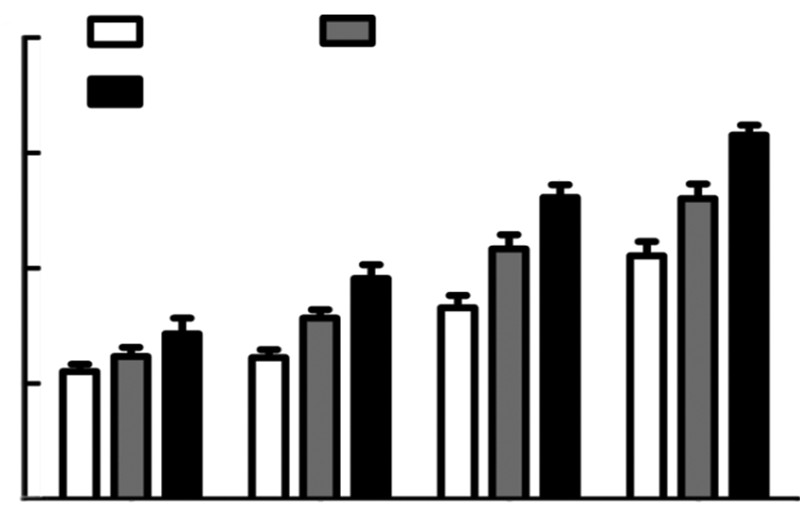 |
| a: P<0.05,与空白组比较;b: P<0.05,与RADA16-Ⅰ组比图 2 细胞计数法检测不同时相点MSCs在3组材料表面的粘附细胞数变化 |
CCK-8检测细胞增殖结果如图 3所示。经统计学处理,培养第1天各组间无显著性差异(P>0.05),第
3天DGEAmx组与空白组有显著性差异(P<0.05),第5天各组间有显著性差异(P<0.05),第7天RADA16-Ⅰ组与空白组无显著性差异(P>0.05),而DGEAmx组与其他2组分别有显著性差异(P<0.05)。
 |
| 图 3 CCK-8法检测MSCs在3组材料表面培养不同时间的增殖变化 |
试剂盒检测ALP活性结果经统计学处理,在第3、7、14天时,各组间均具有显著性差异(P<0.05,图 4)。提示在DGEAmx凝胶支架材料表面生长的成骨细胞能够表达更高的碱性磷酸酶活性(图 5)。
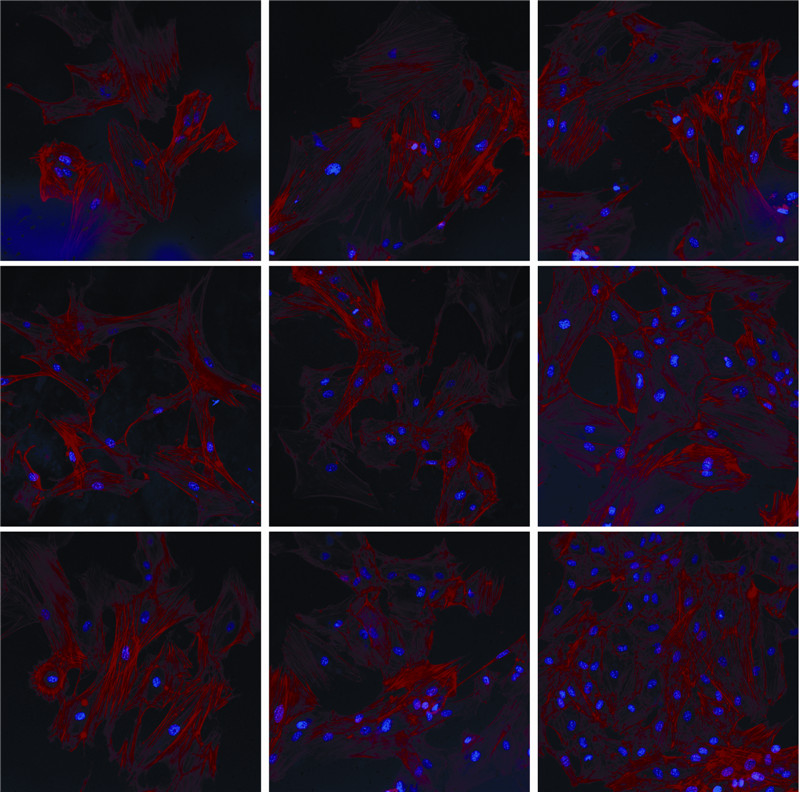 |
| A、B、C:分别为MSCs在盖玻片上分化培养3、7、14 d;D、E、F:分别为MSCs在RADA16-Ⅰ水凝胶上分化培养3、7、14 d;G、H、I:分别为MSCs在DGEAmx水凝胶上分化培养3、7、14 d图 4 激光共聚焦显微镜观察MSCs在3组材料表面分化培养不同时间点的生长形态(×200) |
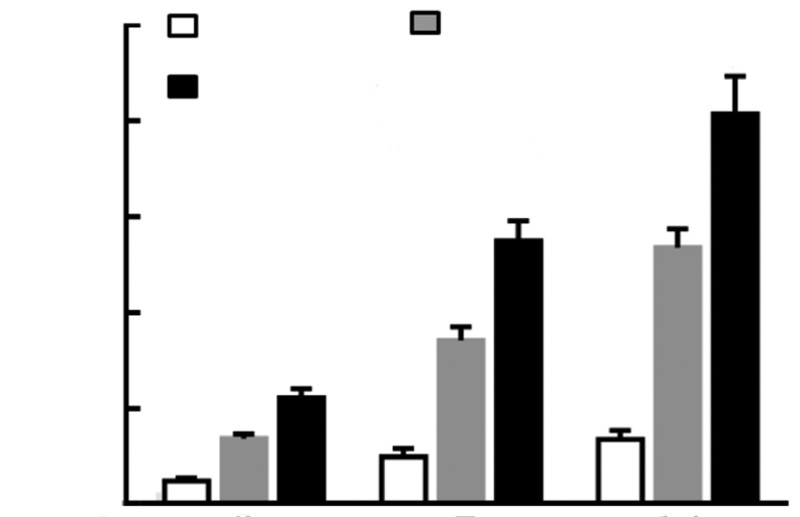 |
| a: P<0.05,与空白组比较;b: P<0.05,与RADA16-Ⅰ 组比较图 5 MSCs在3组材料表面培养不同时间的碱性磷酸酶活性检测结果 |
Real-time PCR结果显示,MSCs经成骨诱导分化培养第3、7、14天时,对比空白组和RADA16-Ⅰ组,在DGEAmx组有更高的ICAM-1和OCN的表达(P<0.05,图 6)。
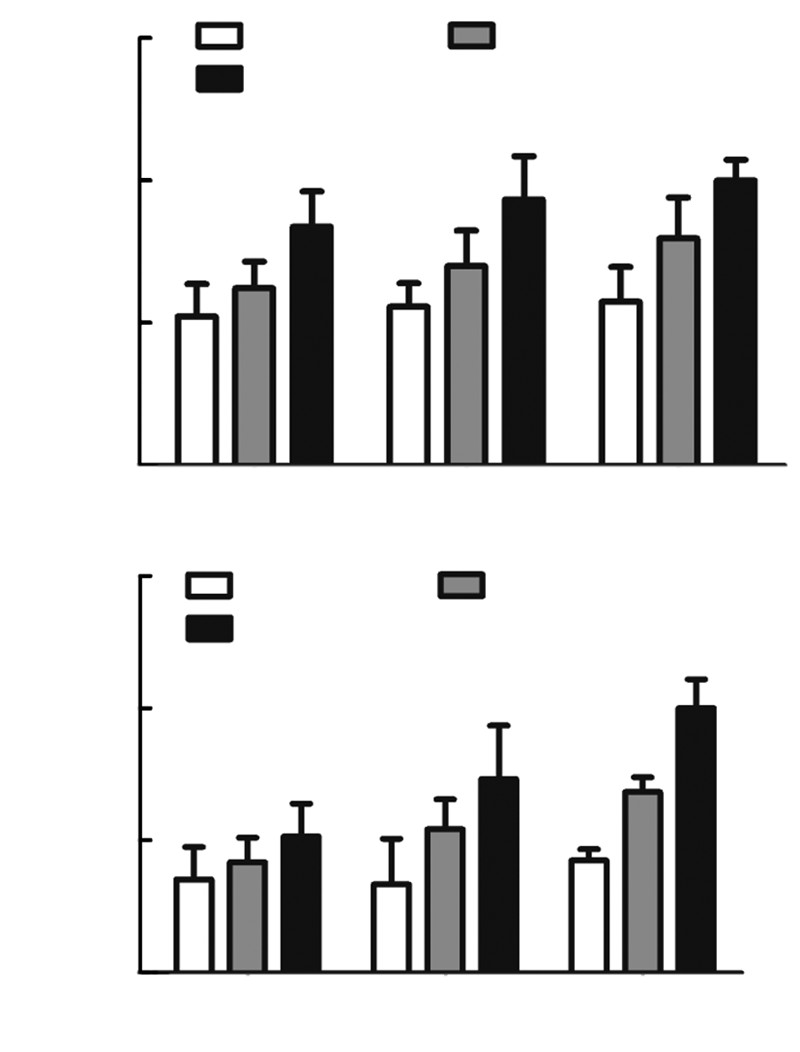 |
| A:ICAM-1;B:OCN a:P<0.05,与DGEAmx组比较 图 6 Real-time PCR检测不同时间MSCs在3组材料表面ICAM-1和OCN基因的表达 |
自组装多肽纳米纤维水凝胶支架材料在细胞培养、组织工程、再生医学等研究领域有广泛的应用前景[11, 12, 13]。自组装多肽溶解后迅速形成纳米纤维,并在接触盐离子后形成水凝胶支架材料。这种纳米纤维支架形成与细胞外基质相类似的结构,含水量高并且具有高孔隙度,是培养组织细胞的良好载体。由于这类材料是由天然氨基酸合成,降解产物没有毒性,可以避 免引起炎症反应和免疫反应。相关研究已证明RADA16-Ⅰ 可以增强细胞增殖和生长因子分泌能力[14, 15, 16]。此外,还可以通过在其C端用肽合成固相法将具有不同功能的短生物活性多肽片段(一般不超过15个氨基酸片段)与其结合,构建新型功能化自组装多肽纳米纤维水凝胶支架材料,从而提高其生物学活性[5]。Horii等[3]将功能基序AKL、DGR和PRG分别结合到RAD16- ⅠC端,并与RAD16-Ⅰ混合制备的三维支架可增强MC3T3-E1 细胞的粘附、增殖和成骨分化能力;Pan等[17]用BMP-2 相关蛋白(P24)修饰RAD16-Ⅰ形成RAD16-P24,再混合聚乳酸- 羟基乙酸共聚物形成复合材料,研究表明这种复合材料增强了BMSCs 的增殖、粘附能力和异位骨形成。 尽管功能化自组装多肽延长了RADA16-I的C末端后会影响自组装多肽原有的凝胶性,提示功能序列影响到RADA16-Ⅰ β折叠结构形成,从而中断长纳米纤维的自组装,但当其与RADA16-Ⅰ等体积混合后,表现出与RADA16-I相似的凝胶特性。
细胞与材料的粘附是细胞在材料表面迁移、增殖与分化的前提。但将有粘附功能序列DGEA与RAD16- Ⅰ复合并检测其对MSCs的快速粘附效果未见相关报道。我们将在细胞粘附中有着重要作用的DGEA序列与RADA16-Ⅰ多肽的C 末端相连,成功复合构建了自组装多肽纳米凝胶支架DGEAmx。DGEAmx的微观结构与经典的RADA16-Ⅰ类似,能够模拟细胞外基质环境。本研究中,我们把小鼠MSCs接种到RADA16-Ⅰ、RAD/DGEA水凝胶支架上体外培养,观察支架材料上细胞的粘附、增殖和分化情况。在 接种MSCs后第30、60、90分钟时,DGEAmx的粘附率较RADA16- Ⅰ 有显著增强(P<0.05)。CCK-8法检测细胞增殖情况证实,MSCs在DGEAmx上对比在RADA16 -Ⅰ上有更高的增殖速率。当在特定的分化刺激培养条件下,肽水凝胶支架支持接种的MSCs向成骨细胞分化。ALP是细胞向成骨细胞分化的重要指标,其活性与成骨细胞分化呈正相关[16]。本实验相关 结果提示在DGEAmx水凝胶上分化培养的MSCs的ALP活性及成骨相关基因ICAM-1和OCN的表达明显高于RADA16-Ⅰ (P<0.05)。上述结果表明,与经典的自组装多肽RADA16-Ⅰ相比,DGEAmx是更适合MSCs体外培养的支架材料。
自组装多肽纳米纤维支架能作为骨细胞和生长因子的良好载体,并且由于其力学方面的特性,作为注射材料填充不规则和微小骨缺损有明显优势[18]。但对于大段骨缺损和承重部位骨缺损难以提供有效支撑。将自组装多肽水凝胶作为修饰材料,修饰脱钙骨基质(demineralized bone matrix,DBM)、羟基磷灰石(hydro-xyapatite,HA)等传统支架材料,构成的复合支架材料,不仅具有较强的力学性能,而且保持了自组装肽纳米纤维支架良好的生物活性,为该材料进一步的体内研究和临床应用奠定了理论基础和提供了实验依据[19, 20]。
| [1] | 秦蕴豪, 张长青. 间充质干细胞促进骨再生的生物学基础及应用[J]. 中华创伤骨科杂志, 2014, 16(6): 533-536. |
| [2] | Pittenger M F, Mackay A M, Beck S C, et al. Multilineage potential of adult human mesenchymal stem cells[J]. Science, 1999, 284(5411): 143-147. |
| [3] | Horii A, Wang X, Gelain F, et al. Biological designer self-assembling peptide nanofiber scaffolds significantly enhance osteoblast proliferation, differentiation and 3-D migration[J]. PLoS One, 2007, 2(2): e190. |
| [4] | Nakahara H, Misawa H, Yoshida A, et al. Bone repair using a hybrid scaffold of self-assembling peptide PuraMatrix and polyetheretherketone cage in rats[J]. Cell Transplant, 2010, 19(6): 791-797. |
| [5] | Gelain F, Bottai D, Vescovi A, et al. Designer self-assembling peptide nanofiber scaffolds for adult mouse neural stem cell 3-dimensional cultures[J]. PLoS One, 2006, 1(1): e119. |
| [6] | 李志强, 侯天勇, 罗飞, 等. 自组装肽复合脱钙骨基质作为骨髓富集支架材料的实验研究[J]. 第三军医大学学报, 2011, 33(5): 441-444. |
| [7] | Yoshimi R, Yamada Y, Ito K, et al. Self-assembling peptide nanofiber scaffolds, platelet-rich plasma, and mesenchymal stem cells for injectable bone regeneration with tissue engineering[J]. J Craniofac Surg, 2009, 20(5): 1523-1530. |
| [8] | Yoo S Y, Kobayashi M, Lee P P, et al. Early osteogenic differentiation of mouse preosteoblasts induced by collagen-derived DGEA-peptide on nanofibrous phage tissue matrices[J]. Biomacromolecules, 2011, 12(4): 987-996. |
| [9] | Genove E, Shen C, Zhang S, et al. The effect of functionalized self-assembling peptide scaffolds on human aortic endothelial cell function[J]. Biomaterials, 2005, 26(16): 3341-3351. |
| [10] | Liu X, Wang X, Wang X, et al. Functionalized self-assembling peptide nanofiber hydrogels mimic stem cell niche to control human adipose stem cell behavior in vitro[J]. Acta Biomater, 2013, 9(6): 6798-6805. |
| [11] | Matson J B, Zha R H, Stupp S I. Peptide self-assembly for crafting functional biological materials[J]. Curr Opin Solid State Mater Sci, 2011, 15(6): 225-235. |
| [12] | Branco M C, Schneider J P. Self-assembling materials for therapeutic delivery[J]. Acta Biomater, 2009, 5(3): 817-831. |
| [13] | Degano I R, Quintana L, Vilalta M, et al. The effect of self-assembling peptide nanofiber scaffolds on mouse embryonic fibroblast implantation and proliferation[J]. Biomaterials, 2009, 30(6): 1156-1165. |
| [14] | Mi K, Wang G, Liu Z, et al. Influence of a self-assembling peptide, RADA16, compared with collagen I and Matrigel on the malignant phenotype of human breast-cancer cells in 3D cultures and in vivo[J]. Macromol Biosci, 2009, 9(5): 437-443. |
| [15] | Hamada K, Hirose M, Yamashita T, et al. Spatial distribution of mineralized bone matrix produced by marrow mesenchymal stem cells in self-assembling peptide hydrogel scaffold[J]. J Biomed Mater Res A, 2008, 84(1): 128-136. |
| [16] | Tang C, Shao X, Sun B, et al. The effect of self-assembling peptide RADA16-I on the growth of human leukemia cells in vitro and in nude mice[J]. Int J Mol Sci, 2009, 10(5): 2136-2145. |
| [17] | Pan H, Hao S, Zheng Q, et al. Bone induction by biomimetic PLGA copolymer loaded with a novel synthetic RADA16-P24 peptide in vivo[J]. Mater Sci Eng C Mater Biol Appl, 2013, 33(6): 3336-3345. |
| [18] | Firth A, Aggeli A, Burke J L, et al. Biomimetic self-assembling peptides as injectable scaffolds for hard tissue engineering[J]. Nanomedicine (Lond), 2006, 1(2): 189-199. |
| [19] | Hou T, Li Z, Luo F, et al. A composite demineralized bone matrix——self assembling peptide scaffold for enhancing cell and growth factor activity in bone marrow[J]. Biomaterials, 2014, 35(22): 5689-5699. |
| [20] | Xia Y, Peng S S, Xie L Z, et al. A novel combination of nano-scaffolds with micro-scaffolds to mimic extracellularmatrices improve osteogenesis[J]. J Biomater Appl, 2013, 29(1): 59-71. |



