2Institute of Immunology, College of Basic Medical Sciences, Third Military Medical University, Chongqing, 400038, China
骨骼肌萎缩是重症烧伤患者常出现的并发症,肌萎缩将严重影响患者呼吸功能、运动功能,并可破坏机体能量代谢稳态,因此它已成为决定烧伤患者预后的重要因素之一[1, 2, 3]。目前认为疾病状态下骨骼肌代谢异常是导致骨骼肌消耗增加,肌肉组织不断萎缩的重要原因[4]。大多数研究集中在骨骼肌蛋白合成与分解代谢障碍,而对骨骼肌中脂肪代谢关注不够[5]。新近研究发现,烧伤后脂肪酸在骨骼肌中的代谢模式明显异常,是导致烧伤伤后骨骼肌中糖、蛋白代谢异常的重要诱因[6, 7]。骨骼肌脂质沉积(intramyocellular lipids,IMCLs)是烧伤伤后骨骼肌脂代谢紊乱典型的病理表现,不仅如此,IMCLs可严重干扰其他物质在骨骼肌中的代谢,由IMCLs造成的“脂毒性”已成为预测烧伤后骨骼肌发生胰岛素抵抗以及线粒体功能障碍严重程度的有效生物学指标[6]。目前,关于烧伤后IMCLs的研究,重点解释了IMCLs的后效应,却忽视了IMCLs的形成原因。针对IMCLs形成机制的研究,是解决烧伤后骨骼肌代谢紊乱的关键步骤。合成大于分解是脂质沉积的根本原因,骨骼肌缺乏合成脂质的关键酶,因此研究认为脂质氧化分解障碍是导致伤后IMCLs最重要的原因[6, 8]。腺苷酸激活蛋白激酶(AMP activated protein kinase,AMPK)/乙酰辅酶a羧化酶(acetyl CoA carboxylase,ACC)作为调控脂肪酸分解代谢的核心通路,可根据肌细胞内能量变化调节肉碱脂酰转移酶-1(carnitine palmitoyl transferase-1,CPT1)活性,进而调控脂肪酸β氧化。去磷酸化的ACC是ACC的活性状态,它催化合成的丙二酰CoA(malonyl-CoA,MA)能够抑制CPT1,CPT1是脂肪酸转入线粒体过程中的限速酶,CPT1活性降低将阻止长链脂肪酸转移至线粒体内膜,最终形成IMCLs[8, 9, 10]。因此,肌细胞内AMPK/ACC磷酸化障碍可能是伤后IMCLs的重要原因之一。本研究将在观察烧伤后骨骼肌中AMPK/ACC磷酸化变化的基础上,探讨影响AMPK/ACC磷酸化导致IMCLs的分子机制。
1 材料与方法 1.1 材料 1.1.1 实验动物清洁级雄性BALB/c小鼠54只,4周龄,体质量(25±5)g,由第三军医大学实验动物中 心提供。标准动物饲料喂养,饲养室温度为22~23 ℃,环境湿度为50%,动物观察1周后用于实验。
1.1.2 主要试剂AMPK激活剂(acadesine,AICAR)、油红O(上海生工),甘油三酯(TG)试剂盒、CPT1试剂盒(南京建成生物研究所),兔抗鼠ACC、AMPK-α、p-ACC、p-AMPK-α(Thr-172)多克隆抗体(美国Abcam公司),辣根酶标记山羊抗兔IgG(北京中杉金桥生物技术有限公司)。
1.2 方法 1.2.1 动物分组和观察时相设置54只BALB/c小鼠按随机数字表法分成4组:正常对照组、AICAR组、烧伤组、烧伤+AICAR组。其中烧伤组观察时相为伤后(post bum day,PBD)1、2、3、5、7、14 d。每组每个时相点6只小鼠。
1.2.2 烧伤模型制作实验前1 d晚禁食,不限水。小鼠1%戊巴比妥钠(40 mL/kg)腹腔麻醉,背部电推剃毛,称质量后置剃毛区于90 ℃水浴中9 s,造成30%体表面积Ⅲ度烧伤(病理切片证实为Ⅲ度)。伤后按40 mL/kg腹腔注入乳酸林格液抗休克。创面涂2%碘酊抗感染,每天2次,伤后给予标准动物颗粒饲料,自由进食水。正常对照组、AICAR组均不予烧伤,麻醉剃毛后背部浸入37 ℃温水中9 s。
1.2.3 实验实施方案AICAR组:正常小鼠腹腔 注AICAR(200 mg/kg),2 mL,每日1次,共14 d;烧伤+ AICAR组:烫伤小鼠伤后12 h开始第1次腹腔注AICAR(200 mg/kg),2 mL,每日1次,共14 d。
1.2.4 CPT1活性检测剪碎腓肠肌,用匀浆器搅拌并置于预冷的分离介质(220 mmol/L 甘露醇,70 mmol/L 蔗糖,2 mmol/L 4-羟乙基哌嗪乙磺酸,0.1 mmol/L 四乙酸二氨基乙烷,pH 7.4)。4 ℃离心(1 000×g,12 min,2次),弃沉淀物,留上清液。再经4 ℃离心(8 500×g,10 min,2次);所得沉淀即为腓肠肌线粒体。采用CPTI酶试剂盒测定。
1.2.5 Western blot检测取30 μg腓肠肌组织蛋白于10% SDS-PAGE凝胶中电泳,电转移至聚偏二氟乙烯(PVDF)膜上。含5% BSA的Tris-Buffered Saline Tween-20(TBST)封闭2 h后,分别将anti-ACC (1 ∶500),anti-AMPK alpha(1 ∶500),anti-p-ACC(1 ∶1 000) 和anti-p-AMPK alpha(Thr172,1 ∶1 000),4 ℃孵育过夜,TBST洗膜6次,5 min/次,将辣根酶标记山羊抗兔IgG用含5% BSA的TBST稀释(1 ∶5 000),室温孵育2 h,TBST洗膜6次,5 min/次。采用超敏化学发光检测试剂盒显影、洗片、显带,分析测量图像软件Image Pro Plus(IPP)对条带进行光密度分析。
1.2.6 甘油三酯(triglyceride,TG)测定取整块腓 肠肌,以生理盐水匀浆制备10%的匀浆液,离心(900×g,10 min,1次)。取上清液,使用甘油-3-磷酸激酶氧化法(glycerate-3-phosphate kinase oxidation,GK-GPO),经酶标仪分析(波长500 nm)测定TG含量。
1.2.7 油红O染色观察取整块腓肠肌,制作冰冻切片,切厚为8 μm切片,将切片完整地贴在载玻片上,-20 ℃保存备用。0.2 g油红O溶于100 mL异丙醇作为储存液,按储存液与双蒸水体积比3 ∶2混合,静置10 min后滤纸过滤新鲜配制油红O工作液。冰冻切片从-20 ℃冰箱拿出,晾干后用PBS清洗玻片3次,60%异丙醇。去离子水清洗2次,室温下油红O工作液染色30 min,60%异丙醇漂洗30 s,蒸馏水洗3次。苏木精复染1 min,流水漂洗5 min。干燥后甘油明胶封片,光镜下观察组织内脂质沉积情况。
1.3 统计学处理采用SPSS 19.0统计软件,计量资料数据以x±s表示,行单因素方差分析。
2 结果 2.1 烧伤小鼠腓肠肌中CPT1活性的变化与正常对照组相比,烧伤组小鼠腓肠肌中CPT1活性在烧伤后1、2 d变化不明显(P>0.05),伤后第3、5、7、14天CPT1活性显著减低(P<0.05,图 1)。
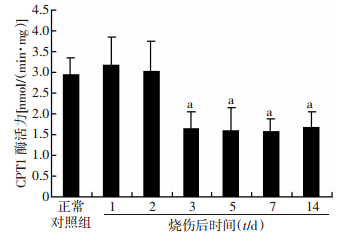 |
| a:P<0.05,与正常对照组比较图 1 同位素标记检测烧伤小鼠腓肠肌CPT1活性的变化 |
Western blot检测结果显示,与正常对照组相比,烧伤组小鼠腓肠肌中ACC在烧伤后1、2、3、5 d变化不明显(P>0.05),伤后第7、14天ACC显著升高(P<0.05)。烧伤小鼠腓肠肌组织中ACC磷酸化水平在伤后第2天开始降低,伤后第3、5、7、14天持续低表达(P<0.05,图 2)。
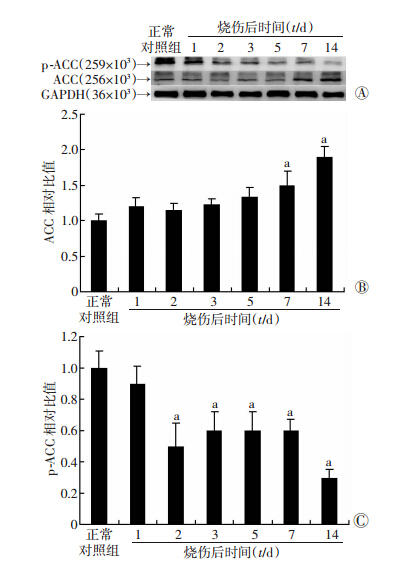 |
| A:Western blot检测结果;B:ACC半定量分析结果;C:p-ACC半定量分析结果 a:P<0.05,与正常对照组比较图 2 Western blot检测烧伤小鼠腓肠肌中ACC和p-ACC蛋白的变化 |
Western blot检测结果显示,与正常对照组相比,烧伤组小鼠腓肠肌组织中AMPK-α亚基在伤后2周内均明显降低(P<0.05)。小鼠烧伤后第2、3、5、7、14天腓肠肌组织中AMPK-α磷酸化较伤前显著降低(P<0.05,图 3)。
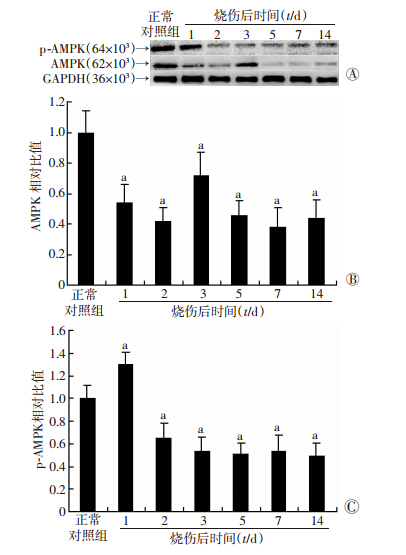 |
| A:Western blot检测结果;B:AMPK半定量分析结果;C:p-AMPK半定量分析结果 a:P<0.05,与正常对照组比较图 3 Western blot检测烧伤小鼠腓肠肌中AMPK和p-AMPK蛋白的变化 |
Western blot检测结果显示,AICAR能使正常小鼠腓肠肌中p-AMPK-α和p-ACC表达显著升高(P<0.05)。而对于烧伤小鼠,AICAR对腓肠肌中p-AMPK-α和p-ACC表达无显著影响(P>0.05,图 4)。
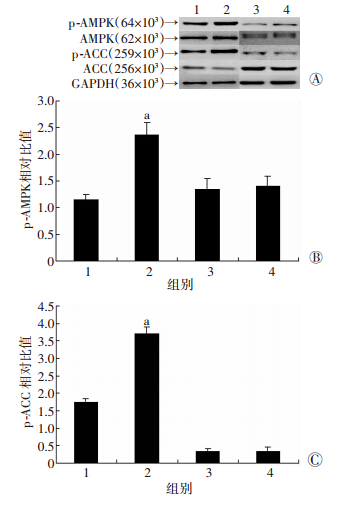 |
| 1:正常对照组;2:AICAR组;3:烧伤组;4:烧伤+AICAR组 A:Western blot检测结果;B:p-AMPK半定量分析结果;C:p-ACC半定量分析结果 a:P<0.05,与正常对照组比较图 4 Western blot检测AICAR对烧伤小鼠腓肠肌AMPK-α、p-AMPK-α、ACC及p-ACC表达的影响 |
与正常小鼠比较,AICAR能使正常小鼠腓肠肌中CPT1活性显著升高[(2.95±0.39)nmol/(min·mg) vs (6.35±0.68)nmol/ (min·mg),P<0.05]。而对于烧伤小鼠,AICAR对腓肠肌中CPT1活性无显著影响[(1.56±0.37)nmol/(min·mg) vs (1.67±0.39)nmol /(min·mg),P>0.05]。
2.6 AICAR干预下烧伤后骨骼肌组织中脂质沉积的变化①经酶标仪分析测定TG含量:AICAR作用下的正常小鼠腓肠肌中TG含量明显降低[(3.88±0.40)mmol/g vs (2.89±0.54) mmol/g,P<0.05],AICAR作 用下的烧伤小鼠腓肠肌中TG含量无明显变化[(5.91± 0.63)mmol/g vs (5.88±0.41)mmol/g, P>0.05]。②应用油红O染色结果显示:正常对照组、AICAR组未见明显脂质沉积,而烧伤组和烧伤+AICAR组小鼠腓肠肌切片中均有明显的脂质沉积,并且两组之间无明显差异(表 1,图 5)。
| 组别 | 脂滴面积/肌纤维总面积 | 光密度平均值 | |||
| 正常对照组 | 0.33±0.10 | 0.58±0.07 | |||
| AICAR组 | 0.27±0.10a | 0.34±0.12a | |||
| 烧伤组 | 0.77±0.14a | 1.17±0.22a | |||
| 烧伤+AICAR组 | 0.78±0.11a | 1.16±0.27a | |||
| a:P<0.05,与正常对照组比较 | |||||
 |
| A:正常对照组;B:AICAR组;C:烧伤组;D:烧伤+AICAR组图 5 油红O染色检测AICAR对烧伤小鼠IMCLs的影响 |
烧伤后IMCLs可导致骨骼肌发生严重的胰岛素抵抗、线粒体功能障碍,并加速肌细胞凋亡[6]。毋庸置疑,针对IMCLs形成机制的研究,是解决烧伤后骨骼肌代谢紊乱的重要途径。脂代谢相关酶的异常是烧伤后IMCLs的重要分子基础[6, 7, 8]。本研究结果显示:与正常对照组相比,烧伤组小鼠腓肠肌中CPT1活性在伤后3、5、7、14 d显著降低,CPT1是脂肪酸β氧化过程中的限速酶,烧伤所致的CPT1活性降低将阻止长链脂肪酸转移至线粒体内膜,从而促使大量脂质在肌细胞中沉积。因此,骨骼肌中CPT1活性变化可能是烧伤后IMCLs的重要原因之一。
骨骼肌中CPT1活性与AMPK/ACC信号通路密切相关,AMPK/ACC信号通路通过调节CPT1活性参与调控脂质代谢[9]。本研究发现,与正常对照组相比,烧伤组小鼠腓肠肌中ACC在伤后第7、14天显著升高,而p-ACC在伤后2 d开始降低,并持续至伤后2周,研究结果进一步显示:烧伤小鼠腓肠肌中p-AMPK-α在伤后第2、3、5、7、14天较伤前显著降低。当AMPK/ACC磷酸化被抑制,去磷酸化ACC增加,ACC活性增强,CPT1活性势必降低。根据骨骼肌中AMPK、ACC及CPT1在伤后2周内的动态变化,我们认为烧伤后骨骼肌中AMPK/ACC/CPT1信号通路被持续抑制,将严重阻碍脂肪酸分解代谢。
AICAR是外源性的AMPK激动剂,可不依赖于AMP直接激活AMPK,使ACC活性减低,从而促进脂肪酸β氧化,因此AICAR可能成为改善烧伤后IMCLs的有效制剂[11]。本研究发现,在AICAR作用下,正常小鼠骨骼肌中AMPK/ACC磷酸化均显著升高,CPT1活性增强,TG含量明显降低。这证实了外源性AICAR可通过调控AMPK/ACC/CPT1,参与调节骨骼肌脂代谢。但本研究进一步表明,烧伤小鼠经AICAR干预后,骨骼肌中的AMPK/ACC磷酸化、CPT1活性及脂质沉积均无明显改变,这意味着烧伤后骨骼肌中AMPK/ACC信号通路不再受AICAR调控,AICAR对烧伤后IMCLs无效。
AMPK/ACC信号通路对AICAR刺激无应答可能与AMPK自身功能障碍有关,不同物种的AMPK蛋白均以一种异源三聚体复合物的形式存在,包括一个α催化亚基、一个β调节亚基以及一个γ调节亚基,任一基团异常都将阻碍AMPK/ACC磷酸化,进而表现为对相应刺激无应答[12, 13]。本研究发现,烧伤小鼠腓肠 肌AMPK-α亚基在伤后2周内均低于正常值。AMPK-α 催化亚基N-末端保守的Ser/Thr激酶区中苏氨酸(Thr-172)是AMPK磷酸化必需的位点,骨骼肌中AMPK α亚基表达缺失可能是烧伤后AMPK/ACC通路障碍的关键因素[14]。
烧伤后骨骼肌中AMPK α亚基表达缺失值得进一步研究。AMPK高度保守,表达稳定,蛋白翻译后的修饰是调控AMPK的主要方式,目前研究认为:泛素-蛋白酶降解系统参与了AMPK翻译后的修饰,并因此成为调控AMPK功能的主要路径。与此同时,泛素化关键酶E3-连接酶MAFbx和MuRF1与AMPK α亚基降解密切相关[15]。烧伤后骨骼肌中泛素-蛋白酶系统极度活跃,E3-连接酶MAFbx和MuRF1也呈现持续高表达,伤后骨骼肌中 AMPK α亚基表达缺失是否与泛素-蛋白酶系统相关还有待进一步研究[15, 16]。此外,AMPK中β、γ亚基异常也可能是烧伤后AMPK磷酸化障碍的重要原因之一,有待进一步研究。
综上所述,骨骼肌中AMPK磷酸化障碍是烧伤后IMCLs的重要分子机制之一,AMPK α亚基表达缺失可能是AMPK磷酸化障碍的关键原因。
| [1] | Cohen S, Nathan J A, Goldberg A L. Muscle wasting in disease: molecular mechanisms and promising therapies[J]. Nat Rev Drug Discov, 2015, 14(1): 58-74. |
| [2] | Porter C, Herndon D N, Sidossis L S, et al. The impact of severe burns on skeletal muscle mitochondrial function[J]. Burns, 2013, 39(6): 1039-1047. |
| [3] | Williams F N, Branski L K, Jeschke M G, et al. What, how, and how much should patients with burns be fed?[J]. Surg Clin North Am, 2011, 91(3): 609-629. |
| [4] | Egerman M A, Glass D J. Signaling pathways controlling skeletal muscle mass[J]. Crit Rev Biochem Mol Biol, 2014, 49(1): 59-68. |
| [5] | 柴家科. 严重烧伤后骨骼肌消耗的机制与治疗前景思考[J]. 中华烧伤杂志, 2009, 25(4): 243-245. |
| [6] | Tzika A A, Astrakas L G, Cao H, et al. Murine intramyocellular lipids quantified by NMR act as metabolic biomarkers in burn trauma[J]. Int J Mol Med, 2008, 21(6): 825-832. |
| [7] | Wade C E, Mora A G, Shields B A, et al. Signals from fat after injury: plasma adipokines and ghrelin concentrations in the severely burned[J]. Cytokine, 2013, 61(1): 78-83. |
| [8] | O’Neill H M, Lally J S, Galic S, et al. AMPK phosphorylation of ACC2 is required for skeletal muscle fatty acid oxidation and insulin sensitivity in mice[J]. Diabetologia, 2014, 57(8): 1693-1702. |
| [9] | Niu Y, Yuan H, Fu L. Aerobic exercise’s reversal of insulin resistance by activating AMPKalpha-ACC-CPT1 signaling in the skeletal muscle of C57BL/6 mice[J]. Int J Sport Nutr Exerc Metab, 2010, 20(5): 370-380. |
| [10] | Bastin J. Regulation of mitochondrial fatty acid beta-oxidation in human: what can we learn from inborn fatty acid beta-oxidation deficiencies?[J]. Biochimie, 2014, 96: 113-120. |
| [11] | Zhou G, Sebhat I K, Zhang B B. AMPK activators--potential therapeutics for metabolic and other diseases[J]. Acta Physiol (Oxf), 2009, 196(1): 175-190. |
| [12] | Grahame-Hardie D. AMP-activated protein kinase: a key regulator of energy balance with many roles in human disease[J]. J Intern Med, 2014, 276(6): 543-559. |
| [13] | 王金霞, 任建功, 罗辉, 等. AMPKɑ2基因多态性与2型糖尿病及血清脂联素、颈动脉粥样硬化的关系[J]. 第三军医大学学报, 2012, 34(6): 530-533. |
| [14] | Zhang B B, Zhou G, Li C. AMPK: an emerging drug target for diabetes and the metabolic syndrome[J]. Cell Metab, 2009, 9(5): 407-416. |
| [15] | Zungu M, Schisler J C, Essop M F, et al. Regulation of AMPK by the ubiquitin proteasome system[J]. Am J Pathol, 2011, 178(1): 4-11. |
| [16] | Merritt E K, Thalacker-Mercer A, Cross J M, et al. Increased expression of atrogenes and TWEAK family members after severe burn injury in nonburned human skeletal muscle[J]. J Burn Care Res, 2013, 34(5): e297-e304. |



