随着基因转导技术的应用,通过基因修饰技术可以使T细胞在其表面稳定地表达抗体,赋予新的抗原特异性[1]。嵌合抗原受体(chimeric antigen receptor,CAR)由抗体(受体)结合域、铰链区和跨膜区及胞内信号域组成,胞内信号域通常为CD3ζ链或FcεRIγ,或与一种或多种共刺激分子相连,如4-1BB (CD137)、CD28、ICOS(CD278)[2 ,3]。肿瘤细胞表面的抗原(配体)与嵌合抗原受体的抗体(受体)结合时,通过铰链区和跨膜区将信号传递至胞内,胞内信号域将信号转化为活化信号,激活效应细胞,效应细胞增殖、产生细胞因子从而杀伤肿瘤细胞[4]。
癌胚抗原(carcinoembryonic antigen,CEA)是一种糖蛋白,相对分子质量为200×103,最初由Gold和Freedman报道[5],表达于上皮源性肿瘤中如结直肠癌、胃癌、肺癌、子宫颈癌、胰腺癌[6],目前广泛应用于临床辅助诊断。BW431/26是CEA特异性单克隆抗体[7 ,8],是制备嵌合抗原受体的理想抗体。
本研究构建了以BW431/26单克隆抗体来源的抗CEA的单链抗体为抗体结合域的嵌合抗原受体的慢病毒载体、慢病毒包装,研究该嵌合抗原受体感染人T淋巴细胞后在该细胞中的表达情况,为后续研究及治疗表达CEA抗原的实体肿瘤奠定基础。
1 材料与方法 1.1 实验材料大肠杆菌TOP10为本实验室保存,携带抗CEA单链抗体编码基因的质粒pCDNA3-scBW431/26-hFc由德国柏林Humboldt大学的Gabriele Pecher教授惠赠,DNA Marker(日本 TaKaRa公司),质粒抽提试剂盒(美国 Invitrogen公司),琼脂糖(上海生工生物公司),引 物(南京金斯瑞公司),KOD FX酶(日本 TOYOBO公司),PCR仪(美国Bio-Rad公司),限制性内切酶NheⅠ、EcoRⅤ(美国Thermo公司),离心机(美国 Thermo Scientific公司),胶回收试剂盒(美国Promega公司),T4连接酶体系(美国Promega公司),5×非变性非还原蛋白上样缓冲液(上海碧云天公司),慢病毒载体LV-EF1α-Luciferase-PGK-FP635-WPRE、Lv-Nanog-2A-GFP由本实验室构建,抗CEA的单克隆抗体(英国Abcam公司),慢病毒包装细胞293T(ATCC),萤火虫荧光检测试剂盒购自Promega公司(Luciferase Assay System,E4550)。稳定表达荧光素酶(Fire-Luciferase)和红色荧光蛋白FP635的结直肠癌细胞系SW480-Luc-FP635,HT29-Luc-FP635以及稳定表达荧光素酶(Fire-Luciferase)和红色荧光蛋白FP635的肝癌细胞系HuH7-Luc-FP635由实验室构建并保存,细胞培养于含10%FBS的DMEM培养基中。
1.2 重组慢病毒载体LV-EF1α-CEA-2A-GFP-WPRE的构建 1.2.1 PCR扩增目的片段抗CEA抗体以pCDNA3-scBW431/26-hFc质粒为模板设计引物,在其5′、3′端分别加上NheⅠ、SalⅠ限制性内切酶位点,CEA Up NheⅠ上游引物5′-AGGCTAGCATGGGATGG-AGCTGTATCAT-3′,CEA Dn SalⅠ下游引物5′-AGGTC-GACGGTATCGATAAGCTTTG -3′,根据KOD FX说明书25 μL体系进行加样,并设置阴性对照。PCR反应条件95 ℃预变性5 min,95 ℃变性10 s,68 ℃退火15 s,72 ℃ 延伸30 s,30个循环,扩增完成后取出2 μL 样品加入1%琼脂糖凝胶电泳上样孔中,120 V电泳30 min鉴定。目的片段约2 000 bp,鉴定完成后,参照美国Promega公司胶回收试剂盒进行样品回收。回收后送南京金斯瑞公司测序。测序后用VectorNTI软件进行比对。
1.2.2 PCR扩增目的片段CD3-2A-GFP以Nanog- 2A-GFP质粒为模板设计引物,在其3′加上SalⅠ限制性内切酶位点,上游引物5′-CATGCAGGCCCT-GCCCCCTCGCGGAAGCGGAGCTACTAACTTCAGC-3′,下游引物5′-ATTGTCGACTTACTTGTACAGCTCGTC-CATG-3′,根据KOD FX说明书25 μL体系进行加样,并设置阴性对照。PCR反应条件95 ℃ 预变性5 min,95 ℃ 变性10 s,68 ℃ 退火 15 s,72 ℃ 延伸30 s,25个循环,扩增完成后取出2 μL样品加入1%琼脂糖凝胶电泳上样孔中,120 V电泳30 min鉴定。目的片段约1 191 bp,鉴定完成后,参照美国Promega公司胶回收试剂盒进行样品回收。回收后送南京金斯瑞公司测序。测序后用VectorNTI软件进行比对。
1.2.3 PCR扩增目的片段CEA-CD3-2A-GFP以抗CEA抗体、CD3-2A-GFP为模板,CEA Up NheⅠ、CEA Dn SalⅠ为引物,根据KOD FX说明书25 μL体系进行加样,并设置阴性对照。PCR反应条件95 ℃ 预变性5 min,95 ℃变性10 s,68 ℃退火15 s,72 ℃延伸30 s,30个循环,扩增完成后取出2 μL样品加入1%琼脂糖凝胶电泳上样孔中,120 V电泳30 min鉴定。目的片段约2 690 bp,鉴定完成后,参照美国Promega公司胶回收试剂盒进行样品回收。回收后送南京金斯瑞公司测序。测序后用VectorNTI软件进行比对。
1.2.4 双酶切LV-EF1α-Luciferase-PGK-FP635-WPRE载体、目的片段CEA-CD3-2A-GFP载体酶切体系为50 μL:10×Green buffer 5 μL,载体3 μL,NheⅠ酶1 μL,SalⅠ酶1 μL,H2O 40 μL;目的片段酶切体系为50 μL:10×Green buffer 5 μL,目的片段回收产物2.5 μL,NheⅠ酶1 μL,EcoRⅤ酶1 μL,H2O 39.5 μL,37 ℃水浴锅3 h。酶切完成后取出2 μL样品加入1%琼脂糖凝胶电泳上样孔中,120 V电泳30 min鉴定。参照美国Promega公司胶回收试剂盒进行相应样品回收。回收后取出2 μL样品加入1%琼脂糖凝胶电泳上样孔中,120 V电泳30 min鉴定。
1.2.5 重组慢病毒载体LV-EF1α-CEA-2A-GFP-WPRE连接、转化、抽提及酶切鉴定连接体系为10 μL:T4 DNA ligase 10×buffer 1 μL,载体片段2 μL,目的片段6 μL,T4 DNA ligase 1 μL,连接过夜。将连接产物取出5 μL加入装有感受态细菌(冰水混合状态)TOP10的1.5 mL EP管中,冰浴30 min,42 ℃水浴90 s,冰浴3 min,加入800 μL LB液体培养基,30 ℃,280 r/min振荡培养1 h;5 000 r/min离心2 min,弃上清,留200 μL吹打混匀后加入氨苄抗性的LB固体培养基上,用三角形玻璃棒涂匀,平板放入30 ℃恒温箱中培养过夜。挑取饱满的菌落于1 ∶1 000的氨苄LB液体培养基中,30 ℃,280 r/min,振荡培养12 h。抽提方法参照美国 Invitrogen公司质粒抽提试剂盒: ①取1 mL 在LB培养基中培养过夜的菌液,12 000×g离心1 min,弃尽上清; ②加250 μL buffer S1悬浮细菌沉淀,不应留有小的菌块(buffer S1中已加入Rnase); ③加250 μL buffer S2温和充分上下翻转4~6次混合均匀使菌体充分裂解,直至形成透亮溶液,不超过5 min; ④加350 μL buffer S3温和充分上下翻转6~8次,12 000×g离心10 min; ⑤吸取步骤4中的上清转移到制备管(置于2 mL离心管中),12 000×g离心1 min,弃滤液; ⑥将制备管置回离心管,加500 μL buffer W1,12 000×g离心1 min,弃滤液; ⑦将制备管置回离心管,加700 μL buffer W2,12 000×g离心1 min,弃滤液,洗涤2次; ⑧制备管置回离心管中,12 000×g离心1 min; ⑨将制备管移入新的1.5 mL离心管中(试剂盒中提供),在制备膜中央加40 μL去离子水(去离子水加热至65 ℃),室温静置1 min,12 000×g离心1 min。抽提完成后取出2 μL样品加入1%琼脂糖凝胶电泳上样孔中,120 V电泳30 min鉴定,选取大小与重组慢病毒载体相近的质粒进行酶切鉴定,体系20 μL:10×Green buffer 2 μL,质粒0.5 μL,HindⅢ酶1 μL,H2O 16.5 μL,37 ℃水浴3 h,酶切完成后取出2 μL样品加入1%琼脂糖凝胶电泳上样孔中,120 V电泳30 min鉴定。
1.3 慢病毒载体的制备及感染T淋巴细胞 1.3.1 病毒包装将293T细胞以1×105/cm2的密度传至1个75 cm2的Flask中,细胞培养过夜。病毒包装前用预热的2%FBS的DMEM培养基给前1 d细胞换液,继续度培养2 h。将100 μL 2.5 mmol/L CaCl2,20 μg LV-EF1α-CEA-2A-GFP-WPRE质粒,pMD2.G 10 μg、pMDLg/pRRE质粒20 μg、pRSV-Rev质粒20 μg,H2O 680 μL 混合于一个15 mL离心管中,混合均匀。向混合液中缓慢滴加入2×HBS(50 mmol/L HEPES,1.5 mmol/L Na2HPO4,280 mmol/L NaCl,10 mmol/L KCl,12 mmol/L sucrose),用200 μL移液器逐滴加入至CaCl2混合液中,同时15 mL离心管中液体用10 mL移液器不停混匀吹打。混匀后室温下静置15 min并将混合液加入细胞。细胞转染48 h和72 h分别收集培养上清并通过PEG6000离心纯化。
1.3.2 T淋巴细胞感染人外周血来源的单个核细胞PBMC培养在含10% FBS的RPMI1640完全培养基中,通过抗CD3单克隆抗体活化2 d后,加入20MOI的慢病毒载体,24 h后更换含有500 IU/mL的 重组人IL-2的RPMI 1640完全培养基中继续培养10 d。
1.4 非变性非还原Western blot 检测抗CEA抗体在T淋巴细胞中的表达1×106个慢病毒载体LV-EF1α-CEA-2A-GFP-WPRE感染后的T细胞(实验组),3×106个未感染的T淋巴细胞(对照组),分别加入100 μL、300 μL的蛋白裂解液,冰上静置30 min,期间5~6 min振荡1次,4 ℃,12 000 r/min离心10 min,吸取上清,根据上清体积加入5×非变性非还原蛋白上样缓冲液25 μL、75 μL,两个样品分别吸出5 μL、10 μL加入10%PAGE分离胶上样孔中,电泳结束后将蛋白转移至NC膜上,转膜结束后5%脱脂牛奶封闭液封闭2 h,PBST洗涤3次,加入Goat Anti-Human IgG Fc(1 ∶1 000)孵育12 h,PBST洗涤3次,加入辣根过氧化物酶兔抗羊IgG抗体(1 ∶1 000)孵育3 h,室温显像。
1.5 流式细胞术检测抗CEA抗体在T细胞中的表达感染病毒的T细胞培养至第14天,300×g离心收集细胞,用含1%FBS的PBS溶液重悬细胞并调整为1×106/mL。将细胞分装成5管,每管100 μL,向细胞中加入20 μL PE标记抗小鼠抗人CD4单克隆抗体(BD公司PRA-T4克隆)、Percep标记小鼠抗人CD8单克隆抗体(BD公司SK1克隆)抗体、APC标记小鼠抗人CD56单克隆抗体(BD公司B159克隆),4 ℃ 孵育30 min后,PBS洗涤2次,用BD公司FACS Calibur流式细胞仪进行检测。
1.6 细胞杀伤实验检测嵌合抗原受体修饰的T细胞对CEA阳性肿瘤细胞系的杀伤效果CEA阳性的靶细胞选取稳定表达荧光素酶(Fire-Luciferase)的结直肠癌细胞系SW480、HT29,CEA阴性的靶细胞选取稳定表达荧光素酶(Fire-Luciferase)的肝癌细胞系HuH7。靶细胞以1×105/mL种植于96孔板中,每孔100 μL。效应细胞为感染LV-EF1α-CEA-2A-GFP-WPRE病毒的T细胞以效靶比为1 ∶1的比例将效应细胞加入靶细胞中,于37 ℃培养箱中孵育24 h。通过Promega公司的Luciferase Assay System(E4550)检测孔板中剩余细胞内Luciferase的表达量计算杀伤效率。
细胞杀伤效率=1-效应细胞靶细胞共培养孔荧光强度/单独靶细胞孔荧光强度×100%[9]
1.7 统计学分析数据以 x±s表示,采用SPSS 19.0统计软件进行方差分析及t检验。
2 结果 2.1 重组慢病毒载体LV-EF1α-CEA-2A-GFP-WPRE构建与鉴定PCR扩增各个目的片段回收后送测序,测序结果显示各个目的片段序列均正确,经酶切、连接等常规分子克隆技术,重组慢病毒载体LV-EF1α-CEA-2A-GFP-WPRE已构建,其大小为10 101 bp。BamHⅠ酶切鉴定结果为8 980、1 121 bp,酶切鉴定结果正确,成功获得克隆(图 1)。
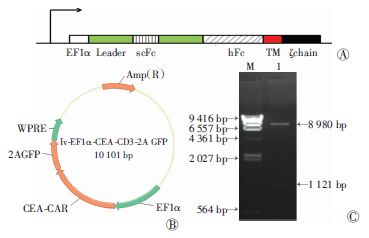
|
| A:嵌合抗原受体LV-EF1α-CEA-2A-GFP-WPRE的结构示意图;B:慢病毒载体LV-EF1α-CEA-2A-GFP-WPRE结构示意图;C:BamHⅠ酶切鉴定重组慢病毒载体LV-EF1α-CEA- 2A-GFP-WPRE M:λ/HindⅢ DNA标准;1:重组慢病毒载体 图 1 重组慢病毒载体LV-EF1α-CEA-2A-GFP-WPRE构建与鉴定 |
感染LV-EF1α-CEA-2A-GFP-WPRE慢病毒载体的T细胞,显微镜下观察细胞形态及GFP的表达情况,结果显示细胞成典型T细胞聚集生长形态,且细胞表达GFP荧光(图 2)。

|
| A:明场视野;B:荧光视野;C:荧光明场叠加视野 图 2 荧光显微镜观察慢病毒载体感染T淋巴细胞效果 (×100) |
收集慢病毒载体感染后的T细胞(实验组),提取蛋白,通过非变性非还原Western blot检测抗CEA抗体在T细胞中的表达,以未感染的T细胞为对照组。结果可见LV-EF1α-CEA-2A-GFP-WPRE感染后的T细胞表达抗 CEA抗体,而未感染的T细胞不表达抗CEA抗体(图 3)。

|
| M:标准;1:对照组(5 μL);2:实验组(5 μL);3:对照组(10 μL);4:实验组(10 μL) 图 3 非变性非还原Western blot 检测抗CEA抗体在T细胞中的表达 |
流式细胞检测结果显示,感染LV-EF1α-CEA-2A-GFP-WPRE慢病毒载体的T细胞培养至14 d后,T细胞GFP表达阳性率为62.8%;GFP+CD4+T细胞占25.0%,GFP+CD8+T细胞占36.8%,GFP+CD56+T细胞占6.0%(图 4)。
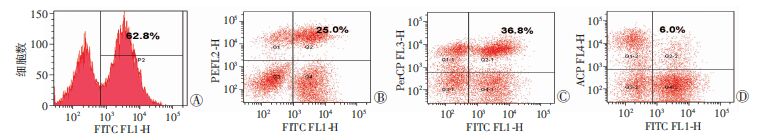
|
| A:慢病毒载体感染T细胞后GFP表达阳性率;B:GFP+CD4+T细胞比例;C:GFP+CD8+T细胞比例;D:GFP+CD56+T细胞比例 图 4 流式细胞术检测感染慢病毒载体T细胞后抗CEA抗体表达率及T细胞CD4、CD8、CD56亚型的比例 |
效应T细胞与靶细胞共培养24 h后通过荧光显微镜观察细胞形态,结果显示CEA阳性的靶细胞SW480和HT29在与效应T细胞共培养后出现葡萄状细胞团,该细胞团为表达绿色荧光的T细胞包裹表达红色荧光的靶细胞形成。而不表达CEA的靶细胞HuH7在与效应细胞共培养后无该现象出现(图 5)。通过检测荧光素酶的含量计算细胞杀伤效率后显示,嵌合抗原受体修饰的T细胞在效靶比1 ∶1的情况下对SW480细胞杀伤效率为(79.53±2.47)%,对HT29细胞杀伤效率为(74.20±0.22)%,对CEA阴性细胞HuH7的杀伤效率为(9.20±0.99)%。结果显示嵌合抗原受体修饰的T细胞对CEA阳性的细胞具有特异性的杀伤作用(P<0.01),而对CEA阴性的细胞几乎无杀伤效果。
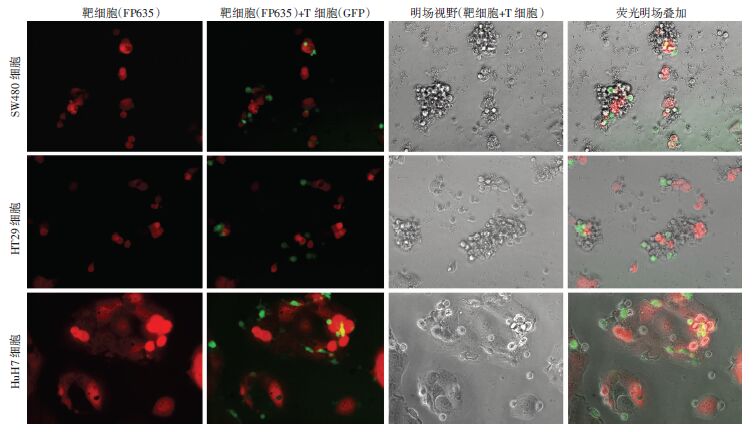
|
| 图 5 荧光显微镜观察重组慢病毒载体感染T细胞后对CEA阳性肿瘤细胞系的杀伤效果 |
近年来嵌合抗原受体修饰的免疫细胞治疗技术发展迅速,其原理是肿瘤细胞表面的抗原(配体)与嵌合抗原受体的抗体(受体)特异性结合,通过铰链区和跨膜区将信号传递至胞内,胞内信号域将信号转化为活化信号,激活效应细胞,效应细胞增殖、产生细胞因子从而杀伤肿瘤细胞[4],其具有以下优势: ①特异性,抗 体(受体)特异性识别抗原(配体); ②安全性好,靶向杀伤肿瘤细胞; ③效率高,非MHC-Ⅰ类分子限制性[10],同时可克服肿瘤微环境造成肿瘤细胞的免疫逃逸。
目前该技术开展的临床试验主要集中应用于血液系统肿瘤的治疗,抗CD19、CD20 CAR修饰的T细胞治疗B系肿瘤效果显著[11]。实体肿瘤临床试验有抗叶酸嵌合抗原受体治疗卵巢癌[12],抗碳酸酐酶Ⅸ(CAⅨ)嵌合抗原受体治疗肾癌[13],抗二唾液酸神经节苷脂(GD2)嵌合抗原受体治疗经母细胞瘤[14]等。CEA抗原是肿瘤相关抗原,广泛表达于上皮源性肿瘤中[6],对该抗原的嵌合受体修饰可广泛应用于上皮源性肿瘤的治疗。
嵌合抗原受体修饰免疫细胞治疗技术的细胞载体包括NK细胞和T细胞,由于肿瘤细胞表面HLAⅠ类分子和NK细胞受体靶向的配体的缺失,T细胞、NK细胞的杀伤活性均会受到肿瘤微环境的抑制[15]。在嵌合抗原受体修饰的免疫细胞治疗技术应用中,NK细胞在外周血淋巴细胞中含量少,转染效率不高[16],增殖能力弱[17];而NK-92细胞需要射线的照射以阻止其复制[18],减少其成瘤风险。且嵌合抗原受体修饰的T细胞治疗各种肿瘤的临床试验已大量开展,技术较成熟。所以本研究将T细胞作为嵌合抗原受体修饰技术的细胞载体。但嵌合抗原受体修饰的NK细胞释放细胞因子少,毒副反应小[16],随着NK细胞培养技术的提高,NK细胞也可能作为新的细胞载体广泛应用于嵌合抗原受体修饰技术中。
虽然嵌合抗原受体修饰免疫细胞治疗各种肿瘤取得了令人振奋的效果,但仍存在部分问题: 由于肿瘤抗原特异性有限,虽然这些抗原在肿瘤组织中表达提升,但其在正常组织中也有较弱的表达水平。因此,CAR修饰免疫细胞杀伤肿瘤细胞的同时也会损伤正常组织,即脱靶(on-target off-tumor toxicity)效应[13, 19]; 修饰后的T细胞在识别靶细胞后将产生大量促炎因子,如IL-2、INF-γ等。这些因子大量聚集将带来严重的副反应,如抗CD19 CAR修饰的T细胞治疗急慢性淋巴细胞白血病观察到了肿瘤溶解综合征(TLS)和细胞因子释放风暴(CRS)[1, 20]; 异基因CAR修饰T细胞治疗时可能会发生移植物抗宿主病(graft versus host disease GVHD)[11, 21]。这也是今后该治疗技术需要逐步改进的内容。
本研究成功构建了表达靶向CEA的嵌合抗原受体LV-EF1α-CEA-2A-GFP-WPRE的慢病毒载体,该载体导入T细胞后可正确表达靶向CEA的嵌合抗原受体。通过体外研究发现表达靶向CEA的嵌合抗原受体的T细胞可有效杀伤CEA阳性肿瘤细胞,为后续体内研究及临床治疗奠定了坚实的基础。
| [1] | Porter D L, Levine B L, Kalos M, et al. Chimeric antigen receptor-modified T cells in chronic lymphoid leukemia[J]. N Engl J Med, 2011, 365(8): 725-733. |
| [2] | Jensen M C, Riddell S R. Design and implementation of adoptive therapy with chimeric antigen receptor-modified T cells[J]. Immunol Rev, 2014, 257(1): 127-144. |
| [3] | Kalos M, June C H. Adoptive T cell transfer for cancer immunotherapy in the era of synthetic biology[J]. Immunity, 2013, 39(1): 49-60. |
| [4] | Jena B, Dotti G, Cooper L J. Redirecting T-cell specificity by introducing a tumor-specific chimeric antigen receptor[J]. Blood, 2010, 116(7): 1035-1044. |
| [5] | Gold P, Freedman S O. Specific carcinoembryonic antigens of the human digestive system[J]. J Exp Med, 1965, 122(3): 467-481. |
| [6] | Hammarstrom S. The carcinoembryonic antigen (CEA) family: structures, suggested functions and expression in normal and malignant tissues[J]. Semin Cancer Biol, 1999, 9(2): 67-81. |
| [7] | Gussow D, Seemann G. Humanization of monoclonal antibodies[J]. Methods Enzymol, 1991, 203:99-121. |
| [8] | Bruynck A, Seemann G, Bosslet K. Characterisation of a humanised bispecific monoclonal antibody for cancer therapy[J]. Br J Cancer, 1993, 67(3): 436-440. |
| [9] | Thorne S H, Negrin R S, Contag C H. Synergistic antitumor effects of immune cell-viral biotherapy[J]. Science, 2006, 311(5768): 1780-1784. |
| [10] | Sadelain M, Brentjens R, Riviere I. The promise and potential pitfalls of chimeric antigen receptors[J]. Curr Opin Immunol, 2009, 21(2): 215-223. |
| [11] | Turtle C J. Chimeric antigen receptor modified T cell therapy for B cell malignancies[J]. Int J Hematol, 2014, 99(2): 132-140. |
| [12] | Kershaw M H, Westwood J A, Parker L L, et al. A phase I study on adoptive immunotherapy using gene-modified T cells for ovarian cancer[J]. Clin Cancer Res, 2006, 12(20 Pt 1): 6106-6115. |
| [13] | Lamers C H, Sleijfer S, Vulto A G, et al. Treatment of metastatic renal cell carcinoma with autologous T-lymphocytes genetically retargeted against carbonic anhydrase IX: first clinical experience[J]. J Clin Oncol, 2006, 24(13): e20-e22. |
| [14] | Louis C U, Savoldo B, Dotti G, et al. Antitumor activity and long-term fate of chimeric antigen receptor-positive T cells in patients with neuroblastoma[J]. Blood, 2011, 118(23): 6050-6056. |
| [15] | Kuroki M, Kuroki M, Shibaguchi H, et al. Strategies to endow cytotoxic T lymphocytes or natural killer cells with antibody activity against carcinoembryonic antigen[J]. Tumor Biol, 2004, 25(4): 208-216. |
| [16] | Klingemann H. Are natural killer cells superior CAR drivers?[J]. Oncoimmunology, 2014, 3:e28147. |
| [17] | Campana D, Schwarz H, Imai C. 4-1BB chimeric antigen receptors[J]. Cancer J, 2014, 20(2): 134-140. |
| [18] | Schonfeld K, Sahm C, Zhang C, et al. Selective inhibition of tumor growth by clonal NK cells expressing an ErbB2/HER2-specific chimeric antigen receptor[J]. Mol Ther, 2015, 23(2):330-338. |
| [19] | Lamers C H, Sleijfer S, van-Steenbergen S, et al. Treatment of metastatic renal cell carcinoma with CAIX CAR-engineered T cells: clinical evaluation and management of on-target toxicity[J]. Mol Ther, 2013, 21(4): 904-912. |
| [20] | Grupp S A, Kalos M, Barrett D, et al. Chimeric antigen receptor-modified T cells for acute lymphoid leukemia[J]. N Engl J Med, 2013, 368(16): 1509-1518. |
| [21] | Marcus A, Eshhar Z. Allogeneic chimeric antigen receptor-modified cells for adoptive cell therapy of cancer[J]. Expert Opin Biol Ther, 2014, 14(7): 947-954. |



