氟(F)是人体必需的微量元素之一,与钙磷代谢有密切关系。但人体中氟元素的安全范围较窄,过量摄入将会对人体多个器官和组织造成损害。国内外研究发现,氟中毒对消化、呼吸、泌尿生殖系统均有不同程度的损害[1]。近年来,已有研究证实过量的氟化钠会损伤生殖系统,造成哺乳动物睾丸结构破坏、精子受精能力丧失等[2],高浓度的氟化物还会导致雌性动物激素分泌紊乱和子代发育异常[3]。课题组前期研究也发现,氟化钠暴露可导致大鼠妊娠率显著降低,血清中类固醇激素明显减少,提示生殖轴功能紊乱可能参与氟化钠的致毒作用[4];进一步研究发现,氟化钠通过引起雌鼠卵巢组织氧化应激,进而导致卵巢颗粒细胞凋亡、卵泡发育异常、卵巢萎缩[5]。同时发现氟化钠暴露可导致子宫组织细胞排列紊乱[9],初步证实了氟化钠暴露对子宫组织形态方面的影响,但是,具体损伤的分子机制尚不明确。本研究从氧化应激、炎症反应方面对氟化钠暴露所致的子宫损伤进行了研究,并进一步探讨其可能的发生机制,旨在为全面理解氟化钠暴露对雌性生殖系统的影响打下基础。
1 材料与方法 1.1 主要试剂和仪器酶标仪为美国Thermo公司产品,低温高速离心机为Sigma公司产品,ChemiDocXRS+荧光化学发光凝胶成像系统,氟离子浓度计、甘汞电极、磁力搅拌器为上海越磁电子科技有限公司产品,氟离子选择电极为上海禹昂自动化科技有限公司产品,显微镜照相系统为日本Olympus公司产品。
氟化钠购自天津光复精细化工研究所,环氧化酶-2 (Cox-2)、细胞间黏附分子-1(ICAM-1)、肿瘤坏死因子-α(TNF-α)、白介素-1β(IL-1β)抗体购自Abcam公司,P38、JNK、PI3K抗体购自Millpore公司,ERK抗体购自Santa Cruz公司,β-actin抗体购自北京博奥森生物技术有限公司。超敏ECL化学发光试剂盒购自Millpore公司,组化试剂盒购自武汉博士德公司,DAB显色试剂盒购自北京中杉金桥生物技术公司,活性氧(ROS)、丙二醛(MDA)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽(GSH)ELISA检测试剂盒购自上海研辉生物科技有限公司。
1.2 建立SD大鼠氟化钠暴露模型将30只年龄、体质量无统计学差异的雌性SD成年大鼠(8~10周龄,体质量160~250 g,购自重庆医科大学实验动物中心)分为3组(10只/组),分别给予蒸馏水(对照组)、100 mg/L氟化钠溶液(100 mg/L氟化钠处理组)、200 mg/L氟化钠溶液(200 mg/L氟化钠处理组)饮用,持续染毒180 d。
1.3 血清及子宫组织氟离子浓度检测(氟离子选择电极法) 采集大鼠静脉血,自然凝固后取上清待检;将各组大鼠子宫组织置匀浆器充分碾磨后,倒入离心管中,加入10倍体积的生理盐水,3 000 r/min离心后取上清待检。 分别配制10-2、10-3、10-4、10-5、10-6、10-7mol/L氟离子溶液,取10 mL样品溶液和10 mL总离子强度调节缓冲液加入到一个定容试管中,用超纯水定容至100 mL。连接仪器电源预热30 min后,氟电极接仪器负极、汞电极接仪器正 极,两级插入超纯水后,开动搅拌器,使电位<-320 mV。 将10-7mol/L氟离子溶液倒入烧杯,放入磁性搅拌棒,插入干净电极,搅拌,读取并记录数值。根据所测结果做出标准曲线,然后测出待测溶液中氟离子浓度所对应的电位,从而换算出氟离子浓度值。 1.4 Western blot检测Cox-2、ICAM-1、TNF-α、IL-1β和P38、ERK、JNK、PI3K蛋白表达染毒完成后,收集新鲜的大鼠子宫组织,加入预冷的组织裂解液及PMSF,冰上碾磨片,静置30 min,裂解产物4 ℃ 12 000×g离心15 min,上清液用BCA法测定蛋白浓度。用SDS-PAGE凝胶电泳分离后将蛋白转至PVDF膜上,将膜用PBST配制的5%脱脂奶粉溶液室温封闭1 h后,分别用Cox-2、ICAM-1、TNF-α、IL-1β、P38、pP38、ERK、pERK、JNK、pJNK、PI3K、pPI3K一抗4 ℃ 孵育过夜,PBST清洗5次,每次5 min,再与辣根过氧化物酶标记的二抗37 ℃反应,用PBST充分洗涤后,用ECL化学发光液于凝胶成像系统成像,用Quantity One 分析条带灰度值,并用目的蛋白/内参灰度值表示蛋白相对表达量。
1.5 免疫组织化学法检测Cox-2、ICAM-1蛋白表达及分布染毒完成后的大鼠脱臼处死后,取出子宫组织放于4%多聚甲醛固定6 h,然后分别在70%、80%、95%、100%酒精梯度脱水、透明、浸蜡、包埋。将蜡块置于切片机切出5 μm厚的石蜡切片。将切片脱蜡、水化后,置于枸橼酸盐缓冲液(pH=6.0)中,于微波炉高火沸腾,转中低火解冻15 min,室温冷却。滴加H2O2 于组织上,室温孵育15 min消除内源性过氧化物酶后,PBS清洗。加入山羊血清封闭液37 ℃封闭3 min后,倾去血清,分别滴加Cox-2、ICAM-1一抗,4 ℃ 过夜后,充分清洗,滴加生物素标记的二抗,37 ℃ 孵育30 min,PBS洗3次,每次10 min,滴加辣根过氧化物标记的链霉素亲和素,37 ℃孵育30 min,充分清洗后用DAB显色,观察到适度深浅的棕黄色后终止反应并用苏木精复染,常规脱水、透明后用中性树胶封片,于显微镜照相系统采集图像。
1.6 ELISA检测ROS、MDA、SOD、CAT、GSH水平为探索氧化应激是否参与了氟化钠所导致的大鼠子宫组织炎症反应,我们对氧化损伤指标ROS、MDA和抗氧化损伤指标SOD、CAT、GSH进行了检测。大鼠子宫组织处理方法同1.3所述,上清液送上海研辉生物科技有限公司用ELISA检测ROS、MDA、SOD、CAT、GSH水平。
1.7 统计学分析采用SPSS 17.0统计软件进行统计学分析,行单因素方差分析,统计图利用GraphPad Prism 5.0软件绘制。
2 结果 2.1 模型验证动物血清及子宫组织中的氟离子浓度测定结果显示,氟化钠处理组氟离子浓度明显高于对照组(P < 0.05,图 1),表明模型建立成功。
 |
| 1:对照组;2:100 mg/L氟化钠处理组;3:200 mg/L氟化钠处理组 图 1 离子选择电极法测定血清(A)和子宫(B)中的 氟离子浓度 |
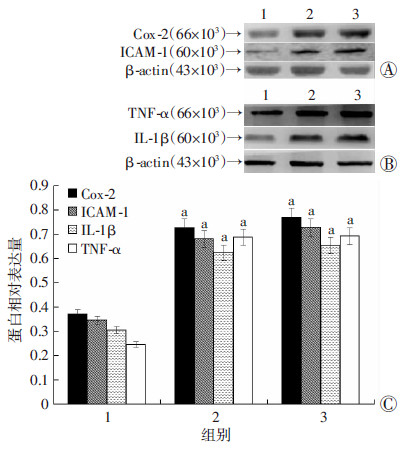
100 mg/L、200 mg/L氟化钠处理组大鼠子宫组织炎症相关因子Cox-2、ICAM-1、TNF-α、IL-1β 表达水平均明显高于对照组(P < 0.05,图 2)。进一步用免疫组化检测Cox-2、ICAM-1的表达及分布,结果发现氟化钠处理组Cox-2、ICAM-1广泛表达于子宫基质中,而对照组未见明显阳性表达(图 3)。
 |
|
1:对照组;2:100 mg/L氟化钠处理组;3:200 mg/L氟化钠处理组 A、B:Cox-2、ICAM-1、TNF-α、IL-1β蛋白Western blot检测结果;C:半定量分析结果 a: P < 0.05,与对照组比较 图 2 Western blot检测大鼠子宫组织炎症相关因子Cox-2、 ICAM-1、TNF-α、IL-1β的表达 |
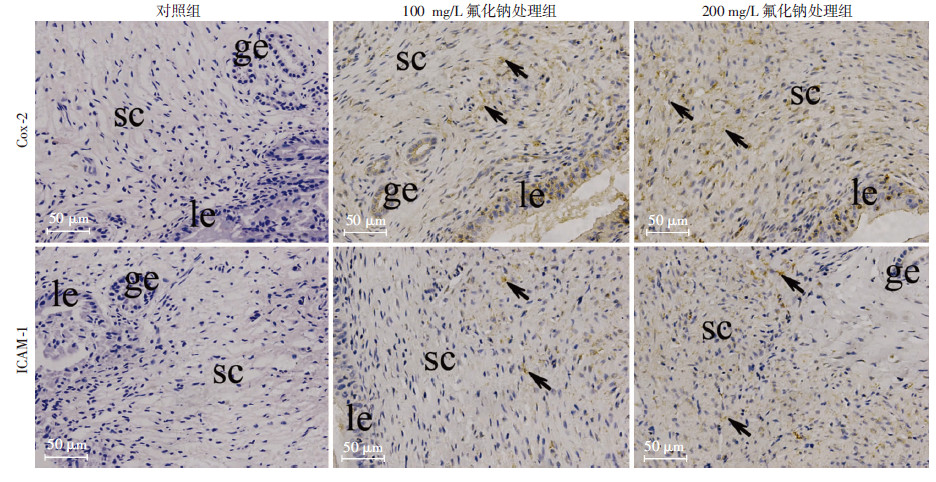 |
| ge:腺上皮;le:腔上皮;sc:基质细胞 ↑:示棕色为阳性表达 图 3 免疫组化检测Cox-2、ICAM-1在子宫组织的表达及分布 (S-P) |
与对照组相比,氟化钠处理导致大鼠子宫组织ROS及抗氧化酶类SOD、CAT、GSH明显增高(图 4A~D,P < 0.05)。进一步对脂质过氧化物MDA的水平进行了检测,与对照组相比,100 mg/L氟化钠处理组与200 mg/L氟化钠处理组MDA水平都明显降低(P < 0.05,图 4E)。结果证实,氟化钠处理导致大鼠子宫组织产生大量过氧化物,同时,也激发机体产生大量的抗氧化物质,打破了机体氧化系统与抗氧化系统之间的平衡。
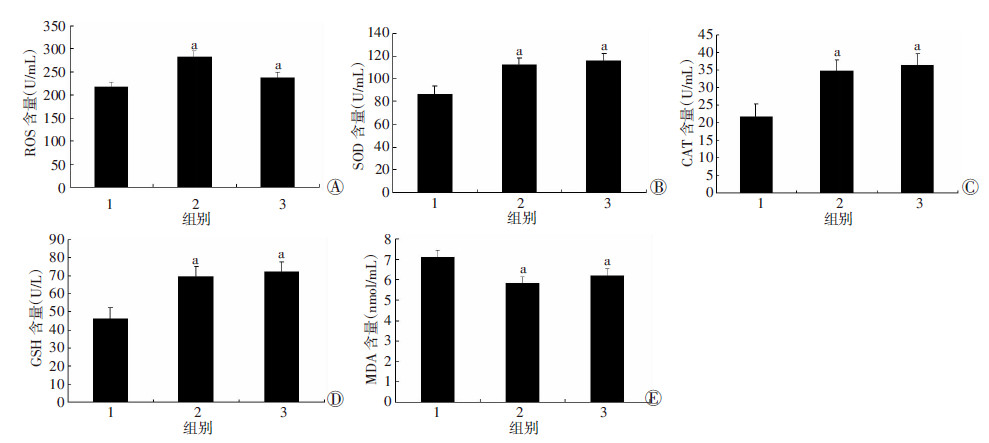 |
| A:ROS;B:SOD;C:CAT;D:GSH;E:MDA 1:对照组;2:100 mg/L氟化钠处理组;3:200 mg/L氟化钠处理组 图 4 ELISA检测各组子宫组织氧化应激指标变化 |
氟化钠处理组P38、JNK的磷酸化效率较对照组明显增高(P < 0.05),虽然ERK和PI3K的磷酸化效 率和对照组比较无明显差异(P>0.05),但两者的总蛋白量和磷酸化蛋白水平在氟化钠处理组均升高(图 5)。
 |
|
1:对照组;2:100 mg/L氟化钠处理组;3:200 mg/L氟化钠处理组 A:Western blot检测结果;B:半定量分析结果 a: P < 0.05,与对照组比较 图 5 Western blot检测氟化钠处理对MAPK(ERK、 JNK、P38)和PI3K信号通路的影响 |
随着氟化物在生活和医疗工作中的运用增多,关于氟中毒与人类身体健康之间的关系研究也越来越多。在生殖系统方面,流行病学调查提示随着氟化物含量增高,男性生育力降低[6]。动物实验也表明,长期接触高剂量氟化钠会导致异常精子增多、精子丧失受精能力等[7]。近年来,关于氟中毒对生殖系统的影响有了进一步的进展。Dimcevici-Poesina等[8]研究发现,氟化钠对附睾上皮细胞及精细胞均有直接损害作用。Wang等[9]则发现氟化钠对精子的损害作用是通过氧化应激以及c-Fos的过表达来实现的。另一方面,研究者也对氟中毒的挽救方法进行了探索。Kumar等[10, 11]发现维生素D、E能在一定程度上减轻氟中毒对雄性生殖系统的危害。研究显示雌性生殖系统对氟化钠处理更为敏感,当母体暴露于足够高浓度的氟化钠时,雌激素、孕激素、黄体生成素的分泌均会下降,最终可导致妊娠率下降及子代发育异常[12]。后加祥等[13]也得到了相似的结论。但是,目前关于氟中毒对生殖系统影响的分子机制研究尚不深入,且氟对女性生殖毒性的研究较少,特别是氟中毒对子宫内膜损伤的具体机制[14]。
本课题组前期研究证实,氟化钠处理可导致雌性大鼠卵巢和子宫的结构损伤,从而影响生育能力[15]。进一步的机制研究表明,氟化钠对SD大鼠卵巢的损伤是通过激活ERK、JNK信号通路诱导氧化应激造成大鼠卵巢细胞凋亡实现的[5]。本研究通过对雌性SD大鼠子宫组织的进一步研究,发现在氟化钠处理组子宫组织的Cox-2、ICAM-1、TNF-α、IL-1β蛋白表达比对照组高,证实氟化钠会导致子宫组织发生炎症反应。由于氧化应激是诱导炎症发生的重要机制之一[16],并且课题组已在前期实验中证明了氟化钠可诱导氧化应激[5],故本研究对氧化应激的情况进行了检测,结果显示,氟化钠亦能导致大鼠子宫组织产生较多的ROS,同时该过程也激发了机体产生大量抗氧化物如SOD、CAT、GSH,最终导致了氧化系统及抗氧化系统的不平衡。但是,氧化损伤可导致脂质及过氧化,从而使组织中MDA水平增高。本实验结果显示,与对照组相比,氟化钠处理组子宫内膜MDA含量没有增加反而下降,可能是由于机体内氧化-抗氧化系统处于一个动态变化的过程。有研究发现,使用溴联苯醚(BDE3)处理翡翠贻贝之后,组织中的SOD活性受到诱导,而MDA的水平却可以呈现出诱导后抑制或者抑制-诱导的反复变化[17]。本实验仅对氟化钠染毒后一个特定的时间点的子宫组织进行了MDA含量测定,其水平的降低可能是由于抗氧化物一过性激活所致。因此,在大鼠子宫组织中,氟化钠诱导的氧化应激是炎症反应发生的重要原因。通常PI3K/Akt和MAPK信号通路是参与氧化应激的重要信号通路[18]。本课题组对PI3K和MAPK家族成员ERK、JNK、P38的检测结果显示P38、JNK的磷酸化效率在氟化钠处理组明显增高,ERK和PI3K的表达及磷酸化水平也升高,提示MAPK、PI3K信号通路在氟化钠诱导的子宫组织发生氧化应激性炎症反应中可能发挥了重要作用。本研究发现了氟化钠通过氧化应激激活炎症反应损害大鼠子宫内膜组织,并进一步进行了分子机制的探讨,加深了我们对于氟的生殖毒性的理解。
本实验仅限于动物研究,由于动物和人体的调节机制差别较大,关于氟化钠的生殖毒性研究还需要更充分的人群调查资料以及更细致的人类细胞和分子水平的研究。在今后的实验中,除了单方面探讨氟化钠的毒理学效应以及调控机制以外,还需要研究相应的补救措施,才能更好地应用研究结果,提高氟中毒地区的生育率。
| [1] | Nielsen F H. Micronutrients in parenteral nutrition: boron, silicon, and fluoride[J]. Gastroenterology, 2009, 137(5 Suppl): S55-S60. |
| [2] | Eppig J J. Oocyte control of ovarian follicular development and function in mammals[J]. Reproduction, 2001, 122(6): 829-838. |
| [3] | Soni M G, Kachole M S, Pawar S S. Alterations in drug metabolising enzymes and lipid peroxidation in different rat tissues by fluoride[J]. Toxicol Lett, 1984, 21(2): 167-172. |
| [4] | Zhou Y, Qiu Y, He J, et al. The toxicity mechanism of sodium fluoride on fertility in female rats[J]. Food Chem Toxicol, 2013, 62: 566-572. |
| [5] | Geng Y, Qiu Y, Liu X, et al. Sodium fluoride activates ERK and JNK via induction of oxidative stress to promote apoptosis and impairs ovarian function in rats[J]. J Hazard Mater, 2014, 272: 75-82. |
| [6] | Freni S C. Exposure to high fluoride concentrations in drinking water is associated with decreased birth rates[J]. J Toxicol Environ Health, 1994, 42(1): 109-121. |
| [7] | Sun Z, Niu R, Wang B, et al. Fluoride-induced apoptosis and gene expression profiling in mice sperm in vivo[J]. Arch Toxicol, 2011, 85(11): 1441-1452. |
| [8] | Dimcevici-Poesina N, Balalau C, Barca M, et al. Testicular histopathological changes following sodium fluoride administration in mice[J]. Rom J Morphol Embryol, 2013, 54(4): 1019-1024. |
| [9] | Wang J, Zhang H, Xu F, et al. The antagonism of aluminum against fluoride-induced oxidative stress and c-Fos overexpression in rat testes[J]. Toxicol Mech Methods, 2014, 24(2): 136-141. |
| [10] | Kumar N, Sood S, Arora B, et al. To Study the Effect of Vitamin D and E on Sodium-Fluoride-induced Toxicity in Reproductive functions of Male Rabbits[J]. Toxicol Int, 2012, 19(2): 182-187. |
| [11] | Kumar N, Sood S, Arora B, et al. Effect of duration of fluoride exposure on the reproductive system in male rabbits[J]. J Hum Reprod Sci, 2010, 3(3): 148-152. |
| [12] | Collins T F, Sprando R L, Black T N, et al. Developmental toxicity of sodium fluoride measured during multiple generations[J]. Food Chem Toxicol, 2001, 39(8): 867-876. |
| [13] | 后加祥, 杨跃进, 巩飚, 等. 饮水氟暴露对女性内分泌 激素的影响[J]. 中华预防医学杂志, 2013, 47(2): 142-146. |
| [14] | 刘丹, 石修权. 氟的生殖毒性研究进展[J]. 中国预防医学杂志, 2014, 15(3): 282-284. |
| [15] | Zhou Y, Zhang H, He J, et al. Effects of sodium fluoride on reproductive function in female rats[J]. Food Chem Toxicol, 2013, 56: 297-303. |
| [16] | Salzano S, Checconi P, Hanschmann E M, et al. Linkage of inflammation and oxidative stress via release of glutathionylated peroxiredoxin-2, which acts as a danger signal[J]. Proc Natl Acad Sci U S A, 2014, 111(33): 12157- 12162. |
| [17] | 黄志斐, 张喆, 马胜伟, 等. BDE209胁迫对翡翠贻贝(Perna viridis)SOD、MDA和GSH的影响[J]. 农业环境科学学报, 2012, 31(6): 1053-1059. |
| [18] | Karube H, Nishitai G, Inageda K, et al. NaF activates MAPKs and induces apoptosis in odontoblast-like cells[J]. J Dent Res, 2009, 88(5): 461-465. |



