2. 400016 重庆,重庆医科大学基础医学院:发育生物学研究室
3. 400016 重庆,重庆医科大学基础医学院:生物化学与分子生物学教研室
2. Department of Developmental Biology, College of Basic Medical Sciences, Chongqing Medical University, Chongqing, 400016, China
3. Department of Biochemistry and Molecular Biology, College of Basic Medical Sciences, Chongqing Medical University, Chongqing, 400016, China
胃癌导致人类死亡的第三大肿瘤疾病[1, 2]。随着分子生物学研究的推进,分子的靶向治疗也将肿瘤的个体化治疗推向了另一个高峰。Forkhead box O4蛋白(又称FOXO4,AFX)是Forkhead转录因子家族的成员之一,参与了细胞的增殖、凋亡等多种生理过程[3],在多种肿瘤细胞中表达异常。有研究发现,FOXO4在胃癌细胞中表达异常,可能与胃癌的发生与发展有关[4, 5]。本研究通过构建FOXO4表达载体及基因表达干扰的短发夹RNA(short hairpin RNA,shRNA)载体,研究FOXO4的异位表达对胃癌细胞系MKN45和SGC7901凋亡的影响。
1 材料与方法 1.1 质粒和菌株和细胞真核表达骨架质粒pLL3.7、真核表达骨架质粒pCMV5-Flag、大肠埃希菌DH5α、人胃癌细胞MKN45和SGC7901均由本实验室保存。
1.2 主要试剂T4 DNA连接酶、限制性内切酶BamHⅠ、EcoRⅠ、HpaⅠ、XhoⅠ、Taq聚合酶、DNA Marker、dNTP、 PrimeScript RT reagent Kit试剂盒均购自宝生物工程(大连) 有限公司(TaKaRa);DMEM培养基及胎牛血清购自美国Gibco公司;兔抗Cleaved Caspase-3多克隆抗体和兔抗FOXO4多克隆抗体购自美国Cell Signaling公司,山羊抗鼠β-actin单克隆抗体购自天津三箭生物技术有限公司,HRP标记的山羊抗兔和抗鼠IgG二抗购自江苏三联生物工程有限公司;TRIzol试剂、脂质体LipofectamineTM 2000购自美国Invitrogen公司;siRNA序列的合成及测序由上海英俊生物技术有限公司完成。
1.3 FOXO4真核表达载体的构建FOXO4基因序列引自GenBank(序列号:NM_001170931.1),应用Primer Premier 5.0设计FOXO4引物序列,正义链:5′-ATGGATCCGGGGAATGAGAATTCA-3′,反义链:5′-TCAGGGATCTGGCTCAAAGTTGA-3′,送上海英骏生物技术有限公司合成。提取胃癌细胞MKN45细胞RNA,以逆转录成cDNA为模板,PCR扩增。按照PCR扩增反应试剂盒说明书,30 μL反应体系,预变性95 ℃,5 min,1个循环。95 ℃变性15 s;55 ℃退火30 s;72 ℃延伸90 s,30个循环。72 ℃延伸10 min。将PCR产物与NdeⅠ和XbaⅠ充分酶切的pCMV5-Flag质粒共同纯化回收后,通过T4连接酶连接后,转入大肠埃希菌DH5α中,在含氨苄抗性LB平板上培养过夜,挑取阳性克隆,即得到pCMV5-Flag-FOXO4真核表达载体。
1.4 siRNA的设计与siRNA重组载体的构建应用美国Oligo Engine公司提供的干扰RNA双链在线设计软件,选取抑制率最高的FOXO4 siRNA序列正义链:5′-GGAAATCAGTCATATGCAGAA-3′,反义链:5′-TTCTGCATATGACTGATTTCC-3′;在人的基因组中无意义的对照siRNA序列正义链:5′-TTGATGTGTTTAGTCGCTA-3′,反义链:5′-TAGCGACTAAACACATCAA -3′,送上海英骏生物技术有限公司合成。将合成的靶向FOXO4 siRNA序列按从95 ℃至25 ℃,每下降5 ℃维持5 min,退火成双链DNA片段后,与经HpaⅠ和XbaⅠ酶切并回收纯化后的pLL3.7质粒用T4 DNA连接酶连接后,转入大肠埃希菌DH5α中,在含氨苄抗性LB平板上培养过夜,挑取阳性克 隆,即得到siRNA 真核表达载体pLL3.7-FOXO4-shRNA 与pLL3.7-Control-shRNA。
1.5 细胞培养及转染胃癌细胞系MKN45和SGC7901培养于含10%灭活胎牛血清RPMI1640培养基中(37 ℃,5% CO2),隔天换液,待细胞生长至合适密度用于实验。采用脂质体介导的方法,将重组质粒pCMV5-Flag-FOXO4、 pLL3.7-FOXO4-shRNA转入细胞系MKN45和SGC7901,同时转入空载pCMV5-Flag、pLL3.7-Control-shRNA作为对照。转染操作按照脂质体转染试剂盒说明书进行。转染24 h后收集细胞,用于实验处理。
1.6 Western blot检测FOXO4及Cleaved Caspase-3蛋白表达收集各组细胞,PBS洗涤,蛋白裂解液裂解提取蛋白,BCA法测定细胞总蛋白浓度,样品经SDS-PAGE电泳分离,转膜,5% 脱脂奶粉封闭,FOXO4、Cleaved Caspase-3一抗(参照说明书稀释抗体)及β-actin抗体4 ℃孵育过夜,洗膜,HRP标记的二抗(1 ∶8 000)室温孵育1 h,洗膜,ECL发光。采用Quantity One 软件进行半定量分析,用目的条带的光密度值与β-actin条带的光密度值的比值来反映目的蛋白表达的相对量,β-actin 为内参对照。
1.7 FCM法检测FOXO4异位表达状态下对胃癌细胞凋亡的影响取对数期生长期的细胞,按2×106/mL接种于6 cm 盘中,按上述转染处理。收集各组细胞,送重庆医科大学生命科学院流式检测中心检测FOXO4异位表达时对胃癌细胞凋亡的影响。
1.8 实时荧光定量PCR实时荧光定量PCR(Real-time PCR,qPCR)是利用SYBR Premix Ex Taq Ⅱ (TaKaRa,Japan)在Bio-Rad CFX 96 qPCR仪上通过两个阶段完成的。第一阶段,95 ℃ 30 s,为使其变性。第二阶段设置95 ℃ 5 s,60 ℃ 30 s,共40个循环。 GAPDH正义链:5′-GAGT-CAACGGATTTGGTCGTA-3′ ,反义链:5′-ATGGGATT-TCCATTGATGACA-3′;FOXO4正义链:5′-CTTTCTGAAGACTGGCAGGAATGTG-3′ ,反义链:5′-GATCTA-GGTCTATGA-TCGCGGCAG-3′;BCL-6正义链:5′-CTGCATCAAG CCTCCTC-3′ ,反义链:5′-GTTCTCCACCACCTCACG-3′。
1.9 统计学方法计量数据用x±s表示,应用SPSS 18.0统计软件,两样本均数比较采用t检验,多样本均数比较采用单因素方差分析。检验水准α=0.05。
2 结果 2.1 重组质粒的鉴定以DL10000为参照,重组质粒pCMV5-Flag- FOXO4经BamH Ⅰ 和Xho Ⅰ 双酶切,阳性克隆为1.5 kb 和4.7 kb片段,重组质粒pLL3.7-FOXO4-shRNA、pLL3.7-Control-shRNA经HpaⅠ和EcoRⅠ双酶切,阳性克隆较对照组只能被EcoRⅠ单酶切。基本与预期研究结果相符(图 1)。阳性克隆送上海英骏生物公司测序,结果正确。表明成功构建pCMV5-Flag-FOXO4和pLL3.7-FOXO4-shRNA、pLL3.7-Control-shRNA表达载体。
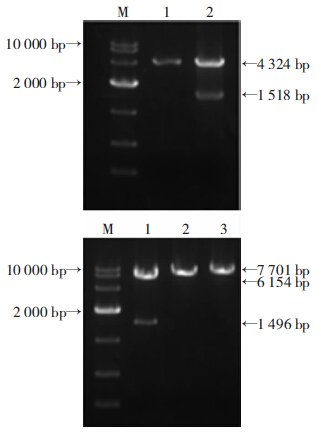 |
| A:重组质粒pCMV5-Flag-FOXO4 BamHⅠ/XhoⅠ双酶切鉴 定 M: 标准(DL10000);1:pCMV5-Flag;2:pCMV5-Flag-FOXO4; B:重组质粒pLL3.7-FOXO4-shRNA、 pLL3.7-Control-shRNA经HpaⅠ和EcoRⅠ双酶切鉴定 M: 标准(DL10000); 1:pLL3.7;2:pLL3.7-FOXO4-shRNA;3:pLL3.7- Control-shRNA 图 1 重组质粒双酶切鉴定结果 |
Western blot结果显示,pCMV5-Flag-FOXO4转染组MKN45细胞和SGC7901细胞中FOXO4 蛋白的表达水平明显高于pCMV5-Flag转染的阴性对照组(P<0.01,图 2);pLL3.7-FOXO4-shRNA转染组MKN45细胞中FOXO4 蛋白的表达水平明显低于pLL3.7-Control-shRNA转染的阴性对照组(P<0.01,图 2)。说明pCMV5-Flag-FOXO4和pLL3.7-FOXO4-shRNA可分别明显增加和降低胃癌细胞中FOXO4蛋白的表达水平。
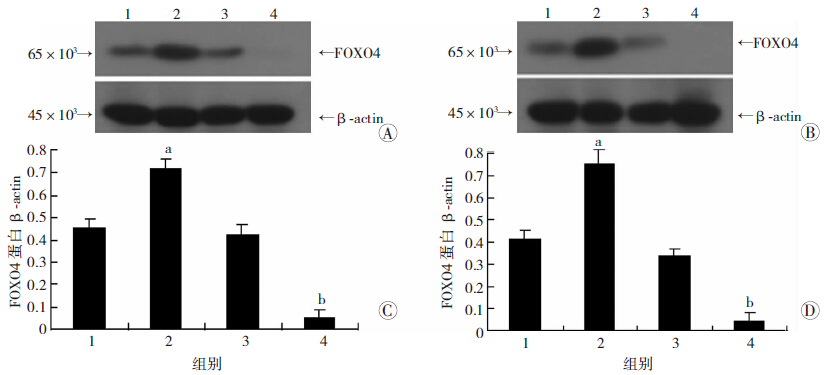 |
| A:Western blot检测FMNK45细胞中FOXO4蛋白表达;B:Western blot检测SGC7901细胞中FOXO4蛋白表达 1:阴性对照组;2:FOXO4组;3:Control-shRNA组;4:FOXO4-shRNA组;C-D:半定量分析结果 a :P<0.01,与阴性对照组比较;b:P<0.01,与Control-shRNA组比较 图 2 Western blot检测质粒转染胃癌细胞后FOXO4蛋白表达 |
FCM检测结果显示,转染24 h后,pCMV5-Flag-FOXO4组较转染pCMV5-Flag组的MKN45细胞和SGC7901细胞的凋亡率分别增加16.54%和26.23%,差异有统计学意义(P<0.01,图 3);转染pLL3.7-FOXO4-shRNA组较转染pLL3.7-Control-shRNA组的MKN45细胞和SGC7901细胞的凋亡率并无明显变化,差异无统计学意义(P>0.05,图 3)。结果表明,FOXO4的过表达会增加胃癌细胞的凋亡。
 |
| A~D:转染质粒后MKN45细胞凋亡情况;E~H:转染质粒后SGC7901细胞凋亡情况;A、E:阴性对照组;B、F:FOXO4组;C、G:Control-shRNA组;D、H:FOXO4-shRNA组 图 3 流式细胞术检测FOXO4对各组胃癌细胞凋亡的影响 |
Western blot结果显示,pCMV5-Flag-FOXO4转染组MKN45细胞和SGC7901细胞中Cleaved Caspase-3 蛋白的表达水平明显高于pCMV5-Flag转染的阴性对照组(P<0.01,图 4);转染24 h后,pLL3.7-FOXO4-shRNA组较转染pLL3.7-Control-shRNA组的MKN45细胞和SGC7901细胞中的Cleaved Caspase-3 蛋白的表达水平并无明显变化,差异无统计学意义(P>0.05,图 4)。结果表明,FOXO4的过表达导致凋亡蛋白Cleaved Caspase-3表达上调。
 |
| 1:阴性对照组;2:FOXO4组;3:Control-shRNA组;4:FOXO4-shRNA组 A、C:MKN45细胞;B、D:SGC7901细胞 a:P<0.01,与阴性对照组比较 图 4 Western blot检测FOXO4对胃癌细胞Cleaved Caspase-3蛋白表达的影响 |
qPCR结果显示,在胃癌细胞MKN45和SGC7901中,转染pCMV5-Flag-FOXO4组较转染pCMV5-Flag组,FOXO4下游促凋亡基因BCL-6 mRNA表达水平明显上调了约3倍和4倍,差异有统计学意义(P<0.01,图 5);转染pLL3.7-FOXO4-shRNA 组较转染pLL3.7-Control-shRNA组,BCL-6 mRNA表达水平明显下调了约1倍,差异有统计学意义(P<0.01,图 5)。结果表明,FOXO4的过表达导致的胃癌细胞的凋亡,可能是通过激活BCL-6的转录实现的。
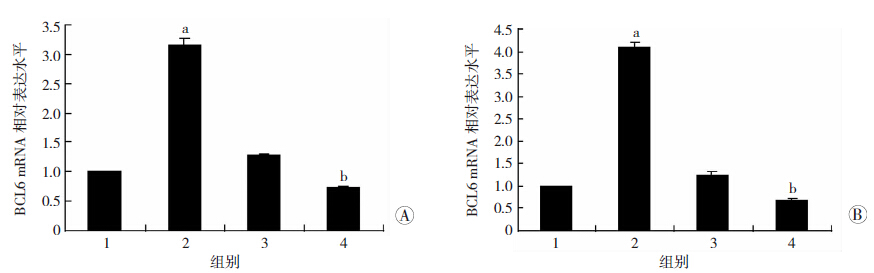 |
| 1:阴性对照组;2:FOXO4组;3:Control-shRNA组;4:FOXO4-shRNA A:MKN45细胞;B:SGC7901细胞 a:P<0.01,与阴性对照组比较;b: P<0.01,与Control-shRNA 组比较 图 5 qPCR检测FOXO4对胃癌细胞BCL-6 mRNA表达的影响 |
胃癌仍是世界难以攻克的常见癌症之一。胃癌的治疗仍主要以化疗和放疗方式为主,但治疗效果有限,患者预后效果差、生存率低。FOXO蛋白是Forkhead转录因子家族的成员之一。在哺乳动物中,FOXO基因亚家族共有4个成员,分别是FOXO1(之前被称为FKHR)、FOXO3(之前被称为FKHRL1)、FOXO4(之前被称为AFX)和FOXO6。许多研究发现,FOXO转录因子参与到细胞的增殖、凋亡、分化、迁移、能量代谢等多种生理过程,并在不同的环境刺激下,FOXO可以很好地协调起不同的基因表达模式,而起到不同的作用[3, 6, 7, 8, 9, 10]。Kim等[11]发现,FOXO1的磷酸化抑制了胃癌的血管生成。 Yamamura等[12]研究发现,FOXO3a可以和RUNX3结合共同调节胃癌细胞的凋亡。 FOXO4在成人胃肠道中表达较FOXO家族其他成员(FOXO1、 FOXO3a、FOXO6)较高,但FOXO4在胃癌中的研究报道较少。
有研究表明,FOXO4在胃癌细胞中较正常胃细胞表达下调。张超等[4]报道FOXO4在正常胃黏膜组织的阳性率为100%,而在胃腺癌组织的阳性率仅为40.0%。Su等[5]研究发现,在早期胃癌组织中,FOXO4的阳性率为42.5%,在侵袭性胃癌组织中,FOXO4的阳性率仅为17.9%。本研究利用在不同分化程度胃癌细胞中过表达和沉默FOXO4,研究FOXO4对胃癌细胞生存能力的影响,结果显示,在低分化胃癌细胞株MNK45和高分化胃癌细胞株SGC7901中过表达FOXO4可明显增加细胞的凋亡(P<0.01),表明FOXO4对低分化、高分化胃癌细胞均有明显的促凋亡作用。
已有研究发现,FOXO4可以介导细胞的凋亡。Chen等[13]研究发现microRNA-421可以通过下调其靶基因FOXO4的表达,介导鼻炎癌细胞的增殖和凋亡。Chuang等[14]通过酶联免疫吸附等实验发现FOXO4可以介导足细胞的凋亡。Takaharu等[15]通过siRNA沉默细胞FOXO4,抑制了在双氧水刺激下早期的促血管生成细胞的凋亡。本研究结果显示,高表达FOXO4,可以引起胃癌细胞系MKN45和SGC7901细胞系的凋亡(P<0.001),表明FOXO4基因对胃癌细胞具有促凋亡能力。
细胞中凋亡蛋白Cleaved Caspase-3的变化也是细胞凋亡的一个重要指标。Tang等[16]在可诱导的高表达的FOXO4的HeLa细胞株中,加入Caspase通路的抑制剂zVAD-fmk [Z-ValAla-Asp (OMe)-fluoromethyl ketone],细胞的凋亡较没有加入Caspase抑制剂组基本完全被消除,说明caspase蛋白是FOXO4引起细胞凋亡的终末途径。本研究结果显示,高表达的FOXO4,使得胃癌细胞的凋亡蛋白Cleaved Caspase-3表达量增加,验证了,FOXO4促进了胃癌细胞的凋亡。但是减少FOXO4表达,并没有明显引起Cleaved Caspase-3蛋白表达变化,可能由于细胞本身凋亡并没有改变。
FOXO4在细胞信号通路中起着重要作用。FOXO4可以响应生长因子的调控而被磷酸化导致其出核,不能激活下游的转录因子。对于很多生长因子激活的蛋白激酶,其特异磷酸化位点已有报道。比如对于细胞有促生存作用的磷脂酰肌醇3-激酶(PI3K)细胞信号通路的蛋白激酶B(PKB/AKT)可以将FOXO4磷酸化,导致其从细胞核穿梭至细胞质,失去了激活下游转录因子,而这些转录因子多有促进细胞凋亡的作用[3, 16, 17, 18, 19, 20]。Tang等[16]通过蛋白免疫印迹及荧光素酶报告基因实验等多种实验方法证实了BCL-6(B-Cell Lymphoma)是FOXO4的下游转录因子。BCL-6转录因子可以与抗凋亡基因BCL-XL的启动子位点结合,而抑制BCL-XL转录,导致细胞的凋亡[21, 22]。本研究结果显示,高表达FOXO4,可以增加胃癌细胞系MKN45和SGC7901细胞系BCL-6转录因子的表达,促进细胞的凋亡,沉默FOXO4,可以明显抑制胃癌细胞系MKN45和SGC7901细胞系BCL-6转录因子的表达,增强了细胞的生存能力。
综上所述,本研究结果显示FOXO4的高表达可以促进胃癌细胞系MKN45和SGC7901细胞的凋亡;FOXO4的沉默增强了胃癌细胞的潜在生存能力。为进一步探讨FOXO4与肿瘤细胞的凋亡及相关调节基因表达的信号转到机制提供了实验数据,为研究胃癌发生、发展的分子机制奠定了基础,有利于在个体化分子治疗中开创新的治疗思路,提供新的实验依据。
| [1] | Leja M, You W, Camargo M C, et al. Implementation of gastric cancer screening - the global experience[J]. Best Pract Res Clin Gastroenterol, 2014, 28(6): 1093-1106. |
| [2] | Herrero R, Park J Y, Forman D. The fight against gastric cancer - the IARC Working Group report[J]. Best Pract Res Clin Gastroenterol, 2014, 28(6): 1107-1114. |
| [3] | Zhang Y, Gan B, Liu D, et al. FoxO family members in cancer[J]. Cancer Biol Ther, 2011, 12(4): 253-259. |
| [4] | 张超, 王德荣, 曲飞, 等. 转录因子FOXO4与胃癌及Hp感染关系的临床研究[J]. 中国现代普通外科进展, 2013, 16(3): 210-213. |
| [5] | Su L, Liu X, Chai N, et al. The transcription factor FOXO4 is down-regulated and inhibits tumor proliferation and metastasis in gastric cancer[J]. BMC Cancer, 2014, 14: 378. |
| [6] | Srisuttee R, Koh S S, Park E H, et al. Up-regulation of Foxo4 mediated by hepatitis B virus X protein confers resistance to oxidative stress-induced cell death[J]. Int J Mol Med, 2011, 28(2): 255-260. |
| [7] | Maiese K, Chong Z Z, Shang Y C, et al. A "FOXO" in sight: targeting Foxo proteins from conception to cancer[J]. Med Res Rev, 2009, 29(3): 395-418. |
| [8] | Brunet A, Bonni A, Zigmond M J, et al. Akt promotes cell survival by phosphorylating and inhibiting a Forkhead transcription factor[J]. Cell, 1999, 96(6): 857-868. |
| [9] | Glauser D A, Schlegel W. The emerging role of FOXO transcription factors in pancreatic beta cells[J]. J Endocrinol, 2007, 193(2): 195-207. |
| [10] | 甘立霞. FoxO转录因子在代谢调节及肿瘤抑制中的作用[J]. 第三军医大学学报, 2006, 28(12): 1347-1350. |
| [11] | Kim S Y, Yoon J, Ko Y S, et al. Constitutive phosphorylation of the FOXO1 transcription factor in gastric cancer cells correlates with microvessel area and the expressions of angiogenesis-related molecules[J]. BMC Cancer, 2011, 11: 264. |
| [12] | Yamamura Y, Lee W L, Inoue K, et al. RUNX3 cooperates with FoxO3a to induce apoptosis in gastric cancer cells[J]. J Biol Chem, 2006, 281(8): 5267-5276. |
| [13] | Chen L, Tang Y, Wang J, et al. miR-421 induces cell proliferation and apoptosis resistance in human nasopharyngeal carcinoma via downregulation of FOXO4[J]. Biochem Biophys Res Commun, 2013, 435(4): 745-750. |
| [14] | Chuang P Y, Dai Y, Liu R, et al. Alteration of forkhead box O (foxo4) acetylation mediates apoptosis of podocytes in diabetes mellitus[J]. PLoS One, 2011, 6(8): e23566. |
| [15] | Nakayoshi T, Sasaki K, Kajimoto H, et al. FOXO4-knockdown suppresses oxidative stress-induced apoptosis of early pro-angiogenic cells and augments their neovascularization capacities in ischemic limbs[J]. PLoS One, 2014, 9(3): e92626. |
| [16] | Tang T T, Dowbenko D, Jackson A, et al. The forkhead transcription factor AFX activates apoptosis by induction of the BCL-6 transcriptional repressor[J]. J Biol Chem, 2002, 277(16): 14255-14265. |
| [17] | Ruggieri S, Tamma R, Marzullo A, et al. Translocation of the proto-oncogene Bcl-6 in human glioblastoma multiforme[J]. Cancer Lett, 2014, 353(1): 41-51. |
| [18] | Zhang X, Tang N, Hadden T J, et al. Akt, FoxO and regulation of apoptosis[J]. Biochim Biophys Acta, 2011, 1813(11): 1978-1986. |
| [19] | Sun Y, Tian H, Wang L, et al. The effects of silencing of PI3K p85alpha on 5-FU-induced colorectal cancer cells apoptosis[J]. Med Oncol, 2013, 30(4): 704. |
| [20] | Tzivion G, Dobson M, Ramakrishnan G. FoxO transcription factors; Regulation by AKT and 14-3-3 proteins[J]. Biochim Biophys Acta, 2011, 1813(11): 1938-1945. |
| [21] | Chiang C, Ihrie R A. Controlling COR competence: BCL-6 regulates neurogenesis and tumor suppression[J]. Cancer Cell, 2014, 26(6): 773-774. |
| [22] | Lee E J, Kim J M, Lee M K, et al. Splice variants of the forkhead box protein AFX exhibit dominant negative activity and inhibit AFXalpha-mediated tumor cell apoptosis[J]. PLoS One, 2008, 3(7): e2743. |



