我国已进入老龄化社会,腰腿痛患者日趋增多,腰椎退变引起的腰椎间盘突出症是其中一个重要原因。自20世纪30年代初美国麻省总医院医生Barr和同事Mixter提出腰椎间盘突出症以来,经过近百年不断探索研究,腰椎间盘突出症的诊断、治疗都取得了非常显著的成效[1, 2]。目前有机械压迫、化学、自身免疫及炎症等用于解释椎间盘突出症的疼痛产生,但椎间盘突出症的疼痛机制却仍不十分明确。正常的背根神经节内仅存在少量伴随血管走行的交感神经纤维,但在某些病理情况下,交感神经纤维可以向背根神经节内广泛生长并包绕神经元,可形成特征性的环状或篮状结构[3]。有研究表明背根神经节(dorsal root ganglion,DRG)交感神经芽生与某些神经损伤性疼痛之间存在着非常密切的联系[4]。而椎间盘髓核突出症所引起的神经性疼痛与DRG内交感神经芽生之间是否也存在着联系尚不清楚。本研究旨在观察在单纯椎间盘髓核刺激下DRG内交感神经的分布情况,探索二者之间的关系,以期为椎间盘突出症的临床诊断、治疗提供一个新的研究方向。
1 材料与方法 1.1 主要试剂及仪器兔来源的TH抗体购自美国Pel-Freeze公司,二抗套件(VECTASTAIN ABC KIT)购自美国Vector Labs公司,BME-410C型热辐射痛觉测量仪和机械痛测痛套件BME 2403 Von Frey 纤维丝购自中国医学科学院生物工程研究所。
1.2 大鼠椎间盘髓核突出动物模型的制备雄性SD大鼠110只,体质量250~300 g,由第三军医大学新桥医院实验动物中心提供。按随机数字表法分为正常组10只,手术组、假手术组术后2、5、7、14、20 d 5个时间点,各时间点10只。大鼠椎间盘髓核突出模型参照文献[5]的方法建立,并进行适当改进。大鼠用3%戊巴比妥钠按照50 mg/kg的剂量腹腔注射麻醉成功后,背侧中下部剃毛备皮,俯卧位固定,消毒手术区,铺手术洞巾。以大鼠L5、L6棘突间为中心,沿背部正中线纵行切开皮肤及皮下组织,切口长约3 cm。切开筋膜后暴露左侧椎旁肌肉,并将其向外侧分离牵开,显露左侧L5、L6椎间关节,切除椎间关节及部分L5椎板后暴露L5 DRG(图 1)。生理盐水冲洗伤口,纱布覆盖。大鼠尾部近端背侧中线做一长约2 cm切口,向外侧牵开皮肤及椎旁组织,暴露2个节段的鼠尾椎间盘。手术刀尖于椎间盘上做横行切口,用刮匙分别刮出两个节段髓核移植于L5 DRG表面(图 2)。1-0丝线缝合腰部皮下筋膜及皮肤,单层缝合尾部皮肤。假手术组则不进行髓核移植,其余手术步骤相同。术后大鼠放回饲养室正常饲养。
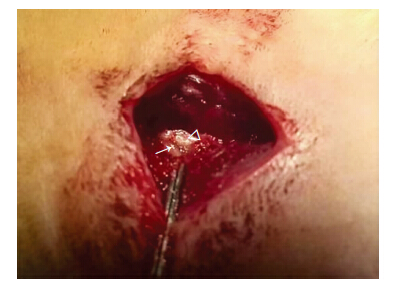 |
| ↑:背根神经节;△:脊髓 图 1 暴露大鼠L5左侧背根神经节 |
 |
| ↑:背根神经节;▲:脊髓;△:大鼠尾部椎间盘髓核 图 2 大鼠尾部髓核移植至暴露的背根神经节 |
正常组大鼠及手术组、假手术组术后2、5、7、14、20 d大鼠,在室温为26 ℃的房间内进行机械性痛阈的测定。将大鼠各自一间放置于底部有筛孔的透明塑料格笼(30 cm×20 cm×40 cm)内。待大鼠安静后,以Von Frey纤维丝由底部筛孔垂直向上刺于后足底皮肤薄弱的中心部位。每一种规格的纤维丝由小到大开始使用,每种规格的力度纤维丝使用5次。使用纤维丝时,纤维丝应轻度弯曲并维持约5 s,每次刺激间隔不小于1 min。当大鼠猛然抬起后足则记为1次阳性反应。如恰巧大鼠在刺激时移动走开,则认为结果不确 切,应间隔一段时间后重新进行测定。当某种力度规格的纤维丝在5次测定中有3次或以上的阳性反应记录时,则视此力度为该大鼠机械痛阈估值。
1.3.2 热痛阈测定各组、各时间点大鼠在室温为26 ℃的房间内进行热痛阈的测定。将大鼠各自一间 放置于底部为透明玻璃板的塑料格笼内,格笼长宽高约为30 cm×20 cm×40 cm。待大鼠安静后,玻璃板下方放置热辐射测痛仪光源,将光线聚焦照射于大鼠后足底中心部,并开始记录照射时间。当大鼠猛然抬起后足即中止计时,所记录的持续时间即为热痛阈值(thermal withdrawl latency,TWL)。测量以60 s为最大阈值以防止大鼠皮肤烫伤,每只大鼠测量5次,每次间隔2 min以上,取各次测量均值。
1.4 大鼠DRG标本取材正常组大鼠及术后各时间点大鼠在痛阈监测完毕后以3%戊巴比妥钠腹腔麻醉(50 mg/kg),先以生理盐水300 mL行左心室快速灌注,再以4 ℃的4%多聚甲醛300 mL进行左心室灌注固定。固定结束后,沿背侧原手术切口切开,暴露并取出L5背根神经节。放置于4 ℃的30%蔗糖多聚甲醛液中后固定过夜,使DRG充分脱水。
1.5 免疫组化染色大鼠L5 DRG于冰冻切片机内切片,切片厚度为30 μm。切片行TH免疫组织化学染色:PBS漂洗10 min×3次;3%过氧化氢溶液中孵育30 min;PBS漂洗切片10 min×3次,中间加1次TritonX-100促进抗体渗透;羊封闭血清封闭40 min;PBS略洗约5 min;TH抗体按照1 ∶200浓度37 ℃孵育1 h,4 ℃过夜;PBS漂洗10 min×3次;生物素化的二抗孵育1 h;PBS漂洗切片10 min×3次后用VECTASTAIN ABC试剂孵育切片30 min;再次以PBS漂洗10 min×3次后DAB显色至显色清楚,充分冲洗切片;切片脱水透明,中性树胶封片。
1.6 图像软件分析应用ImageJ 1.47v图像分析软件(National Institutes of Health,USA)进行交感神经纤维数量评估。随机抽取每个DRG切片总数的1/3进行测定,切片在光镜(×400倍)下拍照。应用ImageJ图像分析软件测量所抽取切片中的交感神经纤维长度,并除以测量面积,得到交感神经纤维密度值,用以估算各背根神经节中交感神经纤维的数量。
1.7 统计学分析使用SPSS 18.0统计软件,计量资料以x±s表示,机械痛阈、热痛阈各时间点的比较及染色切片内交感神经数量的比较均采用单因素方差分析。
2 结果 2.1 髓核移植术后大鼠机械痛阈变化术后1周内,可见大鼠有抬高术侧后足,减少术侧后肢负重,舌舔术侧后肢现象,手术组较假手术组更为频繁。术后5 d内,手术组与假手术组大鼠术侧后足机械痛阈值低于正常组,说明2组大鼠对机械性刺激敏感性均明显增加。手术组大鼠术后7、14、20 d机械痛阈水平均明显低于假手术组和正常组(P<0.01,P<0.05,图 3)。假手术组术后1周时痛阈值开始出现明显恢复,手术组机械痛阈仍维持较低水平。
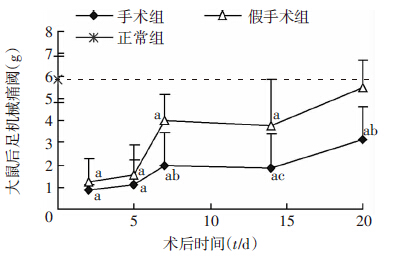 |
| a: P<0.01,与正常组比较;b: P<0.01,c: P<0.05,与假手术组比较 图 3 各组大鼠术后不同时间点机械性痛阈变化 |
术后5 d内,手术组与假手术组大鼠术侧后足热痛阈值低于正常组。手术组大鼠术后7、14、20 d热痛阈水平均明显低于假手术组和正常组(P<0.01,图 4)。假手术组术后1周时热痛阈值开始出现恢复,手术组热痛阈继续维持较低水平。
 |
| a: P<0.01,c: P<0.05,与正常组比较;b: P<0.01,与假手术组比较 图 4 各组大鼠术后不同时间点热痛阈变化 |
正常组大鼠DRG切片经过染色后,仅可见少量的交感神经纤维。手术组大鼠术后5 d,DRG切片经过染色后,可见交感神经纤维数量明显增多。交感神经纤维由DRG外周向DRG内部延伸生长,纤维数量增多、增粗(图 5)。手术组术侧DRG内交感神经数量在术后5、7、14、20 d均显著高于假手术组和正常组(P<0.01,图 6)。
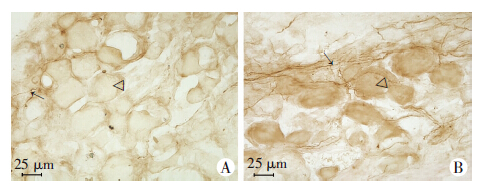 |
| ↑:交感神经纤维;△:感觉神经元 A:假手术组;B:手术组 图 5 TH免疫组织化学染色观察各组术后14 d DRG内交感神经数量及分布 |
 |
| a: P<0.01,与正常组比较;b: P<0.01,与假手术组比较 图 6 各组大鼠术后不同时间点背根神经节内交感神经数量 |
DRG位于脊髓和脊神经之间,其内含有假单极神经元,是外周感觉冲动传入的必经之路和重要“中继站”。DRG周围缺少神经束膜的保护,仅有一层可渗透性较强的结缔组织样包囊[6]。因此,DRG在感觉传导中起着重要作用却又容易受到周围环境的影响。正常情况下,外周的感觉信息通过DRG内假单极神经元传入到中枢系统从而引起痛觉,在某些病理状态下,这些神经元兴奋性增强,产生自发性放电,便可出现异常神经性疼痛[7]。本实验通过将大鼠自身尾部髓核移植到L5 DRG表面建立椎间盘髓核突出大鼠模型,观察DRG在髓核刺激情况下大鼠肢体痛敏变化与DRG内交感神经的生长变化。结果显示,术后手术组出现术侧肢体痛阈下降,这与椎间盘突出症的临床表现相似。虽然假手术组早期因手术创伤原因也出现痛阈降低,但随着创口愈合肢体的痛阈水平也得到明显恢复,而手术组痛阈在术后20 d仍维持较低水平。提示DRG在髓核刺激下可造成大鼠肢体的痛觉异常。
交感神经芽生现象在神经结扎动物模型及坐骨神经横断等周围神经损伤的动物模型中已被发现证实[8, 9]。研究表明出现交感神经芽生的DRG内神经元异常放电率升高,具有篮状结构的神经元自发放电则更加频繁,并且引起神经元放电的刺激阈值降低[10]。提示DRG交感神经芽生在某些神经病理性疼痛中发挥着重要作用。本实验通过对DRG内交感神经免疫组化染色证实,单纯自体髓核刺激下大鼠DRG内交感神经同样可以出现广泛的芽性生长。因此,我们推测,自体髓核作用下DRG交感神经芽生也许是椎间盘突出症引起神经性肢体疼痛的一个重要原因。
研究证实通过外科手术的方式切断特定部位的交感神经确实可以减轻某些神经病理性疼痛症状,因创伤导致的周围神经损伤所引起的异常疼痛也可以通过交感神经阻滞的方式得到解除[11]。Chung等[8]通过结扎大鼠单侧L5和L6脊神经后发现大鼠出现痛觉过敏,且术后DRG内交感神经大量芽生。在行交感神经切除术后大鼠痛觉过敏明显缓解,同时DRG内芽生的交感神经也几乎完全消失。Li等[12]向脊神经结扎大鼠模型DRG表面喷洒皮质激素,在减轻大鼠机械性痛敏的同时,也观察到DRG内出现的交感神经数量明显减少。因此,有理由相信DRG内交感神经芽生在神经病理性疼痛中有着重要作用。
本研究证实了单纯的椎间盘髓核同样可以引起DRG内交感神经纤维的广泛性生长,有助于进一步阐明椎间盘突出症的发病机制,对于椎间盘突出症的靶点治疗提供了新的研究切入点。 然而,本研究仅在动物行为学和组织学形态上进行了观察分析,对于DRG内交感神经芽生对神经病理性疼痛的具体作用机制还需后续研究进一步探讨。目前已有研究表明,DRG内神经生长因子(NGF)蛋白含量明显升高与DRG交感神经数量多少密切相关[13]。也有研究发现白介素-6(IL-6)、肿瘤坏死因子(TNF)等其他炎性因子也可能是引起DRG内交感神经芽生的重要因素[14]。但是DRG内交感神经芽生现象的具体发生机制是什么、是否是引起肢体疼痛、感觉异常的病理基础目前不明确,仍有待进一步的研究。
| [1] | Truumees E. A History of Lumbar Disc Herniation From Hippocrates to the 1990s[J]. Clin Orthop Relat Res, 2014, [Epub ahead of print]. |
| [2] | 王浩明, 李瀚卿, 施荣茂, 等. 椎间髓核摘除辅以Isobar后路动态固定治疗腰椎间盘突出症的临床分析[J]. 第三军医大学学报, 2013, 35(10): 1022-1026. |
| [3] | McLachlan E M, Janig W, Devor M, et al. Peripheral nerve injury triggers noradrenergic sprouting within dorsal root ganglia[J]. Nature, 1993, 363(6429): 543-546. |
| [4] | Xie W, Strong J A, Zhang J M. Increased excitability and spontaneous activity of rat sensory neurons following in vitro stimulation of sympathetic fiber sprouts in the isolated dorsal root ganglion[J]. Pain, 2010, 151(2): 447-459. |
| [5] | Shamji M F, Allen K D, So S, et al. Gait abnormalities and inflammatory cytokines in an autologous nucleus pulposus model of radiculopathy[J]. Spine (Phila Pa 1976), 2009, 34(7): 648-654. |
| [6] | Abram S E, Yi J, Fuchs A, et al. Permeability of injured and intact peripheral nerves and dorsal root ganglia[J]. Anesthesiology, 2006, 105(1): 146-153. |
| [7] | Xie W R, Deng H, Li H, et al. Robust increase of cutaneous sensitivity, cytokine production and sympathetic sprouting in rats with localized inflammatory irritation of the spinal ganglia[J]. Neuroscience, 2006, 142(3): 809-822. |
| [8] | Chung K, Chung J M. Sympathetic sprouting in the dorsal root ganglion after spinal nerve ligation: evidence of regenerative collateral sprouting[J]. Brain Res, 2001, 895(1/2): 204-212. |
| [9] | Ramer M S, Murphy P G, Richardson P M, et al. Spinal nerve lesion-induced mechanoallodynia and adrenergic sprouting in sensory ganglia are attenuated in interleukin-6 knockout mice[J]. Pain, 1998, 78(2): 115-121. |
| [10] | Xie W, Strong J A, Mao J, et al. Highly localized interactions between sensory neurons and sprouting sympathetic fibers observed in a transgenic tyrosine hydroxylase reporter mouse[J]. Mol Pain, 2011, 7: 53. |
| [11] | Malmberg A B, Basbaum A I. Partial sciatic nerve injury in the mouse as a model of neuropathic pain: behavioral and neuroanatomical correlates[J]. Pain, 1998, 76(1/2): 215-222. |
| [12] | Li J Y, Xie W, Strong J A, et al. Mechanical hypersensitivity, sympathetic sprouting, and glial activation are attenuated by local injection of corticosteroid near the lumbar ganglion in a rat model of neuropathic pain[J]. Reg Anesth Pain Med, 2011, 36(1): 56-62. |
| [13] | Saygili E, Schauerte P, Pekassa M, et al. Sympathetic neurons express and secrete MMP-2 and MT1-MMP to control nerve sprouting via pro-NGF conversion[J]. Cell Mol Neurobiol, 2011, 31(1): 17-25. |
| [14] | Liu B, Li H, Brull S J, et al. Increased sensitivity of sensory neurons to tumor necrosis factor alpha in rats with chronic compression of the lumbar ganglia[J]. J Neurophysiol, 2002, 88(3): 1393-1399. |



