2. 571199 海口,海南医学院:科学实验中心
2. Scientific Experiment Center, Hainan Medical University, Haikou, Hainan Province, 571199, China
类鼻疽是一种由类鼻疽伯克霍尔德菌(Burkholderia pseudomallei)所致的地方性人兽共患传染病[1]。类鼻疽致死率高,临床表现多样且缺乏特异性,容易被误诊为肺炎、肺结核、肺脓肿或其他化脓菌所致的败血症,又俗称“似百样病”;此外,类鼻疽伯克霍尔德菌对多种常用抗生素天然耐药,这些特点均给临床诊断和治疗带来很大困难。该病主要分布于南北纬20°之间的热带地区,如澳大利亚北部和东南亚地区。我国主要分布于海南、广东、广西,海南是中国目前类鼻疽伯克霍尔德菌分离率最高的地区,其流行的严峻性并不为人们警觉[2]。
快速诊断类鼻疽伯克霍尔德菌感染是治疗和预防类鼻疽病的关键。虽然传统的培养法方法是诊断类鼻疽的标准方法,但是需要一定的培养和鉴定时间,容易错过最佳治疗时机,且准确率还有待提高[3]。免疫学方法常用的ELISA检测类鼻疽伯克霍尔德菌特异性抗体,在类鼻疽伯克霍尔德菌感染上也存在诸多问题,因为在类鼻疽伯克霍尔德菌感染时不能有效地刺激宿主产生抗体,同时类鼻疽伯克霍尔德菌抗原与马鼻疽伯克霍尔德菌和其他假单胞菌存在共同抗原,特异性较差[4]。近年来,类鼻疽伯克霍尔德菌的分子诊断方法引起研究者的关注。如采用常规PCR检测类鼻疽伯克霍尔德菌,但常规PCR方法存在操作步骤多、易污染,目前还不能直接检测临床标本等缺点[5]。而在进行类鼻疽伯克霍尔德菌自然疫源地调查时,发现该菌在土壤和水源中的数量与人的类鼻疽的发病率有一定相关性[6],上述方法均无法进行准确定量。国外学者开发了一种以16S RNA作为靶序列的定量PCR方法,但其临床应用效果也不理想[7]。本研究通过以类鼻疽伯克霍尔德菌的高度保守序列——Ⅲ型分泌系统基因为靶序列,建立了一种快速、准确、价廉、操作简单的检测类鼻疽伯克霍尔德菌的荧光定量PCR方法。以该法对临床常见病原菌和类鼻疽伯克霍尔德菌临床分离株进行检测,且初步应用于土壤中类鼻疽伯克霍尔德菌的定量检测,以期为该菌的临床诊断和流行病学调查提供可靠方法。
1 材料与方法 1.1 材料 1.1.1 菌株类鼻疽伯克霍尔德菌标准株K96243和临床分离株(经梅里埃生化鉴定板和16S RNA测序鉴定),常见致病微生物包括:金黄色葡萄球菌(ATCC26001)、铜绿假单胞菌(AT27853)、大肠埃希菌(ATCC25922)、福氏志贺菌(ATCC51207)、伤寒沙门菌(ATCC6539)、粪链球菌(ATTCC 32220)、白假丝酵母菌(ATTCC 10231)、洋葱伯克霍尔德菌(临床分离株)。由海南医学院病原微生物学实验室提供。
1.1.2 试剂Taq PCR master Mix、普通琼脂糖胶DNA回收试剂盒、FastFire定量PCR Mix(探针法)购自天根科技有限公司;感受态细胞、PEASY-T1 simp克隆载体购自北京全式金生物技术有限公司;无内毒素质粒小提试剂盒、土壤基因组DNA提取试剂盒购自北京索莱宝科技有限公司。Ashdown肉汤和选择琼脂均由本实验室配制。
1.1.3 仪器PCR 仪(珠海黑马公司);Mx3005 PQPCR System荧光定量PCR仪(美国Agilent公司);Tanon 1600电泳成像系统;Ⅲ级生物安全柜,AutoScan4自动微生物分析系统(美国德灵公司)。
1.2 标本模拟阳性血液标本:从临床分离16株鉴定为类鼻疽伯克霍尔德菌配制为104CFU/mL菌液的类鼻疽伯克霍尔德菌分别种植1 mL无菌血液中。模拟阴性血液标本:临床常见8种病原微生物分别种植1 mL无菌血液中。土壤标本:在海口市周边公路旁的稻田中采集67份土壤标本,取3 g土壤标本加入5 mL Ashdown肉汤振荡2 h,42 ℃增菌培养2 d。增菌液接种到Ashdown,选择琼脂42 ℃培养24~48 h。观察到典型菌落后,转种血平板,并采用细菌生化鉴定板和16S RNA测序对其鉴定。取1 g土壤标本,按土壤基因组DNA提取试剂盒说明书提取总DNA后,采用本法和对照方法检测。
1.3 标准质粒的构建通过生物信息学分析,选取以类鼻疽伯克霍尔德菌Ⅲ型分泌系统DNA序列(GenBank号:HM_235934)作为靶序列。用Primer Premier 5.0软件设计引物,P1:5′-CGTCTCTATACTGTCGAGCAATCG-3′,P2:5′-CG- TGCACACCGGTCAGTATC-3′,扩增产物为135 bp。扩增条件为95 ℃ 5 min 1个循环;95 ℃ 40 s,60 ℃ 40 s,72 ℃ 40 s共35个循环;72 ℃ 5 min。PCR产物经琼脂糖凝胶电泳检测后,经胶回收,核酸定量,然后克隆进T载体,转化入DH5α,用选择平板筛选出阳性克隆,于LB肉汤增菌,提取重组质粒进行PCR扩增和DNA测序鉴定。
1.4 荧光定量PCR扩增条件优化用Primer Premier 5.0软件设计引物和荧光探针,引物P1:5′-CGTCTCTATACTGTCGAGCAATCG-3′,P2:5′-CGTGCACACCGGTCAGTATC-3′;荧光探针:FAM-5′-CCGAATCTGGATCACCACCACTTTC-3′-BHQ1;扩增产物为135 bp。整个优化过程中以最低循环阈值(Ct值)和最高值荧光强度增加值为标准进行选择。选用25 μL反应体系:上下引物分别为0.75 μL;荧光探针0.5 μL;标准质粒2 μL;Taq PCR master Mix 12.5 μL;加ddH2O 8.5 μL 补充至25 μL。实时定量PCR反应条件为:50 ℃ 2 min 1个循环,95 ℃ 5 min 1个循环,95 ℃ 15 s,60 ℃ 60 s共40个循环。
1.5 标准曲线的建立
采用紫外分光光度计对质粒进行测定,换算出标准品质粒浓度后,进行10倍比稀释,7个浓度的标准品浓度为1×102~1×108 拷贝/μL,并用ddH2O做阴性对照进行荧光定量PCR,所得的荧光扩增曲线经电脑软件处理获得标准曲线。
1.6 方法学评价 1.6.1 线性范围通过软件处理获得标准曲线回归方程,计算出其在重组质粒DNA以10倍连续稀释至7管稀释度范围内的r值。
1.6.2 灵敏度根据标准曲线,维持r值在0.99以上,判断方法的线性范围。将质粒以10倍连续稀释,用ddH2O做阴性对照,进行定量PCR能区别于阴性对照的最低质粒浓度就为该法的灵敏度。
1.6.3 重复性对3个确定的高浓度、中浓度和低浓度的标准品进行相同样品间的重复检测4次,计算均值x、s和变异系数(CV),计算批内重复性。
1.6.4 特异性对不同的常见致病微生物用与类鼻疽伯克霍尔德菌相同的荧光定量PCR条件进行检测,鉴定其特异性。
1.6.5 方法对比参照文献[7]所描述的定量PCR方法,与本法同时对模拟血液标本和土壤标本进行检测,对检测结果进行配对秩和检验和相关性分析。
2 结果 2.1 标准质粒的构建及鉴定对提取细菌基因组DNA进行普通PCR,经琼脂糖凝胶电泳,类鼻疽伯克霍尔德菌DNA标本扩增出约135 bp的产物,结果见图 1。质粒构建成功后送上海生工测序,结果显示与预期DNA序列相同,无突变。
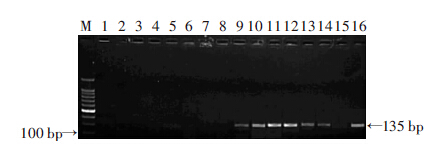 |
| M:DNA 标准;1~8:依次为金黄色葡萄球菌、铜绿假单胞菌、大肠埃希菌、福氏志贺菌、伤寒沙门菌、粪链球菌、白假丝酵母菌、洋葱伯克霍尔德菌;9~14:6个临床阳性标本;15:阴性对照;16:阳性对照图 1 类鼻疽伯克霍尔德菌Ⅲ型分泌系统基因扩增片段 |
土壤标本中类鼻疽伯克霍尔德菌在Ashdown选择琼脂上培养48 h后,可见紫色、干燥、具有皱褶的典型类鼻疽伯克霍尔德菌菌落(图 2)。转种血平板,培养48 h后,可见不规则的皱褶,中间凸起呈同心圆状,典型的银灰色光泽的菌落(图 3)。革兰染色可见短小的革兰阴性球杆菌,经梅里埃生化鉴定板和16S RNA测序鉴定为类鼻疽伯克霍尔德菌。
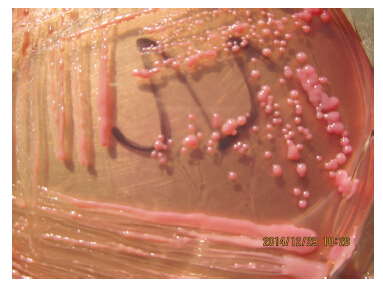 |
| 图 2 土壤标本分离类鼻疽伯克霍尔德菌在Ashdown选择琼脂上培养48 h后的菌落 |
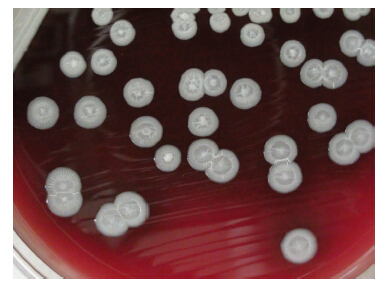 |
| 图 3 土壤标本分离类鼻疽伯克霍尔德菌在血平板上培养48 h后的菌落 |
7个浓度的标准品:1×102~1×108拷贝/μL,分别做荧光定量PCR,得到荧光扩增曲线和标准曲线,1拷贝/μL=10(-0.3.354Ct + 12.14),r为0.995(图 4)。
 |
| 从左至右代表的浓度为1×108、1×107、1×106、1×105、1×104、1×103、1×102拷贝/μL图 4 不同浓度标本荧光定量PCR扩增曲线 |
在重组质粒DNA稀释度在1×101~1×1010拷贝/μL时,r=0.999。
2.5.2 灵敏度本方法能区别于阴性对照的最低模板浓度,即灵敏度为10 拷贝/μL。
2.5.3 特异性用已建立的检测方法同时检测类鼻疽伯克霍尔德菌、金黄色葡萄球菌、铜绿假单胞菌、大肠埃希菌、福氏志贺菌、伤寒沙门菌、粪链球菌、白假丝酵母菌、洋葱伯克霍尔德菌。结果只有类鼻疽伯克霍尔德菌出现特异性扩增曲线,其他细菌均无特异性扩增曲线,为阴性。说明本研究建立的方法具有高度的特异性。
2.5.4 重复性分别对3个确定的高浓度(1×1010 拷贝/μL)、中浓度(1×106 拷贝/μL)和低浓度(10拷贝/μL)的 标准品进行批内重复性测定,结果见图 5。计算其Ct值的 和s,高浓度标准品Ct值为(12.07±0.17),批内CV为1.43%;中浓度标准品Ct值为(21.00±1.20),批内CV为4.6%;低浓度标准品Ct值为(32.90±0.64),批内CV为1.9%。
 |
| 从左至右代表为高、中、低浓度的标准品图 5 不同浓度标本荧光定量PCR扩增曲线 |
16S rRNA基因为靶序列的荧光定量PCR方法与本法均对模拟血液标本和土壤标本进行检测,其中模拟标本两种方法结果准确一致。但67份土壤标本中,12份标本采用本法和细菌培养法均为阳性,参考方法只检测出其中10份标本,其中2份类鼻疽伯克霍尔德菌含量较低的标本未能够检出。两种方法对10份阳性的土壤标本的定量结果见表 1。数据呈偏态分布,采用配对秩和检验,两种定量方法无统计学差异(M=1,P=0.754),相关性分析结果显示,呈高度相关(r=0.92,P<0.05)。
| 编号 | 本法 | 对照方法 |
| 1 | 2×104 | 1.95×104 |
| 2 | 4×103 | 2.29×103 |
| 3 | 8×103 | 8.45×103 |
| 4 | 1.6×106 | 1.87×106 |
| 5 | 3.2×103 | 3.1×103 |
| 6 | 6.4×102 | 6.67×102 |
| 7 | 1.28×105 | 7.78×104 |
| 8 | 2.56×102 | 2.7×102 |
| 9 | 5.12×103 | 4.03×103 |
| 10 | 1.56×103 | 5.51×102 |
| 11 | 1.38×102 | 阴性 |
| 12 | 8.7×102 | 阴性 |
类鼻疽伯克霍尔德菌的自然疫源地主要在热带和亚热带地区,我国的类鼻疽流行区域主要在南方地区,以海南最为多见,具有多重耐药、易播散、感染症状不典型等特点,给临床诊断和治疗带来很大困难,早期相关文献报道其病死率达90%,随着抗生素的发展和检验技术的进步,病死率仍然高达60%[8, 9]。此外,类鼻疽伯克霍尔德菌流行区分布呈现明显地域性,主要集中在南北纬20°之间,如东南亚、澳洲北部;我国大陆发现类鼻疽伯克霍尔德菌的地区主要为南方沿海平原地区,如海南、广东、广西、湖南、贵州、福建各省的部分地区以及香港、台湾地区,其中海南是我国类鼻疽伯克霍尔德菌分离率最高,报道病例最多的地区[10]。类鼻疽伯克霍尔德菌通过接触、吸入或吞食引起人畜感染,目前尚无有效的疫苗。随着全球人类及动物的大规模、远距离旅行及迁徙行为发生,国外已经有较多到类鼻疽伯克霍尔德菌疫区旅游后感染类鼻疽伯克霍尔德菌的报道[11],类鼻疽将可能成为一类新兴传染病,而且该菌在土壤和水源中的数量与人类鼻疽的发病率有一定相关性[6]。因此,对类鼻疽伯克霍尔德菌自然疫源地的调查,同时了解环境中类鼻疽伯克霍尔德菌的数量对该病的防治有重要意义。快速诊断类鼻疽伯克霍尔德菌感染是治疗和预防类鼻疽病的关键,而目前尚无较好的方法应用于临床,用于检测环境中该菌数量的定量方法也较少。
2004年,美国临床实验室标准化委员会(national committee for clinical laboratory standards,NCCLS)将类鼻疽伯克霍尔德菌归为可能成为生物恐怖的细菌,要求在3级生物安全实验室进行分离培养[12]。实际上多数医院检验科根本达不到3级生物安全实验室标准,所以目前医院检验科分离、培养和鉴定该菌存在隐患,而且传统的培养法方法虽能作出初步诊断,但是需要一定的培养和鉴定时间,常常延误确诊时间和错过治疗最佳时机[3]。由于目前筛选的类鼻疽伯克霍尔德菌抗原特异性较差,所以免疫学方法在用于临床实验室诊断上一直存在很大的争议[4]。近年来,类鼻疽伯克霍尔德菌的分子诊断方法引起学者的关注。如采用常规PCR方法检测鉴定类鼻疽伯克霍尔德菌,但常规PCR方法存在操作步骤多、容易污染等缺点,限制了其在临床应用,此外其灵敏度也远远低于荧光定量PCR。而国外学者发现以16S RNA作为靶序列的定量PCR方法在临床应用中也未达到理想效果[7]
发展迅猛的荧光定量PCR技术,因其信号检测与PCR扩增同管、同步进行,属于均相测定,故可减少污染,操作简化,并且可自动化完成扩增及定量检测。因此在其发明后极短时间内,就广泛应用到临床分子诊断中[13]。本研究旨在建立一种快速检测类鼻疽伯克霍尔德菌的荧光定量PCR,用于临床该病的实验室诊断和环境标本中该菌含量的检测。orf2是类鼻疽伯克霍尔德菌Ⅲ型分泌系统(type Ⅲ secretion system,TTS1)特异性基因,在所有的类鼻疽伯克霍尔德菌中包含该基因,而在其具有亲缘关系的鼻疽伯克霍尔德菌(Burkholderia mallei)和泰国伯克霍尔德菌(Burkholderia thailandensis)中不存在[14]。本实验正是根据该基因设计引物和探针。通过多种临床其他常见病原菌进行鉴定,该引物和探针只能扩增类鼻疽伯克霍尔德菌,而其他菌属的病原菌均无扩增信号产生,说明本实验所建立的定量PCR方法特异性很高。本实验又对重复性进行了评价,结果显示高、中、低3种浓度标本的批内变异系数<5%,说明重复性良好。为了进一步验证本方法在检测实际样本中的可靠性,制备了24份模拟双盲样本,检测结果与制备双盲样本的类型完全相同。同时,为验证其在环境标本检测的性能,我们采集了67份海南地区的土壤标本,同时采用培养法、本法和对照方法进行检测,结果显示本法结果与培养方法一致,灵敏度高于国外文献[7]所描述的方法。培养法需要至少5 d,获得的仅仅是定性结果,本方法设立了阴性、阳性对照,一次加样,减少了操作步骤,闭管检测,整个操作可在2 h内完成,得到的是定量结果。无论从检测时间、灵敏度、特异性还是定量数据上比较,本研究建立的快速检测类鼻疽伯克霍尔德菌荧光定量PCR方法相对于其他传统方法或同类方法均有较大优势。
综上所述,本研究建立的检测类鼻疽伯克霍尔德菌的荧光定量PCR方法具有快速、检测范围宽、灵敏度高、特异性好等优点,为类鼻疽伯克霍尔德菌的临床诊断和流行病学调查提供了一种可选择的技术。
| [1] | Leelarasamee A,Bovornkitti S,Melioidosis:review and update [J]. Rev Infect Dis,1989,11(3):413-425. |
| [2] | 刘青芹,段雄波,李金钟. 类鼻疽伯克霍尔德菌分离鉴定进展[J]. 中国人兽共患病学报,2008, 24(10): 970-973. |
| [3] | Glass M B,Popovic T. Preliminary evaluation of the API 20NE and RapID NF plus systems for rapid identification of Burkholderia pseudomallei and B. mallei[J]. J Clin Microbial,2005,43(1): 479-483. |
| [4] | Anuntagool N,Wuthiekanun V,White N J,et al. Lipopolysaccharide heterogeneity among Burkholderia pseudomallei from different geographic and clinical origins[J]. Am J Trop Med Hyg,2006,74(3):348-352 . |
| [5] | 杨小敏,方瑶,顾江,等. 特异引物PCR鉴定类鼻疽伯克霍尔德菌方法的建立和优化[J]. 第三军医大学学报,2011,33(14): 1427-1431. |
| [6] | Suputtamongkol Y,Chaowagul W,Chetchotisakd P,et al. Risk factors for melioidosis and bacteremic melioidosis [J]. Clin Infect Dis,1999,29(2): 408-413. |
| [7] | Chantratita N,Wuthiekanun V,Limmathurotsakul D,et al. Prospective clinical evaluation of the accuracy of 16S rRNA real-time PCR assay for the diagnosis of melioidosis[J]. Am J Trop Med Hyg,2007,77(5):814- 817. |
| [8] | Vongphayloth K,Rattanavong S,Moore C E,et al. Burkholderia pseudomallei detection in surface water in southern Laos using Moore’s swabs[J]. Am J Trop Med Hyg,2012,86(5): 872-877. |
| [9] | 毛旭虎. 加强类鼻疽的研究[J]. 第三军医大学学报,2011,33(13): 1315-1317. |
| [10] | 宋阳. 类鼻疽杆菌: 一个有待认识的环境卫生问题[J]. 中国公共卫生,2001,17(5): 473-745. |
| [11] | Wilks D,Jacobson S K,Lever A M,et al. Fatal melioidosis in a tourist returning from Thailand[J]. J Infect , 1994,29(1): 87-90. |
| [12] | NCCLS. Performance standards for antimicrobial susceptibility testing,Fourteenth informational supplement[J]. NCCLS,2004,24(1): 1-159. |
| [13] | 夏乾峰,文阳安,刘靳波,等. 新型二聚体突变荧光引物定量PCR方法的建立及其在检测HCV的应用[J]. 中华检验医学杂志,2011,34(8): 735-738. |
| [14] | Smith-Vaughan H C,Gal D,Lawrie P M,et al. Ubiquity of putative type Ⅲ secretion genes among clinical and environmental Burkholderia pseudomallei isolates in Northern Australia[J]. J Clin Microbiol,2003,41(2):883-885. |



