急性心肌梗死在我国有着很高的发病率和病死率。而心肌的缺血再灌注损伤(ischemia reperfusion injury,IRI)可加重心肌结构破坏和功能障碍,是影响心肌梗死治疗及预后的重要因素[1]。目前研究者们针对防治心肌缺血再灌注损伤进行了大量的基础及临床研究,建立了诸如通过降低活性氧生成[2]、改善线粒体能量代谢[3]等阻止心肌细胞凋亡坏死的途径以及促进心肌细胞再生[4]等策略和靶点,取得了一定的成果,但其效果及安全性等尚有待进一步证实,因此寻找一种新的改善心脏缺血再灌注损伤的方法成为了研究热点。研究表明饱食状态下的大鼠心脏对缺血再灌 注损伤具有较好的耐受性[5]。而受进食影响最大的是胃肠道激素,其中循环中的胃泌素是其他胃肠道激素的10~20倍[6]。既往研究认为胃泌素具有增强细胞缺氧耐受[7]以及抗凋亡[8]作用,那么胃泌素是否参与了饱食状态下对心脏缺血再灌注损伤的保护作用?机制是什么?目前尚不清楚。因此,本实验通过观察胃泌素在SD大鼠离体心脏缺血再灌注中的影响,探讨胃泌素预处理对心脏缺血再灌注损伤的保护作用及机制。 1 材料与方法 1.1 试剂与耗材
胃泌素(gastrin Ⅰ)、2.5%戊巴比妥钠、氯化三苯基四氮唑(TTC)、抗Tropomyosin抗体(Sigma,美国);STAT3、磷酸化STAT3(p-STAT3)、GAPDH抗体(Santa Cruz,美国);TUNEL试剂盒(Roche Applied Bio Sciences,德国); PowerLab多通道生理记录仪(AD Instruments,澳大利亚);荧光显微镜(TOKYO,日本);K-H缓冲液包括(mmol/L):118 NaCl,4.8 KCl,1.2 MgSO4,1.2 CaCl2,25 NaHCO3,1.2 KH2PO4以及11 Glucose(pH=7.4),试剂均为市售分析纯产品。
1.2 实验动物与分组
12~15周龄SPF级雄性SD大鼠(体质量250~300 g)48只,由第三军医大学大坪医院野战外科研究所实验动物中心提供。采用随机数字表法将其分为4组(n=12,其中随机6只检测左心室功能、TTC染色及心肌酶谱,其余6只进行TUNEL及Western blot检测):空白组(B组),持续K-H缓冲液灌注130 min;胃泌素预处理组(GS组),K-H缓冲液灌注10 min,离体心脏跳动达到稳定状态后给予胃泌素(10-9mol/L)预处理20 min,再给予K-H缓冲液灌注100 min;缺血再灌注组(IR组),全心阻断灌注前给予K-H缓冲液灌注30 min,阻断灌注40 min后给予K-H缓冲液灌注60 min;缺血再灌注胃泌素预处理组(GIR组),K-H缓 冲液灌注10 min后给予胃泌素预处理20 min,然后阻断全心灌注,阻断40 min后给予K-H缓冲液灌注60 min。 1.3 Langendorff 离体心脏灌注模型的建立
SD大鼠给予肝素(300 U)腹腔注射抗凝,20 min后用2.5%戊巴比妥钠(50 mg/kg)腹腔麻醉。麻醉完全后剪开胸骨,快速剪取心脏,放入4 ℃ K-H缓冲液中,排空心腔内残血,迅速移至Langendorff 装置上,以95%O2~5% CO2的混合气体饱和的K-H缓冲液(pH值7.35~7.40)在恒温(37 ℃)、恒流(12 mL/min)条件下灌注。在肺动脉圆锥处剪一小口,使冠脉流出液自然流出。剪开左心耳,将连接有测压导管的心室球囊送入左心室,另一端连接多导生理记录仪,向心室球囊内缓慢注射适量生理盐水,使左心室舒张末压保持在5~10 mmHg,10 min后心脏搏动达到稳定状态。再灌注结束后取下心脏放入-80 ℃冰箱保存待用。 1.4 心功能指标观察
每组随机选定6只SD大鼠进行左心功能测定。设定心脏缺血前即刻为T0,再灌注15(T1)、30(T2)、45(T3)、60 min(T4)。用PowerLab多通道生理信号采集处理系统分别记录各个时刻的左室舒张末压(LVEDP)、左室发展压(LVDP)、左心室内压最大上升速率(+dp/dtmax)的波形及数值。 1.5 心肌梗死面积测定
每组随机选定6只SD大鼠进行TTC染色。再灌注结束后,心脏组织立即置于-80 ℃冰箱冷冻2 h,将冷冻后的心脏从心尖到心基底部平行切成0.2 cm厚薄片6片,放入l%TTC溶液(pH 7.4)中37 ℃温孵15 min 染色,存活的心肌将被染成红色,梗死区心肌呈灰白色。用Image J图像分析软件计算心肌梗死面积百分比(心肌梗死面积=梗死心肌面积/总心肌面积×100%)。 1.6 心肌酶谱检测
于T0、T4时间点收集冠状窦流出液,采用ELISA法分别检测其中乳酸脱氢酶(LDH)及肌酸激酶同工酶(CK-MB,南京建成生物工程研究所)的浓度。 1.7 TUNEL试剂盒检测凋亡
每组随机选定6只SD大鼠进行TUNEL试剂盒检测。将4%多聚甲醛固定的心肌组织常规石蜡包埋并做心肌组织切片,经脱蜡、脱水及抗原修复后,用抗tropomyosin抗体染色心肌肌小节,用TUNEL试剂盒进行心肌细胞的凋亡染色,DAPI染色细胞核,荧光显微镜照相,统计TUNEL阳性细胞百分率(TUNEL阳性细胞数/总细胞数×100%)。 1.8 Western blot 检测STAT3及p-STAT3蛋白表达
每组随机选定6个心脏标本按组织总蛋白的提取方法提取总蛋白,25 μg蛋白进行SDS-PAGE电泳分 离,电泳后电转于硝酸纤维素膜上,5%脱脂牛奶室温封闭90 min。分别孵育STAT3抗体(1 ∶800),p-STAT3抗体(1 ∶800),4 ℃过夜。TBST洗涤3次,加入1 ∶15 000 稀释的荧光二抗,室温避光孵育90 min,TBST洗涤3次,通过荧光扫描仪(LI-COR,美国)采集信号,Quantity One软件分析计算灰度值。 1.9 统计学处理
采用SPSS 16.0统计软件进行分析,计量数据以x±s 表示,组间比较行单因素方差分析,组内差异比较行重复测量数据的方差分析。 2 结果 2.1 SD大鼠离体心脏左心室功能
如表 1所示,在T0时各组间左心室功能数据无统计学差异(P>0.05)。在T1、T2、T3、T4时间点,B组与GS组间左心室功能无统计学差异(P>0.05),与B组和GS组比较,IR组与GIR组LVEDP升高,LVDP与+dp/dt下降,有统计学差异(P<0.05);与IR组比较,GIR组LVEDP下降,而LVDP与+dp/dt升高,有统计学差异(P<0.05)。
| 组别 | LVEDP(mmHg) | ||||
| T0 | T1 | T2 | T3 | T4 | |
| B组 | 7.2±0.4 | 7.7±0.2 | 8.4±0.3 | 8.9±0.3 | 9.6±0.3 |
| GS组 | 7.4±0.5 | 7.5±0.4 | 7.7±0.6 | 8.5±0.5 | 9.1±0.3 |
| IR组 | 7.8±0.4 | 88.3±6.0ab | 75.3±4.0ab | 64.3±3.3ab | 56.7±2.2ab |
| GIR组 | 7.0±0.3 | 42.4±5.1abc | 32.5±3.1abc | 30.6±3.7abc | 25.5±3.5abc |
| 组别 | LVEDP(mmHg) | ||||
| T0 | T1 | T2 | T3 | T4 | |
| B组 | 92.5±3.4 | 91.8±3.3 | 89.4±3.1 | 87.5±2.7 | 85.1±2.3 |
| GS组 | 93.0±4.3 | 91.7±4.0 | 90.9±4.1 | 89.7±3.9 | 87.8±3.4 |
| IR组 | 91.9±4.0 | 7.2±2.2ab | 14.0±2.3ab | 18.2±2.4ab | 20.8±2.1ab |
| GIR组 | 90.1±0.9 | 18.2±2.7abc | 37.6±6.5abc | 49.7±5.8abc | 56.2±5.5abc |
| 组别 | +dp/dtmax(mmHg/s) | ||||
| T0 | T1 | T2 | T3 | T4 | |
| B组 | 3 675.6±218.5 | 3 586.3±192.5 | 3 492.3±190.8 | 3 381.0±166.9 | 3 219.8±183.8 |
| GS组 | 3 832.8±132.0 | 3 690.2±143.6 | 3 514.5±145.5 | 3 453.7±133.8 | 3 280.4±140.1 |
| IR组 | 3 768.0±122.5 | 202.3±24.4ab | 272.9±41.9ab | 414.1±91.7ab | 540.8±88.5ab |
| GIR组 | 3 818.6±248.7 | 450.9±80.9abc | 626.3±131.8abc | 1 016.8±163.6abc | 1 394.2±173.0abc |
| a:P<0.05,与B组比较;b:P<0.05,与GS组比较;c:P<0.05,与IR组比较 | |||||
B组(1.7±0.4)%与GS组(1.8±0.5)%未进行缺血处理,TTC染色心肌梗死面积两组间无统计学差异(P>0.05)。与B组和GS组比较,IR组(36.3±3.0)与GIR组(16.5±0.9)心肌梗死面积增加,有统计学差异(P<0.05)。与IR组比较,GIR组心肌梗死面积减少,有统计学差异(P<0.05,图 1)。
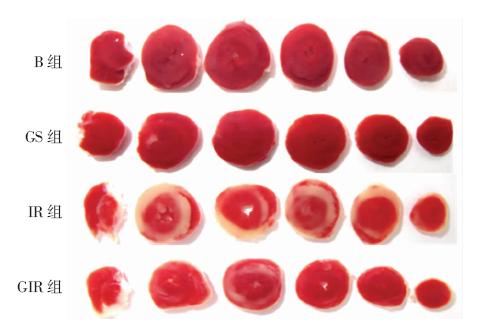 |
| 每组从左到右代表心脏组织心底到心尖部图 1 各组大鼠心肌梗死面积大体形态观察 |
在T0时间点,各组LDH、CK-MB浓度无统计学差异(P>0.05)。在T4时间点,B组与GS组间LDH、CK-MB无统计学差异(P>0.05);与B组和GS组比较,IR组与GIR组的LDH、CK-MB均显著升高(P<0.05);与IR组比较,GIR组的LDH、CK-MB明显下降(P<0.05,表 2)。
| 组别 | LDH | CK-MB | ||
| T0 | T4 | T0 | T4 | |
| B组 | 16.0±3.5 | 50.8±7.1 | 2.7±0.3 | 5.9±0.4 |
| GS组 | 16.3±3.0 | 48.9±6.0 | 2.4±0.6 | 6.4±0.9 |
| IR组 | 16.1±6.0 | 297.5±45.2ab | 2.7±0.4 | 76.8±18.6ab |
| GIR组 | 18.0±3.3 | 151.6±21.2abc | 3.1±0.2 | 28.7±4.9abc |
| a:P<0.05,与B组比较;b:P<0.05,与GS组比较;c:P<0.05,与IR组比较 | ||||
免疫荧光染色显示,B组与GS组未见明显TUNEL阳性细胞,在IR组与GIR组中可见TUNEL阳性细胞;与IR组比较,GIR组阳性细胞数减少。统计TUNEL阳性细胞所占百分数,B组(0.7±0.3)与GS组间(0.6±0.2)差异无统计学意义(P>0.05);同B组和GS组比较,IR组(19.2±1.0)与GIR组(14.2±1.0)均显著升高(P<0.05);同IR组比较,GIR组阳性率明显下降(P<0.05,图 2)。
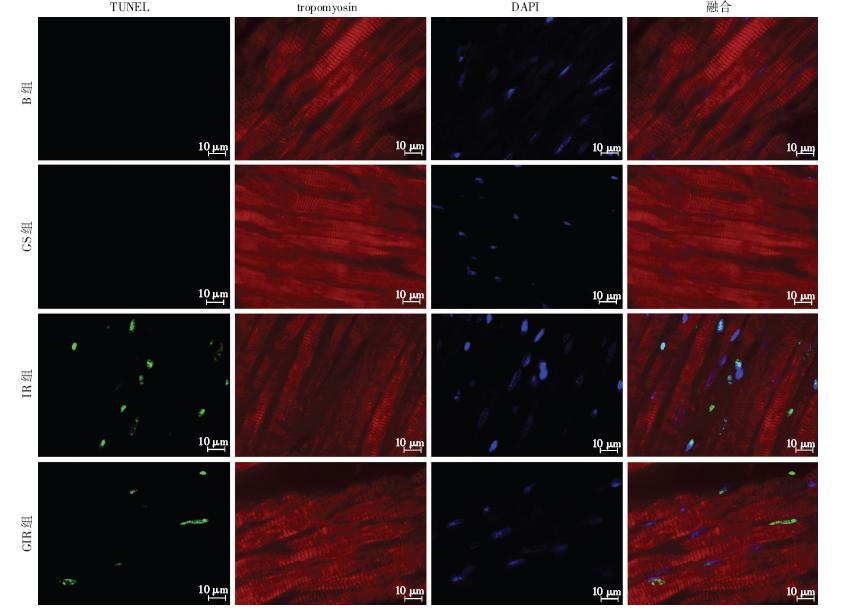 |
| 图 2 荧光显微镜下观察各组大鼠心肌组织形态学变化 |
心肌STAT3蛋白与其p-STAT3蛋白表达改变Western blot检测结果显示,B组p-STAT3蛋白表达水平与STAT3蛋白表达灰度比值(0.65±0.08)与GS组(0.76±0.09)间比较差异无统计学意义(P>0.05)。与B组和GS组比较,IR组(1.14±0.10)和GIR组(1.63±0.10)均有统计学差异(P<0.05)。与IR组比较,GIR组p-STAT3蛋白表达水平明显升高(P<0.05,图 3)。
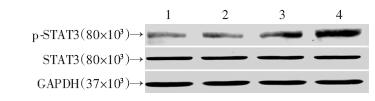 |
| 1:B组;2:GS组;3:IR组;4:GIR组图 3 Western blot检测各组大鼠心肌STAT3与p-STAT3 蛋白表达 |
急性心肌梗死是威胁人类生命的最主要疾病之一,尽快恢复冠状动脉的血液灌注是治疗急性心肌梗死最直接有效的方法。然而,研究发现心肌缺血后的再灌注治疗会加重心肌的损伤,表现为心肌梗死面积增加、心功能显著下降等。改善心脏缺血再灌注损伤,对于急性心肌梗死的治疗效果以及预后等有着重要的意义。
胃泌素是重要的胃肠道激素之一,属CCK家族成员,分子量为2 100,含有17或34个氨基酸的多肽,主要由胃、十二指肠的G细胞合成并分泌,受饮食中蛋白含量影响明显,全身分布广泛。作为一种经典的消化道激素,其生物学功能是促进胃酸分泌[9]及营养胃肠道黏膜[10]。此外,研究发现胃泌素与表皮细胞生长因子协同作用,诱导胰岛β细胞的增生以及促进胰岛素的释放,预防胰岛素抵抗的发生[11]。胃泌素受体(CCK-AR、CCK-BR以及CCK-CR)属于G蛋白偶联受体,在全身多个器官组织中表达较高,包括肾脏、心肌和冠状动脉[12],与胃泌素亲和力最强的受体是CCK-BR[13]。在肾脏中,胃泌素和CCK-BR通过与多巴胺受体的相互作用,促进大鼠肾脏利尿排钠,从而影响大鼠血压[14]。在心脏中,有研究发现给予冠状动脉内注射胃泌素可增加动物的冠脉流量及左心室功能[12],说明胃泌素与心血管系统之间存在着密切联系。本研究应用Langendorff系统建立离体心脏缺血再灌注损伤模型,除去神经体液因素影响,同时通过GS组与B组的比较,可知本研究中10-9mol/L的胃泌素未见明显冠脉扩张作用,对实验结果无影响,在此基础上进一步探讨了胃泌素在心肌缺血再灌注损伤中的作用。本研究证明:缺血再灌注损伤后左心室功能受损,心肌梗死面积增大,心肌酶释放增加,心肌细胞凋亡增加;但在缺血前给予胃泌素预处理后,可发现缺血后左心室功能恢复明显改善,心肌梗死面积显著减少,心肌酶释放受到抑制,同时TUNEL染色发现心肌细胞凋亡明显减少,提示胃泌素可以减少心肌在缺血再灌注中造成的细胞凋亡,从而减轻心肌的损伤,促进心功能的恢复。
在急性心肌梗死以及心肌缺血再灌注损伤中,细胞凋亡是最重要的病理生理现象之一,其机制复杂。生存活化因子增强(survivor activating factor enhancement,SAFE)途径是近年来新发现的保护通路,为寻找新的药物治疗靶点提供了新思路[15]。其中STAT3磷酸化是其重要的调节方式。STAT3是人体内非常重要的转录调节因子,通过酪氨酸残基或丝氨酸残基的磷酸化而被激活,广泛参与细胞应激、增殖和凋亡等多种生物学效应。既往研究表明STAT3参与心脏缺血预保护,并应用STAT3敲除小鼠证明STAT3在缺血再灌注损伤及缺血预保护中起了主要作用[16]。既往研究表明CCK-BR与STAT3之间存在密切联系[17],CCK-BR可促进STAT3磷酸化,促进细胞增殖、细胞粘附等。胃泌素作为CCK-BR受体激动剂,也有研究表明胃泌素与其CCK-BR受体结合可以促进STAT3的磷酸化,抑制食道癌细胞的凋亡[18]。因此本研究应用Western blot检测了STAT3蛋白及其磷酸化蛋白表达水平的改变,在缺血前给予胃泌素预处理后p-STAT3蛋白的表达明显增加,提示胃泌素可促进STAT3蛋白磷酸化。
综上所述,胃泌素对SD大鼠的离体心脏缺血再灌注损伤具有保护作用,其作用机制可能是通过促进STAT3蛋白的磷酸化,减少心肌细胞的凋亡有关。但本实验未使用STAT3抑制剂阻断STAT3的磷酸化,那么胃泌素预处理对心脏缺血再灌注损伤的保护作用仅是通过这一途径发挥,还是存在其他信号通路,目前尚未明确。此外,目前缺血再灌注损伤的治疗研究已取得了很大的进展,但主要为外源性干预,而胃泌素作为内源性物质,可增加治疗的安全性及有效性,改善心肌梗死患者血运重建的预后。同时也提高医学科研人员 对消化道激素在心脏中影响的认识,开启胃-心轴的对话。
| [1] | Perricone A J, Vander-Heide R S. Novel therapeutic strategies for ischemic heart disease [J]. Pharmacol Res, 2014, 89: 36-45. |
| [2] | Yang Y, Sun Y, Yi W, et al. A review of melatonin as a suitable antioxidant against myocardial ischemia-reperfusion injury and clinical heart diseases [J]. J Pineal Res, 2014, 57(4): 357-366. |
| [3] | Ong S B, Samangouei P, Kalkhoran S B, et al. The mitochondrial permeability transition pore and its role in myocardial ischemia reperfusion injury[J]. J Mol Cell Cardiol, 2015, 78: 23-34. |
| [4] | Dauwe D F, Janssens S P. Stem cell therapy for the treatment of myocardial infarction[J]. Curr Pharm Des, 2011, 17(30): 3328-3340. |
| [5] | Liepinsh E, Makrecka M, Kuka J, et al. The heart is better protected against myocardial infarction in the fed state compared to the fasted state[J]. Metabolism, 2014, 63(1): 127-136. |
| [6] | Jiang X, Wang W, Ning B, et al. Basal and postprandial serum levels of gastrin in normotensive and hypertensive adults[J]. Clin Exp Hypertens, 2013, 35(1): 74-78. |
| [7] | Xiao L, Kovac S, Chang M, et al. Induction of gastrin expression in gastrointestinal cells by hypoxia or cobalt is independent of hypoxia-inducible factor(HIF)[J]. Endocrinology, 2012, 153(7): 3006-3016. |
| [8] | Dockray G, Dimaline R, Varro A. Gastrin: old hormone, new functions [J]. Pflugers Arch, 2005, 449(4): 344-355. |
| [9] | Gregory R A, Tracy H J. The constitution and properties of two gastrins extracted from hog antral mucosa[J]. Gut, 1964, 5(2): 103-114. |
| [10] | Ishizuka N, Imazeki N, Senoo A, et al. Cell proliferation in ventromedial hypothalamic lesioned rats inhibits acute gastric mucosal lesions [J]. Obes Res Clin Pract, 2012, 6(3): e175-e262. |
| [11] | Fosgerau K, Jessen L, Lind-Tolborg J, et al. The novel GLP-1-gastrin dual agonist, ZP3022, increases beta-cell mass and prevents diabetes in db/db mice [J]. Diabetes Obes Metab, 2013, 15(1): 62-71. |
| [12] | Grossini E, Caimmi P, Molinari C, et al. Intracoronary gastrin 17 increases cardiac perfusion and function through autonomic nervous system, CCK receptors, and nitric oxide in anesthetized pigs[J]. J Appl Physiol (1985), 2011, 110(1): 95-108. |
| [13] | Ferrand A, Wang T C. Gastrin and cancer: a review [J]. Cancer Lett, 2006, 238(1): 15-29. |
| [14] | Chen Y, Asico L D, Zheng S, et al. Gastrin and D1 dopamine receptor interact to induce natriuresis and diuresis[J]. Hypertension, 2013, 62(5): 927-933. |
| [15] | Lecour S. Activation of the protective Survivor Activating Factor Enhancement (SAFE) pathway against reperfusion injury: Does it go beyond the RISK pathway? [J]. J Mol Cell Cardiol, 2009, 47(1): 32-40. |
| [16] | Smith R M, Suleman N, Lacerda L, et al. Genetic depletion of cardiac myocyte STAT-3 abolishes classical preconditioning[J]. Cardiovasc Res, 2004, 63(4): 611-616. |
| [17] | Ferrand A, Kowalski-Chauvel A, Bertrand C, et al. A novel mechanism for JAK2 activation by a G protein-coupled receptor, the CCK2R: implication of this signaling pathway in pancreatic tumor models[J]. J Biol Chem, 2005, 280(11): 10710-10715. |
| [18] | Beales I L, Ogunwobi O O. Glycine-extended gastrin inhibits apoptosis in Barrett’s oesophageal and oesophageal adenocarcinoma cells through JAK2/STAT3 activation[J]. J Mol Endocrinol, 2009, 42(4): 305-318. |



