非酒精性脂肪肝(nonalcoholic fatty liver disease,NAFLD)的发病率近年来逐渐升高,已经成为威胁人类健康的主要公共卫生问题之一[1, 2, 3]。我国发达城市部分人群NAFLD发生率已经超过20%,而目前关于NAFLD的治疗尚无明确的方法[1, 2]。白藜芦醇(resveratrol,RSV)是一种天然的多酚类植物化合物,研究发现RSV具有很多健康生物学效应,包括抗氧化、抗衰老、抗癌症、诱导自噬以及改善脂质代谢等[4, 5]。最近的动物研究表明,RSV能够明显改善高脂饮食诱导的大鼠肝脏脂肪变性和炎症的发生、发展[6, 7, 8, 9]。固醇调节元件结合蛋白-1c (sterol-regulatory element binding protein-1c,SREBP-1c)是肝脏脂质代谢的关键调控者,激活SREBP-1c不仅促进肝脏脂肪酸和甘油三酯的合成,还抑制甘油三酯的转运。本研究通过给予大鼠高脂饲料建立体内NAFLD模型,以探讨SREBP-1c在白藜芦醇预防NAFLD发生中的作用,旨在为RSV防治NAFLD提供科学依据。
1 材料与方法 1.1 主要试剂白藜芦醇购自上海辞源生物科技有限公司;总胆固醇(TC)、甘油三酯(TG)检测试剂盒为中生北控生物科技有限公司产品;TRIzol试剂购自美国Invitrogen公司;SYBR Green实时定量RT-PCR试剂盒购自重庆波尔生物科技有限公司;多克隆兔抗鼠抗体磷酸化腺苷酸活化蛋白激酶(AMPK,BS-4002R)、沉默调节蛋白1抗体(SIRT1,BS-0921R)、脂肪酸合成酶抗体(FAS,BS-1498R)和SREBP-1c(BS-1402R)购自北京博奥生物集团有限公司;染色质免疫沉淀试剂盒购自美国Millipore公司;RIPA裂解缓冲液购自北京碧云天生物技术研究所。
1.2 动物与实验设计成年健康清洁级雄性SD大鼠(n=40),体质量160~190 g,购自第三军医大学实验动物中心。40只大鼠按随机数字表法分为4组:对照组(基础饲料,Con组)、高脂膳食组(基础饲料+猪油,HF组),高脂膳食+50 mg/kg RSV组(每天50 mg/kg RSV,HFR50组)和高脂膳食+100 mg/kg RSV组(每天100 mg/kg RSV,HFR100组),基础饲料含能量16.1 kJ/g,蛋白质、碳水化合物和脂肪的供能比分别为20%、70%和10%,高脂膳食含能量19.5 kJ/g,蛋白质、碳水化合物和脂肪的供能比分别为20%、35%和45%,脂肪的主要来源是猪油。在整个实验期间,大鼠自由采食水和饲料。RSV干预采用灌胃方式。干预8周,每周称量动物体质量和食物消耗量。干预结束时,大鼠禁食过夜,实施安乐死并取出肝脏与血液备用。
1.3 HE染色进行NAS评分肝组织石蜡切片,HE染色,在光学显微镜(尼康,日本)下用NAS评分对病理组织进行分析[10, 11]。NAS评分由4个半定量分的成绩汇总:脂肪变性(0~3)、小叶内炎症(0~2)、肝细胞气球(0~2)以及间质纤维化(0~4)。
1.4 肝脏TC和TG含量检测按试剂盒说明书检测肝脏TC和TG[12]。
1.5 血脂检测采用自动分析仪(Olympus AU5400,日本)分析血清TC、TG的浓度。
1.6 RNA提取和实时定量PCR分析SREBP-1c和FAS mRNA的表达使用TRIzol试剂提取大鼠肝脏总RNA,用分光光度计定量后,SuperScriptTM第1链合成系统进行反转录。以GAPDH和β-actin用作内参,实时定量PCR分析SREBP-1c和FAS mRNA的表达水平。引物序列如下:SREBP-1c正义链5′-GTACAGAAAGTTGCAGGGGAAG-3′和反义链5′-ACATAGCACCAACATGGGATTC-3′; FAS正义链5′-GATGAAGAGGGACCATAAAGA-3′和反义链5′-GAACTGGCGTCAATGTTGTA-3′;GAPDH正义链5′-TGTGAACGGATTTGGCCGTA-3′和反义链5′-GATGGTGATGGGTTTCCCGT-3′;β-actin正义链5′-CCACCATGTACCCAGGCATT-3′和反义链5′-CGGACTCATCGTACTCCTGC-3′。含有4 μL 的cDNA模板,19 μL的SYBR及酶的混合物,2 μL的各引物体系进行扩增:94 ℃变性5 min,然后35个循环的扩增步骤(变性94 ℃ 15 s,在60 ℃下进行1 min退火和延伸)。所有定量PCR的方法,包括引物的设计,进行PCR环境验证和定量方法是根据MIQE准则执行[13]。
1.7 Western blot检测pAMPK、SIRT1、SREBP-1c和FAS的蛋白表达肝脏用RIPA裂解液提取总蛋白。由Bradford方法定量后,将80 μg蛋白重悬于5×SDS缓冲液中,分离于12%的SDS-PAGE,转膜于PVDF膜,封闭于5% 奶粉中2 h,探测印迹放在1 ∶1 000稀释的一抗(多克隆抗体特异性磷酸化的AMPK、SIRT1、FAS和SREBP-1c)中4 ℃过夜,然后用相应的二抗孵育1 h,然后用化学发光法曝光。最后,将印迹灰度值扫描进行光密度分析。
1.8 染色质免疫共沉淀法分析FAS启动子序列固醇调节元件(SRE)与SREBP-1c的结合程度用手术刀把 0.03 g组织切碎成小块,37%甲醛固定后用甘氨酸终止反应。在冰上用75 W超声1 s后停歇5 s,总共90次,共9 min。1 μg SREBP-1c和正常兔IgG(Millipore公司)抗体用于交联蛋白质/DNA的免疫沉淀,然后进行蛋白质/DNA复合物的洗脱,反转交联的蛋白质/DNA复合物以游离DNA,用离心柱纯化DNA等步骤,最后进行实时定量PCR扩增SREBP-1c结合于FAS启动子位点的DNA片段。引物序列为:正义链5′-GGCATCACCCCACCGACG-3′和反义链5′-GCTCCCTCTAGGCCGCGC-3′。
1.9 统计学分析计量资料以x±s表示,应用SPSS 17.0统计软件对数据进行单因素方差分析。
2 结果 2.1 RSV干预对大鼠摄食量和体质量的影响通过8周的干预,HF组大鼠体质量显著高于Con组(P < 0.05),而RSV干预在不影响大鼠每日能量摄入的情况下能使高脂饲养大鼠体质量下降(P < 0.05)。但50 mg和100 mg RSV干预未观察到剂量效应关系(表 1)。
| 组别 | 初始体质量(g) | 终末体质量(g) | 第8周每天食物摄入量(g) | 第8周每天能量摄入量(kJ) |
| Con组 | 172±12 | 230±16 | 17.8±2.1 | 286±33 |
| HF组 | 173±10 | 296±21 a | 15.9±1.5 a | 309±28 |
| HFR50组 | 173±10 | 257±18 ab | 16.0±1.7 a | 312±34 |
| HFR100组 | 174±10 | 271±18 ab | 16.0±1.4 a | 313±28 |
| a: P<0.05,与Con组比较;b: P<0.05,与HF组比较 | ||||
| 组别 | 血清 TC(mmol/L) | 血清 TG(mmol/L) | 肝脏 TC(μmol/g) | 肝脏 TG(μmol/g) |
| Con组 | 1.25±0.26 | 0.57±0.15 | 4.7±0.5 | 7.2±0.8 |
| HF组 | 2.38±0.58 a | 0.91±0.14 a | 6.8±1.2 a | 11.0±1.8 a |
| HFR50组 | 2.47±0.58 a | 0.69±0.13 b | 6.1±1.5 a | 8.1±2.1 b |
| HFR100组 | 2.24±0.49 a | 0.66±0.17 b | 6.7±1.2 a | 8.9±1.1 ab |
| a: P<0.05,与Con组比较;b: P<0.05,与HF组比较 | ||||
高脂饮食饲养8周后,大鼠肝脏出现了大量的脂肪沉积,部分小叶内出现炎性浸润和肝细胞气球样变,而RSV干预能显著降低肝内脂肪沉积和炎性浸润;NAS量化评分结果表明,RSV可有效地改善由高脂饮食诱导的肝脂肪变性(P < 0.05,图 1)。
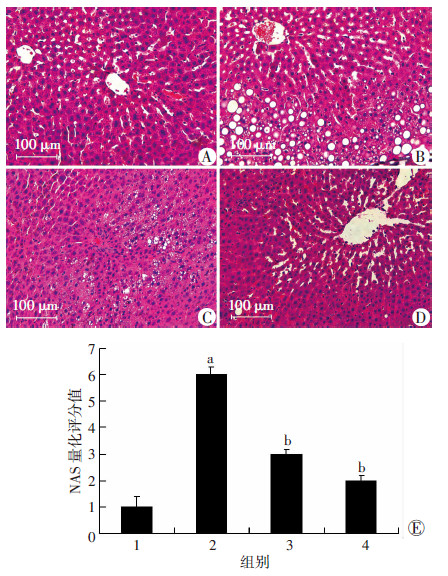 |
| A~D:分别为Con组、HF组、HFR50组、HFR100组HE染色结果;E:NAS量化评分结果 1:Con组;2:HF组;3:HFR50组;4:HFR100组;a:P < 0.05,与Con组比较;b:P < 0.05,与HF组比较 图 1 RSV干预后各组大鼠肝脏组织HE染色结果和NAS 量化评分 |
与Con组比较,HF组pAMPK和SIRT1蛋白表达显著下调(P < 0.05);与HF组比较,HFR50组与HFR100组pAMPK、SIRT1表达显著增加(P < 0.05);与Con组比较,HF组SREBP-1c与FAS蛋白表达显著上调(P < 0.05);与HF组比较,HFR50组与HFR100组SREBP-1c与FAS蛋白表达显著下调(P < 0.05,图 2)。
 |
| A:Western blot检测结果;B:pAMPK、SIRT1、SREBP-1c和FAS蛋白半定量分析结果 1:Con组;2:HF组;3:HFR50组;4:HFR100组;a:P < 0.05,与Con组比较;b:P < 0.05,与HF组比较 图 2 RSV对各组大鼠肝脏pAMPK、SIRT1、SREBP-1c 和 FAS蛋白表达的影响 |
与Con组比较,HF组SREBP-1c和FAS mRNA表达显著增加(P < 0.05);与HF组比较,HFR50组与HFR100组显著下调SREBP-1c和FAS mRNA表达(P < 0.05,图 3)。
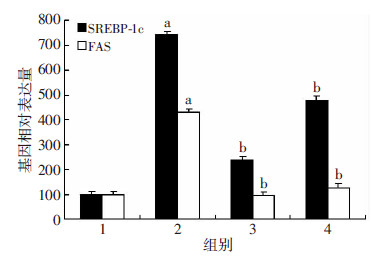 |
| 1:Con组;2:HF组;3:HFR50组;4:HFR100组 a:P < 0.05,与Con组比较;b:P < 0.05,与HF组比较 图 3 RT-PCR检测各组大鼠SREBP-1c和FAS的基因表达 |
ChIP实验结果表明,与Con组比较,HF组大鼠肝脏中结合到FAS基因启动子SRE序列的SREBP-1c转录因子显著增加(P < 0.05),而HFR50组与HFR100组显著抑制SREBP-1c与FAS的启动子SRE的结合(P < 0.05,图 4)。
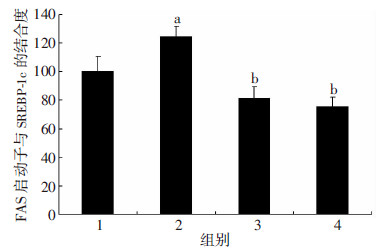 |
| 1:Con组;2:HF组;3:HFR50组;4:HFR100组 a:P < 0.05,与Con组比较;b:P < 0.05,与HF组比较 图 4 RSV对各组SREBP-1c与FAS的启动子SRE 结合的影响 |
NAFLD的特点是脂肪堆积在肝细胞中,在光镜下细胞质内有很多小脂滴[14]。NAFLD的发病机制目前尚未很好地阐释,且NAFLD的治疗仍存在争议。有研究表明,白藜芦醇可显著改善脂质代谢,动物实验结果显示,通过每天50 mg/kg白藜芦醇干预,脂肪组织和肝脏脂肪积累明显减少,提高了脂肪酸在骨骼肌的氧化和降低血脂[15, 16]。本研究发现喂食高脂肪饮食8周的大鼠,肝脏具有典型的脂肪变性,细胞内有较多的脂滴,部分肝细胞表现为气球样变性,而RSV干预组大鼠肝脏脂肪变性程度减轻。NAS评分可作为脂肪肝半定量的“分级”评价[10, 11],而分析肝脏甘油三酯的含量可以更客观和准确地判断肝脏脂肪变性程度。上述两种方法都表明RSV可有效改善高脂膳食导致的肝脏脂肪变性。
本研究发现高脂膳食显著促进SREBP-1c的表达,而RSV干预显著抑制上述效应。SREBP-1c在肝脏脂肪合成调节中是最重要的转录因子,在NAFLD的发生、发展过程中发挥重要作用[17, 18]。SREBP-1c在内质网的膜中合成,在细胞核中发挥作用,在细胞质中以未成熟的形式表达,而水解之后的成熟片段进入细胞核,与它自己的或靶基因的启动子区域的SRE结合,从而激活SREBP-1c应答基因的转录,促进肝脏内脂肪生成。本研究还发现RSV显著抑制SREBP-1c与FAS的启动子SRE的结合,其下游靶基因FAS mRNA和蛋白的表达量与SREBP-1c的改变是一致的。这表明RSV抑制SREBP-1c的表达与活性,下调FAS等脂肪合成基因的表达,减少肝脏脂肪合成,从而改善肝脏的脂肪蓄积和脂肪变性。
SREBP-1c的转录活性还与其磷酸化以及乙酰化水平有关[19]。RSV不仅是SIRT1的天然激活剂,也能激活AMPK[5]。SIRT1降低SREBP-1c的乙酰化水平,改变脂质代谢的基因表达模式;AMPK能促进胰岛素的敏感性,并调节脂质代谢,一旦AMPK的Thr172位点磷酸化,AMPK被活化,就会磷酸化SREBP-1c。本研究表明,高脂膳食喂养导致大鼠肝脏磷酸化AMPK水平和SIRT1蛋白水平显著下降,而RSV干预后其蛋白表达增加。这与其他研究结果基本一致[20]。
本研究只观察了动物现象和一些潜在的分子通路,接下来将通过软脂酸建立体外肝细胞脂肪变性模型,深入探讨白藜芦醇通过SREBP-1c影响NAFLD发生的分子机制,同时采用随机对照试验(RCT)研究白藜芦醇对NAFLD患者的人群干预效应;围绕SREBP-1c这一条主干线,从体外肝细胞脂肪变性模型、实验动物模型和人群干预3个不同层面研究白藜芦醇对NAFLD的影响及其分子机制。
综上所述,本研究表明,高脂饮食导致大鼠的血清和肝脏中TG浓度增加,诱导NAFLD的形成,RSV干预可显著预防高脂膳食诱导NAFLD的发生,RSV可能通过上调pAMPK和SIRT1蛋白表达,下调SREBP-1c的表达和转录活性,抑制FAS等脂肪合成基因的表达,减少肝脏TG含量,从而发挥其预防高脂膳食诱导大鼠NAFLD发生、发展的作用。这为RSV在预防NAFLD的药理学靶点上提供了新的见解。
| [1] | Smith B W, Adams L A. Non-alcoholic fatty liver disease[J]. Crit Rev Clin Lab Sci, 2011, 48(3): 97-113. |
| [2] | Fan J G, Farrell G C. Epidemiology of non-alcoholic fatty liver disease in China[J]. J Hepatol, 2009, 50(1): 204-210. |
| [3] | Williams C D, Stengel J, Asike M I, et al. Prevalence of nonalcoholic fatty liver disease and nonalcoholic steatohepatitis among a largely middle-aged population utilizing ultrasound and liver biopsy: a prospective study[J]. Gastroenterology, 2011, 140(1): 124-131. |
| [4] | Tome-Carneiro J, Larrosa M, Gonzalez-Sarrias A, et al. Resveratrol and clinical trials: the crossroad from in vitro studies to human evidence[J]. Curr Pharm Des, 2013, 19(34): 6064-6093. |
| [5] | Chen M L, Yi L, Jin X, et al. Resveratrol attenuates vascular endothelial inflammation by inducing autophagy through the cAMP signaling pathway[J]. Autophagy, 2013, 9(12): 2033-2045. |
| [6] | Li L, Hai J, Li Z, et al. Resveratrol modulates autophagy and NF-kappaB activity in a murine model for treating non-alcoholic fatty liver disease[J]. Food Chem Toxicol, 2014, 63: 166-173. |
| [7] | Xin P, Han H, Gao D, et al. Alleviative effects of resveratrol on nonalcoholic fatty liver disease are associated with up regulation of hepatic low density lipoprotein receptor and scavenger receptor class B type Ⅰ gene expressions in rats[J]. Food Chem Toxicol, 2013, 52: 12-18. |
| [8] | Shang J, Chen L L, Xiao F X, et al. Resveratrol improves non-alcoholic fatty liver disease by activating AMP-activated protein kinase[J]. Acta Pharmacol Sin, 2008, 29(6): 698-706. |
| [9] | Poulsen M M, Larsen J O, Hamilton-Dutoit S, et al. Resveratrol up-regulates hepatic uncoupling protein 2 and prevents development of nonalcoholic fatty liver disease in rats fed a high-fat diet[J]. Nutr Res, 2012, 32(9): 701-708. |
| [10] | Brunt E M, Kleiner D E, Wilson L A, et al. Nonalcoholic fatty liver disease (NAFLD) activity score and the histopathologic diagnosis in NAFLD: distinct clinicopathologic meanings[J]. Hepatology, 2011, 53(3): 810-820. |
| [11] | Kleiner D E, Brunt E M, Van-Natta M, et al. Design and validation of a histological scoring system for nonalcoholic fatty liver disease[J]. Hepatology, 2005, 41(6): 1313-1321. |
| [12] | Salmon D M, Flatt J P. Effect of dietary fat content on the incidence of obesity among ad libitum fed mice[J]. Int J Obes, 1985, 9(6): 443-449. |
| [13] | Chen C Y, Yi L, Jin X, et al. Inhibitory effect of delphinidin on monocyte-endothelial cell adhesion induced by oxidized low-density lipoprotein via ROS/p38MAPK/NF-kappaB pathway[J]. Cell Biochem Biophys, 2011, 61(2): 337-348. |
| [14] | Angulo P. Nonalcoholic fatty liver disease[J]. N Engl J Med, 2002, 346(16): 1221-1231. |
| [15] | Gomez-Zorita S, Fernandez-Quintela A, Macarulla M T, et al. Resveratrol attenuates steatosis in obese Zucker rats by decreasing fatty acid availability and reducing oxidative stress[J]. Br J Nutr, 2012, 107(2): 202-210. |
| [16] | Wang G L, Fu Y C, Xu W C, et al. Resveratrol inhibits the expression of SREBP1 in cell model of steatosis via Sirt1-FOXO1 signaling pathway[J]. Biochem Biophys Res Commun, 2009, 380(3): 644-649. |
| [17] | Quan H Y, Kim-do Y, Kim S J, et al. Betulinic acid alleviates non-alcoholic fatty liver by inhibiting SREBP1 activity via the AMPK-mTOR-SREBP signaling pathway[J]. Biochem Pharmacol, 2013, 85(9): 1330-1340. |
| [18] | Xiao X, Song B L. SREBP: a novel therapeutic target[J]. Acta Biochim Biophys Sin (Shanghai), 2013, 45(1): 2-10. |
| [19] | Seo M S, Hong S W, Yeon S H, et al. Magnolia officinalis attenuates free fatty acid-induced lipogenesis via AMPK phosphorylation in hepatocytes[J].J Ethnopharmacol, 2014, 157: 140-148. |
| [20] | Zhu W, Chen S, Li Z, et al.Effects and mechanisms of resveratrol on the amelioration of oxidative stress and hepatic steatosis in KKAy mice[J]. Nutr Metab, 2014, 11: 35. |



