2. 100700 北京,北京军区总医院附属八一脑科医院神经外科;
3. 100038 北京,首都医科大学附属复兴医院神经内科
2. Department of Neurosurgery, Bayi Brain Hospital, General Hospital of Beijing Military Command, Beijing, 100700;
3. Department of Neurology, Fuxing Hospital, Capital Medical University, Beijing, 100038, China
颅脑创伤(traumatic brain injury,TBI)后脑组织结构被破坏,血脑屏障功能紊乱,随之浸润的免疫细胞及细胞因子共同参与了炎症反应。炎症反应对神经损伤修复具有两面性:一方面可局限致伤因素,为修复创造条件;另一方面则加重组织损伤,不利于神经再生[1]。由此可见,对TBI后炎症反应进行有序调控是临床治疗的关键。近来研究发现干细胞具有免疫调控作用,将间充质干细胞(mesenchymal stem cells,MSCs)与免疫细胞离体共培养,发现MSCs可分泌多种细胞因子影响免疫细胞活化和极性转变[2];经静脉移植的神经干细胞(neural stem cells,NSCs)能在免疫器官中存活并与免疫细胞相互作用[3]。虽然干细胞移植治疗TBI的报道较多[4],但鲜有研究对比观察不同干细胞在神经损伤后炎症反应中的调控作用,此外由于移植方式和干预时机等差异,对于干细胞发挥的免疫调控作用在国际上仍有争议[5, 6]。因此,本研究选用小鼠源性NSCs与MSCs分别移植到同品系小鼠TBI动物模型脑内,避免了由移植物引起的免疫排斥,可较为客观地比较分析两种干细胞免疫调控作用,从而为移植治疗TBI后炎症反应选用适宜干细胞提供理论依据。
1 材料与方法 1.1 实验动物成年雄性C57BL/6小鼠264只,体质量20~28 g。 采用随机数字表法分为假手术组和TBI组,对TBI组进行不同干预分为NSCs移植组、MSCs移植组和磷酸 盐缓冲液(PBS)处理组,每组小鼠再分为移植后24、72 h 和7 d共3个时相点,每个时相点组18只。所有实验动物购于北京维通利华公司,SPF级。
1.2 主要仪器和试剂仪器:CO2培养箱和MultiskanTM MK3(美国Thermo公司),超净工作台(美国ESCO公司),S8AP0体视镜、倒置相差显微镜、CM1950冰冻切片机、TCS SP5Ⅱ激光共聚焦显微镜和DM3000荧光显微镜(德国Leica公司),C6流式细胞仪(美国BD公司),小鼠数字化脑立体定向仪(美国Stoelting公司),ViiA7 Real- time PCR System(美国Applied Biosystems公司),Gel Doc XR System凝胶成像分析系统(美国Bio-Rad公司)。
试剂:DMEM/F12培养基、Neurobasal培养基、B27、碱性成纤维细胞生长因子(bFGF)、表皮生长因子(EGF)、0.25%胰酶-EDTA、Accutase酶、胎牛血清(FBS)、PBS和TRIzol(美国Invitrogen公司),多聚赖氨酸(PLL)、Percoll分离液、牛血清白蛋白(BSA)、HRP标记山羊抗兔IgG抗体(1 ∶5 000)、小鼠IL-6、IL-10 和TNF-α ELISA试剂盒(美国Sigma公司),Nestin抗体(1 ∶400)、IL-6抗体(1 ∶1 000)和β-actin抗体(1 ∶1 000,美国Millipore公司),Sox2抗体(1 ∶200,美国Santa Cruz公司),CD44-FITC、CD14-PE和CD29-PE(美国BD公司),CD71-FITC和CD45-APC(美国eBioscience公司),CD34-APC(美国Biolegend公司),CD3抗体(1 ∶200)、CD11b抗体(1 ∶200)、IL-10抗体(1 ∶2 000)和TNF-α抗体(1 ∶2 000,美国Abcam公司),CD19抗体(1 ∶200,美国Lifespan公司),488标记驴抗山羊IgG抗体(1 ∶800)、594标记驴抗小鼠IgG抗体(1 ∶1 000)、594标记驴抗大鼠IgG抗体(1 ∶600)和 594标记驴抗兔IgG抗体(1 ∶1 000,美国Life Technologies 公司),QuantScript RT试剂盒(中国Tiangen公司),SYBR Green Master Mix试剂盒(日本TaKaRa公司),PCR引物(中国生工公司),BCA试剂盒(美国Thermo公司)。
1.3 神经干细胞体外分离培养采用颈部脱臼法处死小鼠,无菌条件下取出脑组织,体视镜下分离SVZ区并放入DMEM/F12培养基中。移入超净工作台,剪碎组织,用0.25%胰酶-EDTA 37 ℃消化5 min。用200目滤网过滤,200×g离心5 min,弃上清液,加入NSCs培养基(含2%B27,20 ng/mL bFGF和20 ng/mL EGF的DMEM/F12与Neurobasal等体积混合培养基)。调整细胞量为105~106个/mL接种到培养瓶内,放于37 ℃,5%CO2培养箱中。7 d后将悬浮的神经球吸入离心管内,200×g离心5 min,弃上清液,用Accutase酶37 ℃消化14 min后加入NSCs培养基,传代培养。取第3代NSCs进行鉴定,用酶消化法制备单细胞悬液,以1×105个/mL接种到24孔细胞培养板,孔内放有PLL包被的细胞爬片,培养2 d后取出爬片,用巢蛋白(Nestin)和Sox2双重标记,用激光共聚焦显微镜观察。取第5~8代NSCs用于移植,制备单细胞悬液并用PBS漂洗3遍,调整细胞数为1×105个/μL,放置于离心管中冰浴。
1.4 间充质干细胞体外分离培养以1.3方法处死动物,无菌条件下将完整分离的股骨与胫骨放入DMEM/F12培养基中。移入超净工作台,剪开两侧骨端,用1 mL 注射器抽吸培养基反复冲洗骨髓腔,将组织冲洗液缓慢注入到1.082 g/mL 的Percoll分离液中,在4 ℃以150×g离心20 min。用PBS漂洗所收集的单个核细胞,加入MSCs培养基(含 10%FBS的DMEM/F12培养基)。调整细胞量为105~ 106个/mL接种到培养瓶内培养。每隔1 d半量换液,当贴壁细胞生长达90%时,吸弃培养液并用PBS漂洗,加入Accutase酶37 ℃消化5 min,待贴壁细胞变圆,即加入MSCs培养基终止消化并反复吹打,收集单细胞悬液,传代培养。取第3代MSCs进行鉴定,用酶消化法制备单细胞悬液并用PBS漂洗,调整细胞密度为1×106个/mL,分装到EP管内,分别用CD44-FITC、CD14-PE、CD29-PE、CD45-APC、CD71-FITC和CD34-APC染色,设置同型对照组,用流式细胞仪鉴定。取第5~8代MSCs用于移植,方法同1.3。
1.5 小鼠TBI模型制备和干细胞移植小鼠用3.6%水合氯醛10 mL/kg腹腔注射麻醉后固定于脑立体定向仪,备皮后铺无菌洞巾,切开头部皮肤,以前囟向尾侧1.5 mm,中线偏右侧2.0 mm为撞击点。使用自由落体脑打击装置,用40 g击锤从25 cm 高度坠落,撞击撞针(直径3.0 mm)造成颅脑损伤,缝合头皮继续喂养。假手术组(54只)仅切开头皮,不实施撞击。于伤后12 h进行神经功能缺损评分(NSS),将3~7分者纳入TBI组并按随机数字表法分为NSCs移植组、MSCs移植组和PBS处理组,每组54只,均在伤后24 h给予干预。操作如下:将小鼠固定于脑立体定向仪,消毒铺巾,切开皮肤暴露前囟,以 前囟向喙侧1.5 mm,中线偏右侧1.0 mm,深度2.5 mm 为注射点,用25 μL 22 s微量进样器以0.5 μL/min的速度注射5 μL细胞悬液,细胞总量为5×105个,结束后留针5 min,缓慢拔针缝合头皮。PBS处理组以同样方式注射等体积PBS。
1.6 脑组织冰冻切片病理染色和免疫荧光染色移植后24、72 h和7 d从各组随机选取6只动物,麻醉后灌注固定并取出大脑观察其形态,包埋后用冰 冻切片机沿大脑冠状面连续切片(厚10 μm)。每隔5张 用HE染色确定细胞移植区和脑损伤区,观察移植物分布和脑组织损伤修复情况。根据病理染色结果进行免疫荧光染色,用10%BSA封闭后,加入CD3、CD11b和CD19抗体4 ℃孵育过夜。漂洗后,加入荧光标记二抗,室温避光孵育2 h。用DAPI染细胞核,在荧光显微镜下观察,在镜下(×20)随机选取6个视野,计数阳性细胞数(特异性抗体标记)和总细胞数(DAPI 标记),计算阳性细胞百分率=阳性细胞数/总细胞数×100%。
1.7 RT-qPCR检测细胞因子mRNA表达在各观察时间点从各组随机选取6只动物进行处 死,取新鲜脑组织,称重后用液氮研磨法提取总RNA,用QuantScript RT试剂盒合成cDNA,放于EP管中-20 ℃ 保存。用SYBR Green Master Mix试剂盒,以cDNA为模板在ViiA7 Real-time PCR System中检测细胞因子mRNA,并进行3次独立重复实验。引物序列如下:β-actin上游:5′-TATCGGCAATGAGCGGTTC-3′,下游:5′-GTTGGCATAGAGGTCTTTA-3′; IL-6上游:5′-AGCT-GGAGTCACAGAAGGAG-3′,下游:5′-CGCACTAGGTT-TGCCGAGT-3′;IL-10上游:5′-CTTTAAGGGTTACTTG- GGT-3′,下游:5′-TTGATCATCATGTATGCTTC-3′;TNF-α 上游:5′-TGAAGGGAATGGGTGTTA-3′,下游:5′-GA-AGAATCTGGAAAGGTC-3′。以β-actin为内参计算细胞因子mRNA水平,再以假手术组为对照计算TBI各干预组间mRNA的表达倍数。
1.8 ELISA和Western blot检测细胞因子蛋白表达如1.7取新鲜脑组织,称量后用液氮速冻,并将样品放在冰上,加入裂解缓冲液,用电动匀浆机匀浆。总蛋白浓度用BCA试剂盒测定,将样品按比例稀释后分装到EP管中-80 ℃保存。使用小鼠ELISA试剂盒检测脑组织内IL-6、IL-10和TNF-α蛋白含量,用MultiskanTM MK3在450 nm波长处测量样品光密度值,用ELISA Calc V软件参照标准曲线计算相对蛋白浓度。取样品蛋白用SDS-PAGE凝胶电泳分离目的条带(总蛋白量为30~40 μg)并转至PVDF膜,用5%BSA封闭后,分别加入IL-6、IL-10、TNF-α和β-actin中,4 ℃孵育过夜,用HRP标记的山羊抗兔IgG抗体室温孵育1 h后,在暗室内与ECL显色剂反应,用Gel Doc XR System凝胶成像分析系统采集并分析蛋白含量。
1.9 统计学方法采用SPSS 17.0统计软件,计量资料以x±s表示。同一观察时间点多组间比较和组内多个观察时间点间的比较均行单因素方差分析,两两比较行LSD-t检验。
2 结果 2.1 干细胞分离培养和鉴定取自成年雄性C57BL/6小鼠侧脑室下区(SVZ)的细胞经离体培养3~4 d后不断增殖形成边缘光滑的神经球,6~7 d后神经球逐渐脱离瓶底而呈悬浮生长状态。 神经球用酶消化后可传代培养,并表达NSCs特异性标记物:Nestin和Sox2。取自成年雄性同品系小鼠骨髓组织的细胞在含血清的培养基中呈纺锤形并贴壁生长。这些梭形细胞用酶消化后可传代培养,并高表达MSCs表面抗原:CD29、CD44和CD71(>80%),而低表达造血细胞相关抗原:CD14、CD34和CD45( < 5%)。
2.2 动物模型一般资料和形态学分析用自由落体脑打击装置制备动物模型,伤后12 h NSS评分为(4.47±0.75),选3~7分小鼠(76.78%)纳入TBI组。干预后24 h和72 h 3组间无明显差异,肉眼可见软脑膜和脑组织明显破裂,伴有出血和水肿,镜下可见神经元胞体肿胀,尼氏体溶解消失,细胞核边集固缩,大量红细胞溢出和炎性细胞浸润。在NSCs和MSCs移植组可见移植物沿注射针道分布。NSCs或MSCs移植7 d后,脑损伤较PBS处理组局限,组织内渗出减少。假手术组NSS评分均为0,在各观察时间点未发现上述病理变化。
2.3 脑组织内免疫细胞数量的动态变化假手术组在各观察时间点均未见到免疫细胞浸润。TBI组在干预后24 h均可检测到小胶质细胞/巨噬细胞(CD11b)、T细胞(CD3)和B细胞(CD19),但各干预组间阳性细胞数量无明显差异(P>0.05)。干预后72 h PBS处理组小胶质细胞/巨噬细胞明显增多,并高于NSCs移植组和MSCs移植组(P < 0.05);T细胞和B细胞的数量虽有所增加,但3组间差异不明显(P>0.05)。干预后7 d,PBS处理组小胶质细胞/巨噬细胞百分率持续上升,高于NSCs移植组和MSCs移植组(P < 0.05);浸润的T细胞和B细胞数量也不断增多,PBS处理组T细胞百分率明显高于NSCs移植组(P < 0.05)。结果见图 1、2。
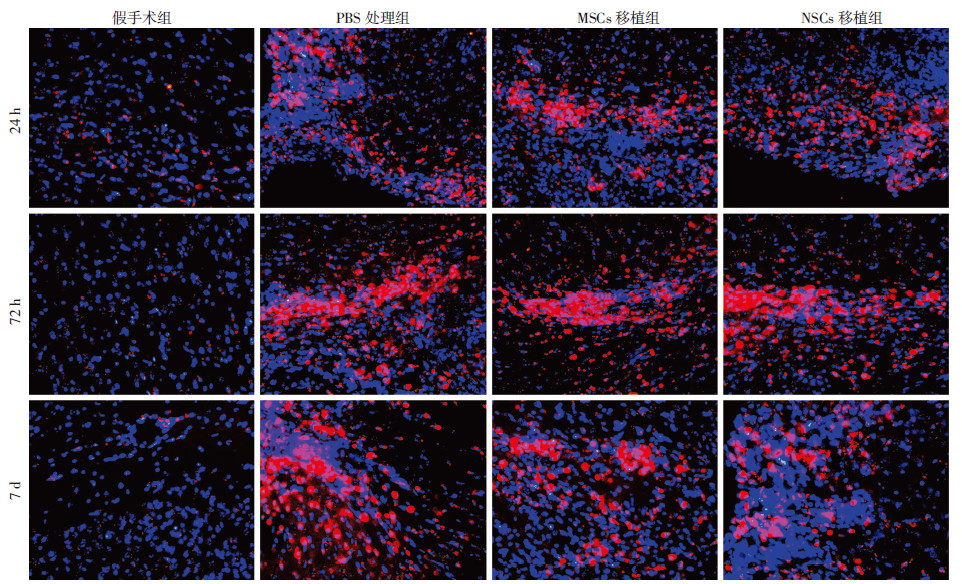 |
| 图 1 干预后24 h、72 h和7 d各组小鼠脑组织内小胶质细胞/巨噬细胞免疫荧光染色 (荧光显微镜 ×200) |
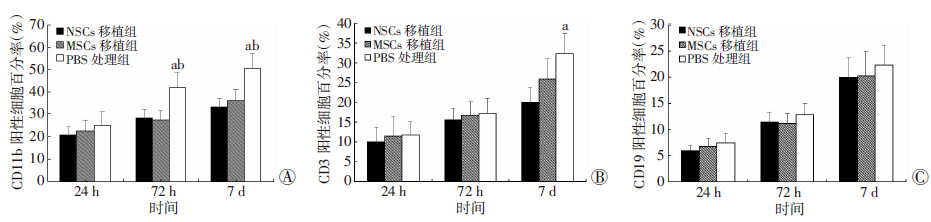 |
| a:P < 0.05,与NSCs移植组比较;b:P < 0.05,与MSCs移植组比较 图 2 干预后24 h、72 h和7 d各组小鼠脑组织内CD11b(A)、CD3(B)和CD19(C)阳性细胞百分率 |
RT-qPCR检测脑组织内细胞因子IL-6、IL-10和TNF-α mRNA转录水平结果见图 3,ELISA检测对应蛋白含量结果见图 4,Western blot检测结果见图 5。假手术组脑组织内细胞因子IL-6、IL-10和TNF-α mRNA转录水平和蛋白含量在各观察时间点均明显低于TBI各干预组(P < 0.05)。PBS处理组IL-6和TNF-α mRNA水平和蛋白含量在各观察时间点均高于MSCs移植组(P < 0.05)。MSCs移植组IL-6蛋白含量和TNF-α mRNA水平在各观察时间点以及TNF-α蛋白含量在移植后72 h和7 d均明显低于NSCs移植组(P < 0.05)。NSCs移植组IL-10水平持续上升,其mRNA水平在移植后24 h和72 h均明显高于PBS处理组,蛋白含量在72 h和7 d较PBS处理组和MSCs移植组明显升高(P < 0.05)。
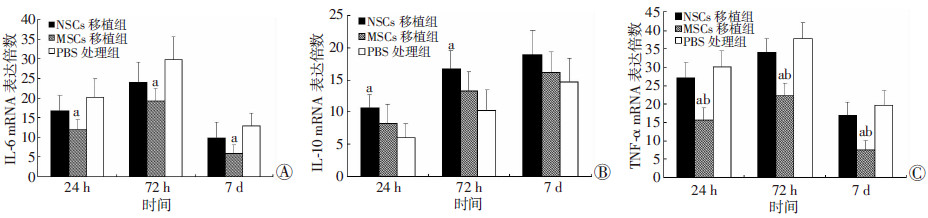 |
| a:P < 0.05,与PBS处理组比较;b:P < 0.05,与NSCs移植组比较设假手术组为1 图 3 干预后24 h、72 h和7 d各组小鼠脑组织内IL-6(A)、IL-10(B)和TNF-α(C) mRNA 表达倍数 |
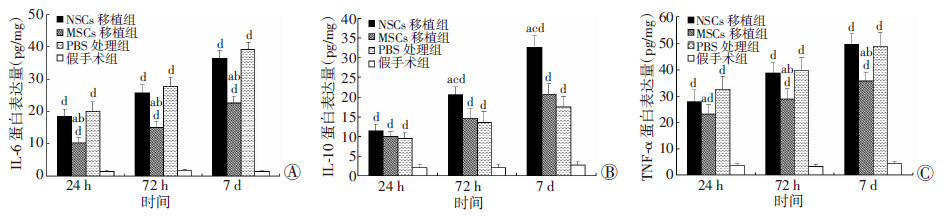 |
| a:P < 0.05,与PBS处理组比较;b:P < 0.05,与NSCs移植组比较;c:P < 0.05,与MSCs移植组比较;d:P < 0.05,与假手术组比较 图 4 干预后24 h、72 h和7 d各组小鼠脑组织内IL-6(A)、IL-10(B)和TNF-α(C)蛋白含量 |
 |
| 1:假手术组;2:PBS处理组;3:MSCs移植组;4:NSCs移植组 图 5 Western blot检测干预后24(A)、72 h(B)和7 d(C)各组小鼠脑组织内IL-6、IL-10和TNF-α的表达 |
TBI后炎症反应一方面可参与继发性病理损伤,另一方面对神经修复再生发挥着重要作用,调控炎症反应目的是减小损伤和促进修复。目前临床上防治TBI后炎症反应主要采用固醇类激素和神经营养因子[7, 8],但二者疗效并不理想,因此新的调控手段具有广阔前景。近来研究发现,移植体内的干细胞不仅具有细胞替代作用,而且还能调节免疫反应[9]。MSCs在体外可抑制T细胞增殖,移植到体内可抑制由淋巴细胞介导的免疫应答,此外MSCs尚可通过调控多种细胞因子的表达发挥免疫抑制作用[10]。NSCs与MSCs具有类似作用,基因芯片数据显示与免疫相关的基因约有18%在NSCs中稳定表达,移植体内保持未分化状态的NSCs可发挥免疫调控作用促进组织修复[11]。然而,现有研究主要是针对单一干细胞免疫调控作用而言[12],缺乏比较和定量分析。据此,本研究对比观察NSCs与MSCs在TBI后炎症反应中的调控作用,发现两种干细胞均可在一定程度上影响脑内免疫细胞的浸润和细胞因子的表达,并且与文献[13, 14]报道不同,两种干细胞的调控作用既有共同点也有明显差异。
本研究选用近交系C57BL/6小鼠源性NSCs与MSCs直接经颅定向移植到同品系小鼠TBI动物模型脑内,与之前研究采用封闭群SD大鼠模型及经静脉移植途径相比[15],可更有效地避免免疫排斥反应和血液循环消耗移植物,并且浸润脑内的免疫细胞可归因于TBI后炎症反应。本实验发现TBI后2 d脑组织内即可检测到小胶质细胞/巨噬细胞、T细胞和B细胞。小胶质细胞/巨噬细胞可促进炎症发生、发展,并能释放细胞因子趋化淋巴细胞浸润[16]。T细胞和B细胞可调节TBI后适应性免疫应答,在炎症早期参与继发性病理损伤,而在后期则对神经再生及功能重塑起重要的支持作用[17]。本研究发现接受NSCs或MSCs移植,小胶质细胞/巨噬细胞数量增幅渐趋平缓,移植后72 h和7 d其百分率明显低于PBS处理组,说明两种干细胞均有抑制小胶质细胞/巨噬细胞浸润的作用。此外,移植后7 d,与PBS处理组相比NSCs移植组脑内浸润的T细胞数量明显减少,提示NSCs可抑制T细胞浸润。文献[3]报道抑制体内T细胞数量可降低动物学习和记忆能力,认为T细胞可影响内源性NSCs的增殖分化,可见NSCs与T细胞间作用复杂。前面已述及MSCs可抑制T细胞增殖,而本实验发现与PBS处理组相比,MSCs移植组在TBI后炎症反应中并没有明显减少浸润的淋巴细胞。可见TBI后各时期产生的多种信号分子对MSCs的影响较为复杂,此外MSCs的免疫调节作用具有双向性,可介导免疫抑制,也能增强免疫应答。这些作用受环境中信号分子的影响,例如只有当促炎因子高表达时,MSCs才能抑制T细胞增殖活化[10]。TBI后炎症反应中信号分子对NSCs的影响是否与MSCs相似以及作用机制仍是今后研究热点。
TBI后2 d脑组织内细胞因子的表达即增加,包括促炎因子(IL-6和TNF-α)和抑炎因子(IL-10)[18]。IL-6和TNF-α mRNA转录水平在干预后72 h达峰值并逐渐降低,而IL-10 mRNA水平则在观察期内不断上升,与炎症反应自身调节有关[19]。促炎因子IL-6可造成血脑屏障功能紊乱,促使免疫细胞和细胞因子大量涌入中枢神经系统内参与继发性病理损伤[20]。TNF-α在继发性脑损伤中可扩大炎症反应,使组织病变进一步恶化[21]。MSCs移植组IL-6和TNF-α mRNA转录和蛋白表达水平在各观察点均明显低于PBS处理组,说明MSCs可下调IL-6和TNF-α表达,减轻炎症反应。文献[13]报道在脑损伤后24 h内经静脉移植NSCs可降低IL-6和TNF-α含量。本研究未发现这两种因子在NSCs移植组和PBS处理组间的显著差异,可见干预时机和移植途径对干细胞的免疫调控作用有一定影响。抑炎因子IL-10具有拮抗促炎因子,保护神经组织的作用[22]。NSCs移植组IL-10 mRNA转录水平在干预后24 h和72 h即明显高于PBS处理组,其蛋白水平在随后72 h和7 d也明显高于MSCs移植组和PBS处理组,说明NSCs可上调IL-10表达水平而减轻组织损伤,促进神经修复。文献[23]报道MSCs与免疫细胞离体共培养可增加IL-10表达,而本研究IL-10的含量在MSCs移植组和PBS组间无明显差异,提示干细胞调控细胞因子表达受多种因素影响,如何引导干细胞稳定上调抑炎因子同时下调促炎因子需从分子机制的研究入手。
综上所述,本研究采用小鼠源性NSCs与MSCs分别移植到同品系小鼠TBI动物模型脑内,发现两种干细胞能影响TBI后免疫细胞浸润和细胞因子表达。NSCs与MSCs免疫调控作用有相似之处,如抑制小胶质细胞/巨噬细胞浸润,此外NSCs可抑制T细胞浸润并增加IL-10含量,MSCs主要通过降低促炎因子IL-6和TNF-α水平调节炎症反应。这些差异值得深思,例如IL-6和TNF-α主要由活化的小胶质细胞/巨噬细胞产生[3],在本研究中MSCs一方面抑制小胶质细胞/巨噬细胞浸润,另一方面下调IL-6和TNF-α表达,而NSCs虽然减少小胶质细胞/巨噬细胞浸润,但对IL-6和TNF-α的表达无明显抑制作用。可见两种干细胞免疫调控作用涉及复杂的细胞和分子机制。文献[24]报道,经静脉移植NSCs可在免疫器官中富集,抑制T细胞增殖,发挥全身性免疫调节作用,而经颅定向移植NSCs则在脑内发挥局部抗炎、抗凋亡作用。在脑卒中、TBI等急性期,NSCs主要抑制小胶质细胞/巨噬细胞介导的固有免疫应答,而在帕金森、多发性硬化等慢性疾病中NSCs主要抑制由淋巴细胞介导的适应性免疫应答[11]。因此,针对干细胞免疫调控机制的研究,一方面要从信号转导途径入手,另一方面尚需借助基因或蛋白芯片技术以及生物信息学等学科知识,深入到具体的病理环境中比较NSCs与MSCs的作用机制,才能从本质上理解二者在TBI后炎症反应中的调控作用。
| [1] | Rotshenker S. Wallerian degeneration: the innate-immune response to traumatic nerve injury[J]. J Neuroinflammation, 2011, 8: 109. |
| [2] | Normanton M, Feitosa-Ribeiro A A, Kondo A. et al. Mesenchymal stem cell effect on lymphocyte apoptosis is partially contact dependent[J]. J Immunol, 2013, 190: 185-187. |
| [3] | Kokaia Z, Martino G, Schwartz M, et al. Cross-talk between neural stem cells and immune cells: the key to better brain repair?[J]. Nat Neurosci, 2012, 15(8): 1078-1087. |
| [4] | Richardson R M, Singh A, Sun D, et al. Stem cell biology in traumatic brain injury: effects of injury and strategies for repair[J]. J Neurosurg, 2010, 112(5): 1125-1138. |
| [5] | Lundberg J, Sodersten E, Sundstrom E, et al. Targeted intra-arterial transplantation of stem cells to the injured CNS is more effective than intravenous administration: engraftment is dependent on cell type and adhesion molecule expression[J]. Cell Transplant, 2012, 21(1): 333-343. |
| [6] | Han E Y, Chun M H, Kim S T, et al. Injection time-dependent effect of adult human bone marrow stromal cell transplantation in a rat model of severe traumatic brain injury[J]. Curr Stem Cell Res Ther, 2013, 8(2): 172-181. |
| [7] | Sarkaki A R, Khaksari-Haddad M, Soltani Z, et al. Time- and dose-dependent neuroprotective effects of sex steroid hormones on inflammatory cytokines after a traumatic brain injury[J]. J Neurotrauma, 2013, 30(1): 47-54. |
| [8] | Lu J, Frerich J M, Turtzo L C, et al. Histone deacetylase inhibitors are neuroprotective and preserve NGF-mediated cell survival following traumatic brain injury[J]. Proc Natl Acad Sci U S A, 2013, 110(26): 10747-10752. |
| [9] | Wada N, Gronthos S, Bartold P M. Immunomodulatory effects of stem cells[J]. Periodontol 2000, 2013, 63(1): 198-216. |
| [10] | Li W, Ren G, Huang Y, et al. Mesenchymal stem cells: a double-edged sword in regulating immune responses[J]. Cell Death Differ, 2012, 19(9): 1505-1513. |
| [11] | Pluchino S, Gritti A, Blezer E, et al. Human neural stem cells ameliorate autoimmune encephalomyelitis in non-human primates[J]. Ann Neurol, 2009, 66(3): 343-354. |
| [12] | Carpentier P A, Palmer T D. Immune influence on adult neural stem cell regulation and function[J]. Neuron, 2009, 64(1): 79-92. |
| [13] | Lee S T, Chu K, Jung K H, et al. Anti-inflammatory mechanism of intravascular neural stem cell transplantation in haemorrhagic stroke[J]. Brain, 2008, 131(Pt 3): 616-629. |
| [14] | Ramasamy R, Tong C K, Seow H F, et al. The immunosuppressive effects of human bone marrow-derived mesenchymal stem cells target T cell proliferation but not its effector function[J]. Cell Immunol, 2008, 251(2): 131-136. |
| [15] | Zhang R, Liu Y, Yan K, et al. Anti-inflammatory and immunomodulatory mechanisms of mesenchymal stem cell transplantation in experimental traumatic brain injury[J]. J Neuroinflammation, 2013, 10: 106. |
| [16] | Beck K D, Nguyen H X, Galvan M D, et al. Quantitative analysis of cellular inflammation after traumatic spinal cord injury: evidence for a multiphasic inflammatory response in the acute to chronic environment[J]. Brain, 2010, 133(Pt 2): 433-447. |
| [17] | Schwartz M, Shechter R. Protective autoimmunity functions by intracranial immunosurveillance to support the mind: the missing link between health and disease[J]. Mol Psychiatry, 2010, 15(4): 342-354. |
| [18] | Ziebell J M, Morganti-Kossmann M C. Involvement of pro- and anti-inflammatory cytokines and chemokines in the pathophysiology of traumatic brain injury[J]. Neurotherapeutics, 2010, 7(1): 22-30. |
| [19] | Ouyang W, Rutz S, Crellin N K, et al. Regulation and functions of the IL-10 family of cytokines in inflammation and disease[J]. Annu Rev Immunol, 2011, 29: 71-109. |
| [20] | Shlosberg D, Benifla M, Kaufer D, et al. Blood-brain barrier breakdown as a therapeutic target in traumatic brain injury[J]. Nat Rev Neurol, 2010, 6(7): 393-403. |
| [21] | Abdul-Muneer P M, Chandra N, Haorah J. Interactions of oxidative stress and neurovascular inflammation in the pathogenesis of traumatic brain injury[J]. Mol Neurobiol, 2015, 51(3):966-979. |
| [22] | Ransohoff R M, Brown M A. Innate immunity in the central nervous system[J]. J Clin Invest, 2012, 122(4): 1164-1171. |
| [23] | Aggarwal S, Pittenger M F. Human mesenchymal stem cells modulate allogeneic immune cell responses[J]. Blood, 2005, 105(4): 1815-1822. |
| [24] | Bacigaluppi M, Pluchino S, Peruzzotti-Jametti L, et al. Delayed post-ischaemic neuroprotection following systemic neural stem cell transplantation involves multiple mechanisms[J]. Brain, 2009, 132(Pt 8): 2239-2251. |



